脐带间充质干细胞外泌体对大鼠肾间质纤维化的抑制作用
2020-07-23胡玉燕尹磊张晨笑钱晖
胡玉燕, 尹磊, 张晨笑, 钱晖
(江苏大学医学院, 江苏 镇江 212013)
肾间质纤维化几乎是所有慢性肾脏病进展到终末期的病理损伤过程,其主要发生机制为正常伤口愈合的病理性扩展,表现为肌成纤维细胞活化,细胞外基质成分过度沉积以及炎性细胞的大量浸润[1]。目前临床研究中发现一些抗纤维化剂可有效降低甚至逆转纤维化,但针对人类有效的抗纤维化治疗方法仍受到限制[2]。因此,缓解肾脏纤维化是迫切需要解决的一大难题。
外泌体(exosomes)是由细胞分泌的一类直径在30~200 nm的膜性囊泡,富含蛋白质、核酸和脂质等,在细胞外环境中进行信号和分子的交流传递[3]。课题组前期研究发现,人脐带间充质干细胞来源外泌体(human umbilical cord mesenchymal stem cell-derived exosomes,hucMSC-Ex)在肝纤维化、炎性肠病、烫伤皮肤创面愈合、急慢性肾损伤等多种疾病模型中发挥修复作用[4-7]。我们前期研究发现hucMSC-Ex可抑制转化生长因子-β1(transforming growth factor beta-1,TGF-β1)诱导的大鼠肾小管上皮细胞上皮间质转化(EMT)[8],然而,hucMSC-Ex在肾间质纤维化中能否发挥作用尚不清楚。在此基础上,本研究拟采用单侧输尿管结扎法模拟体内单侧输尿管梗阻(unilateral ureteral obstruction, UUO)导致的肾脏纤维化,探讨hucMSC-Ex在大鼠肾纤维化过程中的作用机制。
1 材料与方法
1.1 主要试剂与仪器
α-MEM培养液、特级胎牛血清(以色列Bioind公司);100 kDa MW CO 超滤离心管(MBI公司);外泌体提取试剂(美国SBI公司);细胞蛋白质裂解液RIPA和酶抑制剂(美国Pierce公司);鼠抗人CD9单克隆抗体、兔抗人CD63多克隆抗体及兔抗人CD81多克隆抗体(美国Proteintech公司);兔抗人β-肌动蛋白多克隆抗体、兔抗人TGF-β1多克隆抗体(美国Bioworld公司);鼠抗人α-平滑肌肌动蛋白(α-SMA)单克隆抗体(博士德公司);兔抗人波形蛋白单克隆抗体、兔抗人N-钙黏蛋白多克隆抗体(美国CST公司);兔抗人E-钙黏蛋白多克隆抗体(美国Santa Cruz公司);羊抗鼠IgG二抗、羊抗兔IgG二抗、驴抗兔IgG荧光二抗(美国Invitrogen公司);CO2培养箱(美国Thermo公司); 细胞超净台(苏州净化设备厂);透射电子显微镜(荷兰Philips公司);ImageQuant LAS400mini化学发光成像仪(日本GE公司);倒置式生物显微镜(日本Nikon公司);免疫组织化学染色试剂盒、Masson 染色试剂盒(博士德公司);超声波破碎仪(美国Branson公司)。
1.2 hucMSC-Ex收集、提取和鉴定
脐带标本来源于江苏大学附属四院。根据本实验室前期建立的脐带间充质干细胞培养及外泌体提取方法[9],收集对数生长期hucMSCs的培养上清液。超滤浓缩上清液,加入外泌体提取试剂沉淀,获得hucMSC-Ex,透射电镜观察外泌体形态,蛋白质印迹检测外泌体表面标志CD9、CD63和CD81及纳米流式检测粒径大小,分装保存于-80 ℃。
1.3 UUO模型及治疗模型构建
SD雄性大鼠购于江苏大学实验动物中心,体重180~200 g。按随机数字表法分为假手术组、UUO 组和hucMSC-Ex组,每组6只。UUO组大鼠腹腔注射10%水合氯醛(3 mL/kg)麻醉,经腹部左侧开口,找到输尿管后用4-0手术缝合线进行结扎,之后用2-0手术线进行缝合。假手术组在找到输尿管后不做处理,直接缝合。hucMSC-Ex处理组在术后24 h尾静脉注射250 μg hucMSC-Ex,之后每隔2 d注射1次,共计3次。7 d后处死大鼠,摘取左侧肾脏,用PBS洗净,将肾脏横切一分为二,一半置于4%多聚甲醛固定,用于组织石蜡包埋切片;一半置于-80 ℃保存用于蛋白质检测。
1.4 Masson染色观察肾组织胶原沉积
肾组织石蜡切片首先于65 ℃ 烘箱烤片6 h,依次放入二甲苯15 min/次×2次,100%、95%、90%、80%、75%、70%乙醇各2 min脱蜡,流水冲洗。0.5%碘酒溶液10 min,水洗;0.5%硫代硫酸钠溶液处理5 min,水洗;30%饱和苦味酸乙醇溶液固定30 min,水洗;苏木素染核10 min,充分水洗;玻片烘干后滴加丽春红酸性复红染色液,室温20 min,0.2%冰醋酸水溶液清洗玻片;磷钼酸水溶液分化处理2 min,甩干后苯胺蓝染色5 min;冰醋酸水溶液洗涤。脱水过程为脱蜡的逆过程,方法如上,最后用中性树脂封片,镜下观察。
1.5 HE染色观察肾组织形态结构
石蜡切片脱蜡至水,苏木素染核5 min,充分水洗;甩干后滴加1%盐酸乙醇作用30 s,弃掉溶液后直接滴加1%氨水30 s返蓝,充分水洗;0.5%伊红染液染色90 s,水洗。最后对切片进行脱水处理,中性树脂封片镜下观察。
1.6 免疫组织化学和免疫荧光染色观察肾组织内纤维化相关蛋白表达
石蜡切片脱蜡脱水过程同上。3% H2O2室温孵育10 min,灭活内源性过氧化物酶,组化PBS洗涤3次;枸橼酸盐缓冲液蒸煮30 min进行抗原修复,洗涤3次;然后用5% BSA室温封闭1 h,甩干后直接孵育一抗,一抗稀释比α-SMA(1 ∶ 100),TGF-β1(1 ∶ 100),4 ℃孵育过夜,洗涤3次;滴加二抗,室温孵育30 min,洗涤;滴加SABC,37 ℃ 30 min,洗涤;最后,每张切片滴加DAB显色剂,镜下显色5~10 min,待组织切片出现棕黄色阳性区域后用蒸馏水终止,苏木素染核20 s,流水冲洗后,脱水封片,镜下观察。
脱蜡及孵育一抗同上,一抗稀释比例E-钙黏蛋白(1 ∶ 100)、N-钙黏蛋白(1 ∶ 100)。随后加入 FITC标记的羊抗兔二抗,37 ℃湿盒放置45 min,PBS 洗涤4次,每次5 min;加入Hoechst避光染5 min,PBS 洗涤4次,每次5 min。甘油封片后,荧光显微镜观察拍照。
1.7 蛋白质印迹检测肾脏纤维化相关蛋白
取1 g肾脏组织加入150 μL蛋白裂解液,超声波破碎细胞提取组织蛋白。配制12% SDS-PAGE分离胶,以180 μg上样。80 V恒压电泳至目的条带分离。350 mA恒流转膜2 h,5%脱脂奶粉封闭1 h后孵育一抗,β-肌动蛋白稀释比为1 ∶ 2 000,TGF-β1、波形蛋白、E-钙黏蛋白稀释比均为1 ∶ 500。4 ℃孵育过夜,1×TBST洗涤。加入HRP标记的驴抗兔抗体(1 ∶ 2 000),37 ℃孵育1 h,洗涤。洗涤后采用化学发光成像仪进行凝胶成像。
2 结果
2.1 hucMSC-Ex的观察和鉴定
实验提取的hucMSC-Ex经电子透射电镜观察,外泌体为盘状囊泡(图1A);粒径分布在50~200 nm之间,主要集中在110 nm左右(图1B);蛋白质印迹检测显示hucMSC-Ex表达标志分子CD9、CD63和CD81(图1C)。

A:透射电子显微镜观察hucMSC-Ex形态;B:纳米流式技术分析hucMSC-Ex粒径分布;C:蛋白质印迹检测hucMSC-Ex表面标志
2.2 hucMSC-Ex 对UUO大鼠肾脏结构的影响
SD大鼠结扎7 d,肉眼可见左侧肾脏明显肿大,近肾端输尿管充盈大量炎性液体,并且与周围组织粘连严重。经尾静脉注射hucMSC-Ex干预后,肾脏外观与UUO组相比有明显改善,外观鲜红,表面瘀血减少,坏死区域较少(图2)。
HE染色结果表明,UUO组大鼠肾脏基本结构消失,大量成纤维细胞增生;hucMSC-Ex组大鼠肾脏结构有所改善,肾小管萎缩得到缓解,炎性因子浸润和成纤维细胞增生减少,坏死区域有所减缓(图3)。Masson染色结果显示,假手术组肾脏组织无明显的胶原沉积;UUO组中有被染成蓝色的片状阳性区域,且多分布在肾小管周围,表明有大量的胶原纤维沉积在肾间质;hucMSC-Ex组大鼠肾脏组织蓝色区域明显减少,成条索状分散在少数肾小管周围(图4)。以上结果证明hucMSC-Ex能在UUO诱导的大鼠肾间质纤维化中发挥抑制作用,改善肾脏结构,减少胶原沉积,延缓肾纤维化进展。

图2 输尿管结扎7天大鼠左肾横切面观察
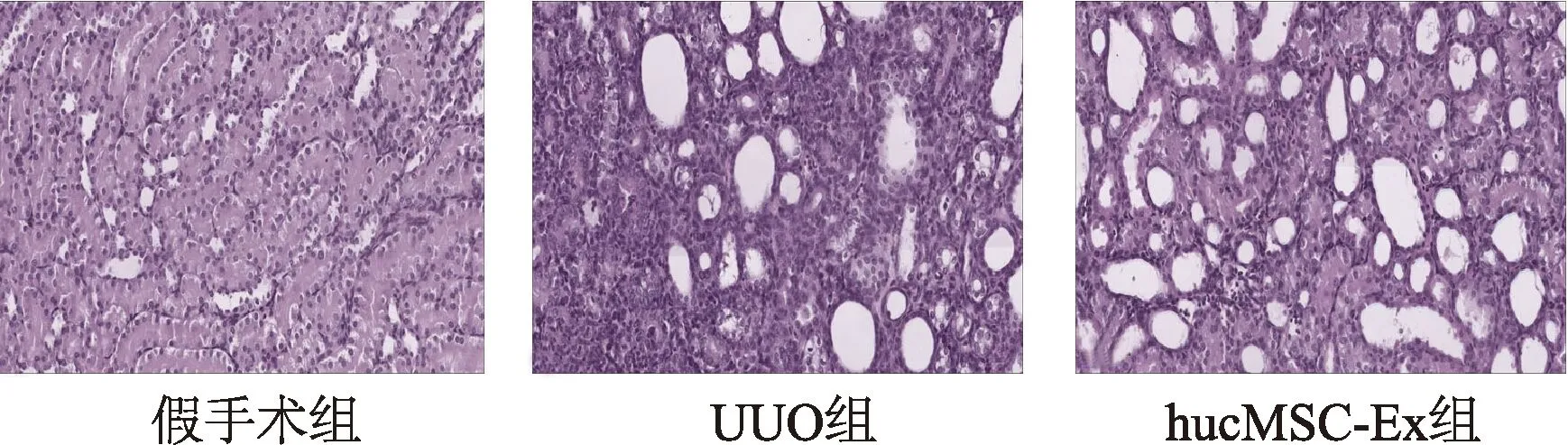
图3 HE染色观察大鼠肾脏组织结构(×400)
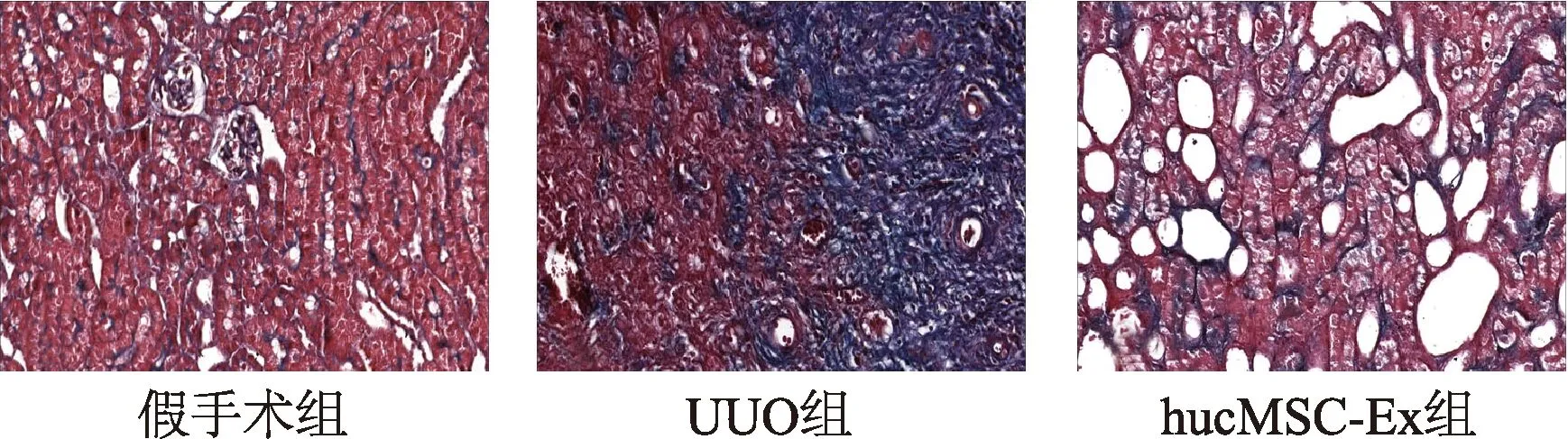
图4 Masson染色观察大鼠肾脏组织胶原沉积(×400)
2.3 hucMSC-Ex对UUO大鼠肾脏组织EMT的影响
免疫组织化学检测α-SMA和TGF-β1在肾组织内的表达,UUO组病变部位有大量的棕黄色阳性颗粒沉积,而hucMSC-Ex组阳性区域明显减少(图5)。蛋白质印迹显示,UUO组TGF-β1和波形蛋白的表达高于假手术组,而E-钙黏蛋白表达下调;hucMSC-Ex组TGF-β1和波形蛋白的表达减少, E-钙黏蛋白含量上调(图6)。免疫荧光检测结果显示hucMSC-Ex能够增加E-钙黏蛋白表达,减弱N-钙黏蛋白表达(图7)。结果表明hucMSC-Ex能够抑制肾间质中TGF-β1等促纤维化因子的表达,并且能够逆转EMT,从而起到保护肾脏的作用。
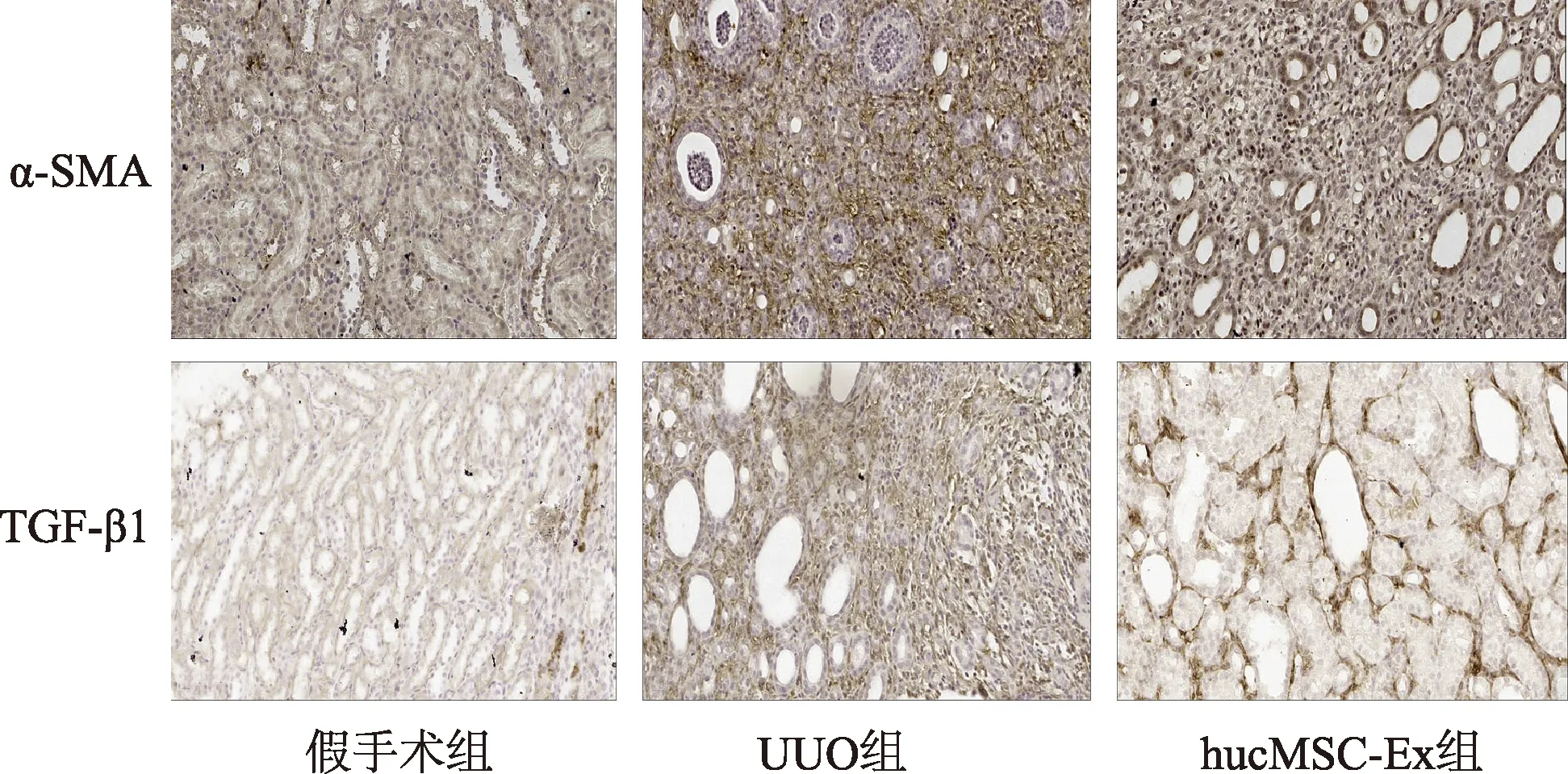
图5 免疫组化检测各组大鼠肾组织α-SMA 和TGF-β1的表达(×400)
3 讨论
干细胞来源的外泌体以其免疫原性低、稳定、可量产等诸多优势,在免疫调节、抗炎和抗纤维化、增强血管再生等方面发挥了重要作用[10]。本研究探讨hucMSC-Ex对大鼠肾间质纤维化的作用,结果显示hucMSC-Ex干预后炎性因子浸润减少,肾间质空泡变性好转,肾小管结构较清晰,提示hucMSC-Ex能够有效缓解输尿管梗阻引起的肾脏炎症和纤维化的进展,改善肾脏的功能。

图6 蛋白质印迹检测各组大鼠肾组织TGF-β1及EMT指标
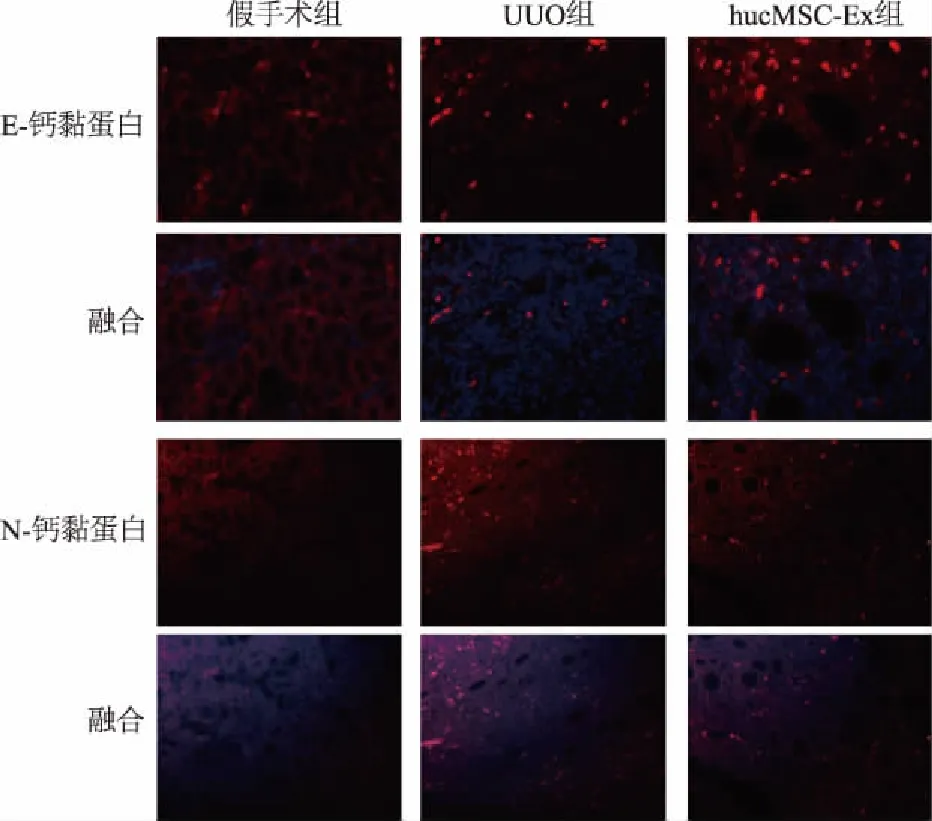
图7 免疫荧光检测肾脏组织E-钙黏蛋白(×400)和N-钙黏蛋白(×200)表达
TGF-β信号通路作为关键介质参与器官纤维化进程,其中TGF-β1被认为是炎症性疾病转变至纤维化的重要细胞因子[11-12]。研究发现,骨髓来源的外泌体可以通过下调TGF-β1调节受损子宫内膜的纤维化修复[13]。本研究中大鼠输尿管梗阻后引起肾组织TGF-β1和α-SMA高表达,hucMSC-Ex处理后能够下调纤维化相关蛋白TGF-β1、α-SMA和波形蛋白的表达。此外,肾小管细胞在损伤状态下能够发生EMT,并通过旁分泌方式显著地促进炎症和纤维形成[14]。损伤发生后,炎症性细胞因子、机械应力或化学(激素类)物质会刺激EMT,研究发现,hucMSC-Ex能够抑制CCL4诱导的肝纤维化中的EMT发生[15]。我们的结果显示,在UUO模型中波形蛋白的表达水平增加,E-钙黏蛋白含量下调,hucMSC-Ex干预能够促进E-钙黏蛋白的表达,抑制波形蛋白的表达。由此表明,hucMSC-Ex可能通过TGF-β信号通路逆转EMT从而延缓肾间质纤维化,提示hucMSC-Ex干预可能成为缓解甚至治疗肾间质纤维化的一种新型疗法。
干细胞外泌体是干细胞旁分泌的一类囊泡,内部包裹多种干细胞独特的基因产物和大量的miRNAs,参与细胞通讯,维持组织内稳态,其中外泌体miRNAs信号传递被认为是细胞间通讯新的方式[16]。研究发现过表达miR-let-7c的工程化骨髓间充质干细胞能够归巢到受损的肾组织并上调miR-let-7c,同时外泌体中摄取大量miR-let-7c抑制TGF-β1受体有效地发挥体外抗纤维化作用[17]。另外肌内注射过表达miR-29的外泌体能够有效缓解UUO诱导的肾纤维化,减少肾脏组织中TGF-β、α-SMA和胶原的表达[18]。为了探索外泌体miRNAs的治疗效果,课题组开展了hucMSC-Ex的miRNAs测序,生物信息学分析显示在hucMSC-Ex中存在大量高表达的miRNAs分子。我们将在后续研究中探究是否存在抑制肾纤维的特异性功能miRNAs,对hucMSC-Ex在肾脏纤维化中抑制TGF-β1逆转EMT的具体机制作进一步探讨。
综上所述,本研究显示hucMSC-Ex能够有效延缓大鼠UUO导致的肾纤维化,但其是否能够抑制人类肾脏纤维化还有待进一步证实。另外,本实验针对的是肾脏纤维化进展前期的干预性治疗,对衰竭中晚期的肾脏是否有缓解作用还需进一步实验。
