DLL3沉默抑制小细胞肺癌细胞系H592的增殖和迁移
2020-07-23周菁郭丽
周菁, 郭丽
(1. 陕西省肿瘤医院肿瘤科, 陕西 西安 710061; 2. 空军第九八六医院干部病房科, 陕西 西安 710054)
小细胞肺癌(small cell lung carcinomas, SCLC)是肺癌的一个亚型,约占肺癌的15%,但其5年生存率仅有1%~2%,明显低于其他类型的肺癌[1]。因此,探讨SCLC转移的分子机制对于预防其复发至关重要。近年来,众多学者对SCLC的病理机制进行了深入探究,并开发了多种治疗SCLC的靶向药物,主要针对Notch信号通路、酪氨酸激酶受体、免疫检查点、凋亡信号通路等相关的靶点[2]。
Notch信号通路激活后可以抑制SCLC癌细胞的增殖与转移。DLL3作为Notch家族的一员,可以抑制Notch信号通路的激活[3]。研究表明,DLL3在SCLC细胞表面呈高度上调,一项临床报道发现83%的SCLC肿瘤患者DLL3呈阳性,其中32%高表达,这表明DLL3可能是治疗该疾病的潜在靶点[4]。目前关于DLL3在SCLC发生、发展中的作用机制研究并不多,最近有报道称DLL3通过调控上皮间质转化(epithelial-mesenchymal transition, EMT)相关蛋白Snail促进癌细胞的迁移和侵袭[5]。本研究通过收集SCLC患者的临床信息,分析DLL3在癌组织与癌旁组织中的表达,并探讨DLL3促进SCLC转移的分子机制。
1 材料与方法
1.1 材料
1.1.1 组织来源 收集陕西省肿瘤医院2017年1月至2018年12月手术切除的SCLC组织及其癌旁组织50例,所有病例经病理学确诊。本研究经由陕西省肿瘤医院伦理委员会批准。
1.1.2 试剂 RPMI-1640培养基、胎牛血清、青霉素和链霉素(美国Gibco公司);SCLC细胞系H592、正常支气管上皮细胞HBE(广州吉妮欧生物科技有限公司);DLL3,MUC-1, Snail, GAPDH抗体(英国Abcam公司);Transwell小室(美国Corning公司);CCK-8试剂盒(北京索莱宝科技有限公司);凋亡检测Annexin V FITC-PI试剂盒(北京欣博盛生物科技有限公司)。
1.2 方法
1.2.1 细胞培养 H592和HBE均培养于含有10%胎牛血清的RPMI-1640培养基,并加入终浓度为1%的青霉素和链霉素,置于37 ℃、5% CO2的培养箱中培养。
1.2.2 免疫组织化学法检测组织中DLL3的表达 组织切片采用二甲苯脱蜡,乙醇脱水,高pH抗原修复液修复抗原。自然冷却后,取出切片,PBS缓冲液冲洗3次,3%过氧化氢封闭30 min,用EDTA抗原提取缓冲液在微波炉中加热切片进行抗原提取。室温下,将切片用10%的山羊血清封闭30 min。加入一抗DLL3抗体4 ℃孵育过夜;滴加HRP偶联的二抗,37 ℃孵育30 min;PBS冲洗,DAB显色,苏木素复染。根据阳性染色细胞比例及染色强度进行打分,将患者分为低表达DLL3(≤3分)组和高表达DLL3(>3分)组。
1.2.3 实时荧光定量PCR检测DLL3、MUC-1的mRNA表达 从获取的SCLC组织以及癌旁组织提取RNA,采用RNAprep Pure动物组织总RNA提取试剂盒提取RNA。从处于对数生长期的SCLC细胞系H592中提取RNA,采用RNAprep Pure培养细胞总RNA提取试剂盒提取总RNA。测量D(260 nm/280 nm)评估RNA的质量。取1 μg RNA作为模板,采用FastKing一步法逆转录-荧光定量试剂盒检测DLL3 mRNA水平,以GAPDH作为内参。反应条件:95 ℃ 3 min预变性;95 ℃ 15 s, 60 ℃ 30 s, 35个循环。DLL3上游引物:5′-CACTCCCGGATGCACTCAAC-3′;下游引物:5′-GATTCCAATCTACGGACGAGC-3′。MUC-1上游引物:TGCCGCCGAAAGAACTACG;下游引物:TGGGGTACTCGCTCATAGGAT。GAPDH上游引物: 5′-CTGACTTCAACAGCGACACC-3′;下游引物:5′-TGCTGTAGCCAAATTCGTTG-3′。每组实验设置3个复孔。
1.2.4 蛋白质印迹检测DLL3、MUC-1、Snail蛋白的表达水平 收集H592细胞,加入RIPA裂解液,冰上裂解30 min。12 000 r/min、4 ℃离心20 min。取上清液采用BCA试剂盒进行蛋白定量分析。每组取50 μg蛋白上样于SDS-PAGE胶上,160 V运行1 h。随后采用湿转法将蛋白转移至PVDF膜上。5%的脱脂奶粉室温封闭1 h,加入一抗DLL3(1 ∶2 000),MUC-1 (1 ∶ 1 000), Snail (1 ∶ 1 000), GAPDH (1 ∶ 5 000) 4 ℃孵育过夜,TBST洗涤3次,二抗室温孵育2 h。ECL发光液曝光、显影。
1.2.5 细胞转染 将H592细胞按照2×105个/孔的密度接种到6孔板中,孵育24 h。采用脂质体LipofectamineTM3000将si-NC、si-DLL3、si-MUC-1转染至H592细胞,操作过程按照说明书进行。转染成功48 h后,收集细胞进行后续实验。
1.2.6 CCK-8实验检测细胞增殖 取处于对数生长期的H592细胞100 μL接种于96孔板中,孵育过夜。向每孔加入10 μL的CCK-8溶液进行增殖实验检测。采用酶标仪测定450 nm处的光密度。测量时间点为0、12、24、48 h。
1.2.7 流式细胞仪检测细胞凋亡 收集转染48 h后的H592细胞用于流式细胞仪检测。500 r/min离心5 min收集H592细胞,PBS重悬;加入3 μL Annexin-V-FITC,轻轻混匀后加入终浓度为1 μg/mL的碘化丙啶,4 ℃避光孵育10 min。离心后100 μL PBS重悬,进行流式细胞仪检测。
1.2.8 Transwell实验检测细胞迁移 将H592细胞以5×104的密度接种于不含血清的RPMI-1640培养基中,取300 μL加入到Transwell小室上层,下层加入含10%胎牛血清的RPMI-1640培养基。孵育48 h后,用棉签将上层小室内的细胞擦去,甲醇和丙酮(1 ∶ 1)固定30 min,结晶紫染色30 min。倒置显微镜下观察细胞迁移数,随机选取10个视野,取平均值。
1.3 统计学分析
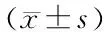
2 结果
2.1 DLL3在SCLC组织及癌旁组织中的表达
免疫组织化学染色结果显示,SCLC组织中DLL3呈现较强的表达,且主要表达于细胞膜上,而癌旁组织中DLL3基本不表达。SCLC组织中DLL3阳性表达率为72%(36/50),其中高表达的有22%。实时荧光定量PCR结果显示,癌组织中DLL3的mRNA表达较癌旁组织显著提高(Z=7.62,P<0.01)。见图1、图2。
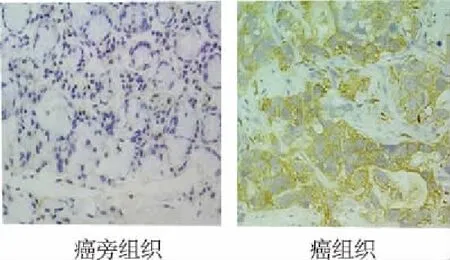
图1 免疫组化染色检测SCLC组织及癌旁组织中DLL3的表达(×200)

图2 实时定量荧光PCR检测SCLC组织及癌旁组织中DLL3的表达
2.2 DLL3在SCLC细胞系H592中的表达
蛋白质印迹和实时荧光定量PCR结果显示,DLL3在H592细胞中的表达水平显著高于HBE细胞(t=21.63,t=43.62,P均<0.01),提示DLL3在SCLC中表达上调。见图3、图4。

图3 蛋白质印迹检测SCLC细胞H592中DLL3的蛋白表达

图4 实时荧光定量PCR检测SCLC细胞H592中DLL3的mRNA表达
2.3 下调DLL3抑制H592细胞增殖、促进凋亡
实时荧光定量PCR结果显示,与si-NC组比较,si-DLL3组DLL3的mRNA表达显著降低(t=79.95,P<0.01)。提示,si-DLL3组中H592细胞的DLL3基因被抑制,可以进行后续实验。见图5。
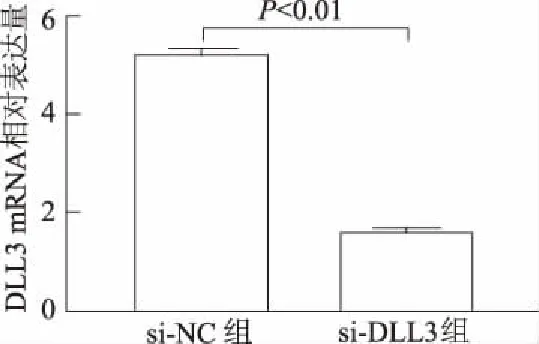
图5 siRNA干扰后H592细胞DLL3 mRNA表达
CCK-8检测H592细胞活力结果显示,与si-NC组比较,在48 h 时si-DLL3组的细胞活力明显降低(t=14.07,P<0.01),而si-NC组与空白对照组间无明显差异。见图6。si-DLL3转染细胞48 h后,流式细胞仪检测结果显示,与si-NC相比,si-DLL3组细胞凋亡能力明显增强(t=133.60,P<0.01);而si-NC组与空白对照组间无明显差异。见图7。

a:P<0.01,与si-NC组比较
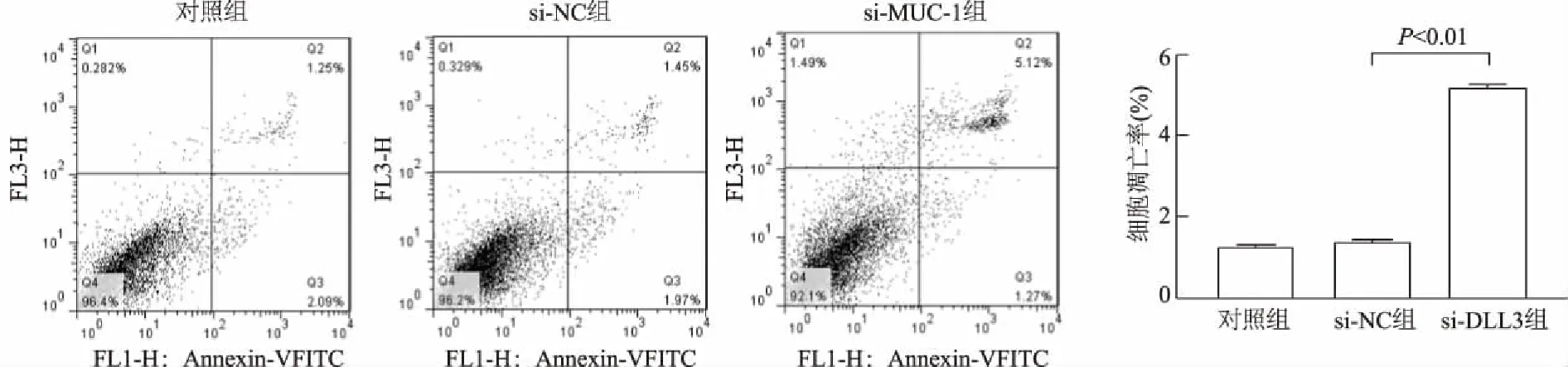
图7 下调DLL3对H592细胞凋亡的影响
2.4 下调DLL3抑制H592细胞迁移
转染48 h后Transwell实验结果显示,si-DLL3组细胞穿膜的垂直迁移能力显著低于si-NC组,差异有统计学意义(t=7.25,P<0.01);而si-NC组与空白对照组间无明显差异。见图8。

图8 下调DLL3对H592细胞迁移的影响(结晶紫染色,×100)
2.5 DLL3与MUC-1表达水平呈显著正相关
蛋白质印迹结果显示,与si-NC组比较,si-DLL3组MUC-1 mRNA蛋白表达明显下调(t=36.13,P<0.01);而Snail蛋白表达无差异(t=0.35,P=0.74)。见图9。
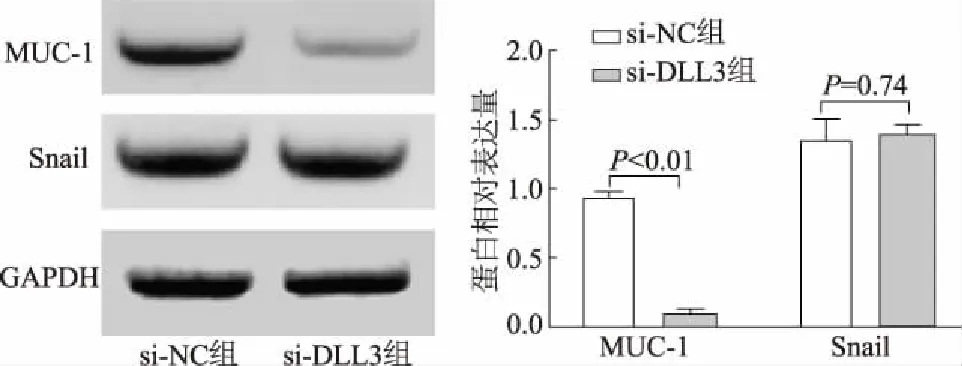
图9 蛋白质印迹检测MUC-1和Snail蛋白的表达
进一步采用实时荧光定量PCR检测MUC-1 mRNA在SCLC组织及癌旁组织中的表达,结果显示与癌旁组织相比,癌组织中MUC-1的mRNA表达水平显著提高(Z=9.63,P<0.01)。见图10。

图10 实时荧光定量PCR检测癌组织及癌旁组织中MUC-1的mRNA表达
Pearson相关性分析显示,在SCLC癌组织中DLL3与MUC-1的mRNA表达水平呈显著正相关(r=0.83,P<0.01)。提示DLL3可能通过调控MUC-1促进SCLC的增殖与迁移。见图11。

图11 MUC-1与DLL3 mRNA表达的相关性
2.6 下调MUC-1抑制H592细胞增殖、迁移,促进凋亡
实时荧光定量PCR结果显示,与si-NC组比较,si-MUC-1组MUC-1的mRNA表达显著降低(t=27.24,P<0.01)。表明si-MUC-1组中MUC-1基因被抑制,可以进行后续实验。见图12。CCK-8检测结果显示,与si-NC组比较,si-MUC-1组24 h(t=5.81,P<0.05)和48 h(t=6.63,P<0.01)的细胞活力均明显降低,而si-MUC-1组与空白对照组间无明显差异。见图13。流式细胞仪检测结果显示,与si-NC组比较,si-MUC-1组细胞凋亡明显增强,差异有统计学意义(t=21.47,P<0.01);而si-NC组与对照组间无明显差异。见图14。Transwell结果显示,与si-NC组比较,si-MUC-1组H592细胞迁移能力明显下降(t=7.58,P<0.01);而si-NC与对照组间无明显差异。见图15。上述结果表明下调MUC-1可以抑制SCLC细胞的增殖、迁移,促进凋亡。

图12 siRNA干扰后H592细胞MUC-1 mRNA表达

a: P<0.05, b: P<0.01,与si-NC组比较

图14 下调MUC-1对H592细胞凋亡的影响

图15 下调MUC-1对H592细胞迁移的影响(结晶紫染色,×100)
3 讨论
SCLC是一种恶性肿瘤,具有生长快、转移早、预后差的特点。目前铂类药物是其主要治疗药物,但几乎所有患者3个月内都会复发。DLL3作为Notch配体抑制剂,在SCLC中通过阻滞Notch信号通路激活来促进癌细胞的增殖扩散。Rova-T是一类靶向DLL3的抗体偶联药物,在SCLC治疗中展现出一定的抗肿瘤效果[6]。DLL3可能是治疗SCLC的靶点,目前关于其在SCLC进展中的分子机制并不明确。
近期有学者指出DLL3高表达的晚期SCLC患者呈现较短的无进展生存期和总生存期;下调DLL3抑制了EMT,导致SCLC细胞的增殖、迁移能力减弱,提示靶向DLL3有助于防止SCLC的转移[7]。但是由于Notch信号通路在不同的肿瘤类型中发挥不同的作用[8],DLL3可能根据不同癌症类型扮演不同的角色,比如在肝癌中发现DLL3启动子甲基化会促进其细胞凋亡,提示DLL3在肝癌中可能是抑癌基因[9]。本研究证实了DLL3在SCLC癌组织中呈现表达上调,DLL3阳性率为72%,高表达率为22%。DLL3下调后能抑制SCLC细胞H592增殖、迁移,促进细胞凋亡。
最近有研究证实在SCLC中DLL3通过调控Snail来促进癌细胞的增殖、迁移与侵袭[5]。本文也分析了DLL3调控SCLC细胞所介导的信号途径,发现敲减DLL3前后Snail表达无明显变化,但与EMT相关的另一个蛋白分子MUC-1的表达出现了明显变化。表明在该细胞系中DLL3有可能通过调控MUC-1促进EMT进程。MUC-1是黏蛋白家族的一员,其过度表达会促进上皮来源的肿瘤细胞获得间质细胞的可迁移能力,即促进EMT进程。目前已证实MUC-1在肺癌[10]、乳腺癌[11]、结直肠癌[12]、胰腺癌[13]和多发性骨髓瘤[14]等表达上调,促进癌细胞的转移。本研究表明,MUC-1在SCLC癌组织中呈高表达,推测在SCLC中DLL3通过调控MUC-1促进EMT进程,从而促进癌细胞的转移。SCLC患者中MUC-1与DLL3表达水平呈显著正相关的结果间接证实了我们的推测。进一步敲减MUC-1,结果发现H592细胞的迁移能力明显降低,表明下调MUC-1可以抑制肿瘤的迁移。
本研究证实了DLL3和MUC-1在SCLC组织中表达上调,敲减DLL3和MUC-1会抑制癌细胞的增殖、迁移,促进凋亡,推测在SCLC中DLL3通过调控MUC-1促进EMT进程,从而促进癌细胞的转移。
