粉防己碱对人结直肠癌HCT116细胞株生物功能的影响及其机制
2020-07-23王月霞张治进张玉浩傅骏秦贤举
王月霞, 张治进, 张玉浩, 傅骏, 秦贤举
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 上海市第八人民医院胃肠外科, 上海 200235)
结直肠癌占肿瘤发病率10.2%,死亡率仅次于肺癌,占全球癌症相关死亡9.2%[1]。化疗是结直肠癌辅助治疗的重要策略之一。天然产物因具有生物友好性和较好的治疗效果,在肿瘤化疗药物研发领域得到越来越多关注[2-3]。粉防己碱是一种可用于肿瘤化疗的天然生物碱,其作为传统中药在治疗矽肺、关节炎和高血压等疾病中发挥重要作用[4-7]。近来,关于粉防己碱的抗肿瘤作用得到广泛研究,其主要通过靶向多条信号通路抑制肿瘤细胞增殖和诱导凋亡,如通过介导细胞内线粒体途径及胞外死亡受体途径诱导前列腺癌细胞凋亡[8];通过上调细胞周期蛋白依赖性激酶抑制剂p21诱导肺癌细胞凋亡[9];通过介导caspase依赖的细胞凋亡途径抑制口腔癌细胞增殖[10]等;但关于粉防己碱对肿瘤细胞迁移的影响还不清楚。HCT116是一种以侵袭迁移为特征的人结直肠癌低分化细胞株,具有干细胞特性[11]。本研究旨在探讨粉防己碱对高恶性人结直肠癌HCT116细胞株生物功能的影响及其可能机制。
1 材料与方法
1.1 主要材料
人结直肠癌HCT116细胞株(中国科学院上海生物化学研究所);DMEM、胎牛血清、青霉素、链霉素和胰酶(美国Gibco公司);粉防己碱(美国Selleck公司);CCK-8试剂(日本Dojindo公司);Annexin V细胞凋亡检测试剂(美国BD公司);线粒体膜电位检测试剂盒(JC-1)和Hoechst 33342细胞核染色液(上海碧云天生物公司);Transwell小室(美国Corning公司);SDS-PAGE凝胶试剂盒(上海生工生物公司);PVDF膜(美国Millipore公司);兔单克隆抗体E-钙黏蛋白、N-钙黏蛋白、波形蛋白、磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase, PI3K)、蛋白激酶B(PKB/AKT)、磷酸化蛋白激酶B(p-AKT)、核因子激活的B细胞κ 轻链增强蛋白(NF-κB)、磷酸化NF-κB(p-NF-κB)均为美国CST公司产品;兔单克隆抗体GAPDH(英国Abcam公司);HRP标记的羊抗兔二抗(美国Jackson公司)。
1.2 方法
1.2.1 细胞培养 HCT116细胞培养于含10%胎牛血清和1%青、链霉素的DMEM中,于37 ℃,5% CO2和饱和湿度的培养箱中常规培养。
1.2.2 CCK-8检测细胞活力 将对数期细胞以7×103/孔密度接种于96孔板,培养24 h;以二甲基亚砜为对照,分别加入100 μL不同浓度的粉防己碱(2.5、5、10、20、40和80 μmol/L)继续培养24 h;每孔加入10 μL CCK-8试剂,每组设置5个复孔,37 ℃孵育2 h;酶标仪测定450 nm处吸光度,计算细胞存活率及粉防己碱半数抑制浓度(semi inhibition concentration,IC50)。后续实验均将对数期HCT116细胞接种于6孔板,孵育过夜;次日,以二甲基亚砜为对照,小于IC50粉防己碱(2.5、5、10 μmol/L)处理细胞后,对应实验检测粉防己碱对细胞生物功能的影响。
1.2.3 克隆形成实验测定细胞增殖能力 粉防己碱处理细胞48 h;胰酶消化,PBS清洗后收集细胞,以300个/孔密度接种于6孔板,每组设置3个复孔,培养14 d,在此期间,每3 d更换一次新鲜培养基;待克隆细胞长至合适大小时终止培养, 4%低聚甲醛固定细胞30 min;0.1%结晶紫染色20 min;拍照后Image J软件计数。
1.2.4 流式细胞术测定细胞分布周期和凋亡 粉防己碱处理细胞24 h;胰酶(不含EDTA)消化,PBS清洗后收集细胞;取部分细胞用70%乙醇4 ℃固定2 h;25 μL碘化丙锭常温避光孵育30 min;流式细胞仪分析细胞周期分布;同时,根据Annexin V凋亡检测试剂盒说明书,用300 μL 1×结合缓冲液重新悬浮剩余细胞,加入5 μL Annexin V-FITC混匀,避光孵育15 min;加入5 μL碘化丙锭避光孵育5 min;流式细胞仪检测细胞凋亡;每组设置3个复孔,每次至少计数10 000个细胞。
1.2.5 荧光染色检测细胞早期凋亡 粉防己碱处理细胞24 h;PBS洗涤;分别加入1 mL 线粒体膜电位检测试剂JC-1 和Hoechst 33342染色工作液,每组设置3个复孔,37 ℃孵育20 min;PBS洗涤后荧光显微镜下观察细胞并拍照。
1.2.6 Transwell实验检测细胞迁移能力 粉防己碱处理细胞24 h;胰酶消化,PBS清洗后无血清培基重悬细胞,分别以3×104/孔密度接种至Transwell小室,下室加600 μL含5%胎牛血清的培养基,每组设置3个复孔,37 ℃培养22 h,4%多聚甲醛固定细胞30 min,0.1%结晶紫染色20 min,PBS清洗,显微镜观察拍照,Image J软件计数。
1.2.7 划痕实验测定细胞迁移能力 粉防己碱处理细胞24 h;PBS清洗后枪头垂直划痕,控制划痕宽度在300~500 μm之间,PBS清洗划落细胞,更换无血清培基继续培养,分别在划痕后0、48和72 h观察拍照,Image J软件计算迁移面积。
1.2.8 蛋白印迹实验分析蛋白表达水平 粉防己碱处理细胞48 h;收集细胞,RIPA裂解液提取蛋白,BCA测定蛋白浓度;蛋白煮沸变性;配制10% 分离胶及浓缩胶;加样后,以70 V恒压,再以120 V恒压行SDS-PAGE分离蛋白;恒流350 mA,4 ℃ 2 h半干电转法将蛋白转至PVDF膜;5%脱脂奶粉室温封闭2 h;4℃孵育抗体过夜(实验用一抗稀释浓度均为1 ∶ 1 000);TBST洗涤后常温孵育二抗1 h(HRP羊抗兔1 ∶ 1 000);TBST洗涤后ECL显色,凝胶成像系统曝光,每组实验重复3次。
1.3 统计学分析
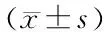
2 结果
2.1 粉防己碱降低HCT116细胞活力
CCK-8实验结果显示,细胞存活率随粉防己碱处理浓度的增加而降低, 粉防己碱对HCT116细胞抑制效应呈现剂量-效应关系。见图1。其在HCT116细胞24 h的IC50为9.441 μmol/L,故后续实验以二甲基亚砜为对照,分别检测2.5、5、10 μmol/L粉防己碱对细胞生物功能的影响。

*:P<0.05,与0 μmol/L组比较
2.2 粉防己碱抑制HCT116细胞增殖
细胞集落形成实验结果显示,细胞集落数随粉防己碱处理浓度增加而减少,与0 μmol/L组相比,2.5、5和10 μmol/L粉防己碱处理组形成集落数明显减少(t=9.134,13.51,16.64,P均<0.05)。流式细胞仪分析结果显示,与0 μmol/L组相比,5 μmol/L和10 μmol/L 粉防己碱处理组G0/G1期细胞比例明显增加(t=10.06,21.49,P均<0.05),而S期(t=7.212,21.54,P均<0.05)和G2/M期(t=12.39,25.26,P均<0.05)细胞比例明显下降。见图2。
2.3 粉防己碱诱导HCT116细胞凋亡
流式细胞术检测结果显示,与0 μmol/L组相比,5和10 μmol/L粉防己碱处理组细胞凋亡比率增加(t=2.969,23.96,P均<0.05)。见图3。荧光染色检测细胞早期凋亡结果显示,线粒体膜电位荧光强度随粉防己碱处理浓度增加而增强。Hoechst 33342细胞核染色结果显示,粉防己碱处理组细胞核荧光增强,标志着粉防己碱处理组细胞早期凋亡增多。见图4。
2.4 粉防己碱抑制HCT116细胞迁移
迁移实验结果显示,与0 μmol/L组相比,2.5、5、10 μmol/L粉防己碱处理组迁移至下室的细胞数目明显减少(t=9.057,18.69,19.35,P均<0.05)。见图5。划痕实验结果显示,粉防己碱对HCT116细胞迁移抑制呈现剂量-时间-效应关系,与0 μmol/L组相比,5和10 μmol/L粉防己碱处理组细胞48 h划痕修复率明显降低(t=4.187,5.260,P均<0.05),2.5、5、10 μmol/L粉防己碱处理细胞72 h划痕修复率降低(t=5.182,6.376,8.329,P均<0.05)。见图5。
2.5 粉防己碱可能通过抑制PI3K/AKT/NF-κB通路逆转细胞上皮间质转化
显微镜下观察显示,与0 μmol/L组相比,经10 μmol/L粉防己碱处理的HCT116细胞多呈圆形,有更多上皮细胞形态,而未经加药处理的细胞多呈梭形间充质形态。见图6。蛋白印迹结果显示,与0 μmol/L组相比,2.5、5和10 μmol/L粉防己碱处理组细胞上皮间质转换(Epithelial-mesenchymal transition,EMT)标志蛋白表达水平改变:上皮标志物E-钙黏蛋白表达明显增加(P均<0.05),而间充质标志蛋白N-钙黏蛋白和波形蛋白表达明显减少(P均<0.05)。见图7。进一步检测PI3K/AKT/NF-κB通路中关键蛋白的表达水平,结果显示,与0 μmol/L组相比,2.5、5、10 μmol/L粉防己碱处理组细胞通路中关键分子p-AKT(t=22.89,34.88,23.58,P均<0.05)和p-NF-κB(t=24.30,26.12,28.89,P均<0.05)表达水平均明显降低,表明其活化受到抑制。见图8。

*:P<0.05,与0 μmol/L组比较A:细胞克隆形成实验结果;B:流式细胞仪检测细胞周期实验结果

*:P<0.05,与0 μmol/L组比较

A:线粒体膜电位检测结果(100×,50 μm);B:Hoechst 33342细胞核染色结果(100×,50 μm)

A:迁移实验结果(100×);B:划痕实验结果(100×);*:P<0.05,与0 μmol/L组比较

图6 粉防己碱对HCT116细胞形态的影响(100×)
3 讨论
既往研究表明,粉防己碱可通过抑制肿瘤细胞增殖和诱导凋亡来发挥抗癌活性,如其通过Bcl-2/Caspase3/PARP途径使结直肠癌HT29细胞株阻滞于G1/S期,进而诱导肿瘤细胞凋亡[12];也有研究发现其通过上调TGF-β1来抑制PTEN磷酸化,从而抑制结直肠癌细胞增殖[13]。本研究结果显示,粉防己碱能抑制人结直肠癌HCT116细胞增殖,使细胞停滞于G0/G1期,诱导细胞凋亡。肿瘤细胞不受抑制的增殖常伴有细胞周期失调[14]。由此说明粉防己碱可能通过阻滞细胞周期,进而抑制肿瘤细胞增长和诱导细胞凋亡。但粉防己碱是否影响结直肠癌HCT116细胞株其他生物学行为,如迁移、EMT、肿瘤相关信号转导通路的激活等还需要进一步研究。

*:P<0.05,与0 μmol/L组比较

*:P<0.05,与0 μmol/L组比较
细胞迁移是恶性肿瘤细胞转移的重要步骤,抑制肿瘤细胞迁移是防止恶性肿瘤细胞转移的前提和基础。本研究结果显示,小于IC50的粉防己碱能显著抑制HCT116细胞迁移。多项研究证实,EMT与肿瘤细胞增殖、迁移、侵袭、抗凋亡等多项恶性表型相关[15]。EMT是指上皮细胞在一些因素作用下,失去细胞极性,丢失细胞间紧密连接和黏附连接,转变成具有间质细胞形态和特性的细胞;不适当的EMT参与促进肿瘤细胞浸润转移,使肿瘤细胞逃逸某些因素诱导的凋亡,获得肿瘤干细胞样特性[15-16]。HCT116细胞多呈梭形间充质形态,以侵袭迁移为特征,有着EMT标志性变化[11]。本研究结果显示,小于IC50的粉防己碱能上调HCT116细胞上皮标志物E-钙黏蛋白的表达,同时下调间充质性标志物N-钙黏蛋白和波形蛋白表达。由此提示,粉防己碱可能通过逆转HCT116细胞EMT,进而降低细胞迁移能力。
研究表明,PI3K/AKT信号通路广泛参与调节肿瘤细胞多项生物学行为,在促进和维持肿瘤恶性表型方面起关键作用[17]。为进一步探究粉防己碱影响HCT116细胞生物功能的分子机制,本实验利用蛋白印迹技术检测小于IC50的粉防己碱对细胞PI3K/AKT信号通路中关键分子表达水平的影响,结果显示,该通路中关键分子p-AKT活化明显受到抑制。研究证实,NF-κB是活化的AKT重要的下游靶点之一,参与调控多种生物进程,如姜黄素通过抑制NF-κB信号逆转乳腺癌细胞EMT,抑制肿瘤细胞转移[18];乌苯美司通过抑制PI3K/AKT/NF-κB通路的激活,抑制胃癌细胞增殖[19]。本研究结果显示,粉防己碱能下调HCT116细胞中p-NF-κB表达水平,由此推测粉防己碱可能通过抑制PI3K/AKT/NF-κB通路抑制肿瘤细胞的恶性表型,但其影响肿瘤细胞生物功能的具体分子靶点仍需进一步探索。
综上,本实验证明粉防己碱可能通过抑制PI3K/AKT/NF-κB 信号途径,逆转HCT116细胞EMT,进而降低细胞增殖迁移能力,诱导细胞凋亡。
