脑缺血再灌注模型大鼠miR133b-3p表达及意义
2020-07-23徐琛刘竞丽
徐琛, 刘竞丽
(广西医科大学第一附属医院神经内科, 广西 南宁 530000)
miRNA是一种短链非编码小RNA,与靶基因mRNA 3′UTR端相互作用,阻止其翻译[1]。研究报道,miR124在脑中高表达,可激活PI3K/AKT/mTOR通路,参与缺血性脑卒中发生[2]。在外周神经损伤后不同时间鞘内注射miR133b-3p,可防止或逆转神经病理性疼痛,如机械性疼痛或寒冷性疼痛[3]。另有报道证实表没食子儿茶素没食子酸酯能够改善脂多糖诱导的大鼠慢性阻塞性肺疾病, 通过调控肺 miR133a/b-3p 和 TGF-β1/Smad3 水平,抑制氧化应激和炎症[4]。关于miR133b-3p在缺血性脑灌注损伤后的表达及机制尚不明确,本研究通过高通量测序选出大鼠脑缺血再灌注损伤后差异表达的miR133b-3p并通过qRT-PCR验证其表达,通过双荧光素酶靶点验证报告证实miR133b-3p与bcl2l2的靶向调控关系。
1 材料与方法
1.1 材料
1.1.1 实验动物 28只成年雄性SD大鼠250~300 g,购自广西医科大学动物实验中心,动物合格证编号:SYXK桂2014- 0003。随机均分为假手术组和脑缺血再灌注组,每组14只。每组取造模后任意12只行神经行为学评分;5只行TTC染色;6只行qRT-PCR实验;3只行Tunnel实验。实验通过广西医科大学动物伦理委员会批准。
1.1.2 试剂与仪器 佳灵线栓(广州佳灵生物技术有限公司);动物麻醉机(深圳瑞沃德生物技术有限公司);异氟烷(北京友诚生物技术有限公司);TTC染色液(大连美仑生物技术有限公司);Trizol(美国Life公司);逆转录试剂盒,实时荧光定量PCR检测试剂盒,大鼠miR133b-3p验证引物均为广州复能生物技术有限公司产品;Tunnel试剂盒、蛋白酶K(瑞士Roche公司);人肾胚293T细胞(广州锐博生物技术公司实验室);DMEM,胰酶均为美国Gibco公司产品;Lipo6000TM转染试剂(上海碧云天生物技术有限公司);pmiR-RB-Report载体(广州锐博生物技术有限公司);分光光度计(美国Promega公司)。
1.2 脑缺血再灌注模型建立
将大鼠置于麻醉机诱导盒,异氟烷诱导麻醉3 min,期间异氟烷浓度维持在1.5%~1.8%;然后将大鼠固定于平板上,分离颈总动脉、颈内动脉、颈外动脉,结扎颈总动脉近心端,并且结扎颈外动脉与颈内动脉分叉处;在颈总动脉剪一小口,插入线栓到分叉处约18 mm,用缝线结扎血管切口,缝合皮肤;2 h后拔除线栓;脑缺血再灌注组再灌注24 h,假手术组分离肌肉组织,仅显露血管。
1.3 动物造模的评判
1.3.1 神经行为学评分 两组在再灌注24h后按照文献[5]进行神经行为学评分:0分,无神经行为学症状;1分,爪子弯曲;2分,向对侧转圈;3分,向对侧倾倒;4分,不能行走,无意识。
1.3.2 梗死体积测量 断头取脑组织于-20 ℃冷冻20 min;冠状面切片,依次切5片,厚度约2 mm;2% TTC染液37 ℃避光孵育20~30 min;每10 min晃动切片;数码相机拍照;用IPP6.0软件计算梗死体积,按照文献[6],梗死体积百分率计算公式:(对侧半球体积-非梗死同侧半球体积)/对侧半球体积×100%。
1.4 梗死中心区脑组织TUNNEL染色检测细胞凋亡率
两组在再灌注24 h后分别予以4%低聚甲醛灌注,取视交叉前后约2 mm脑组织;4%低聚甲醛固定24 h;石蜡包埋后切3 μm薄片;二甲苯脱蜡,5 min/次,2次;90%乙醇,80%乙醇,70%乙醇脱水,各10 min;蛋白酶K 37 ℃消化30 min;PBS洗涤,玻片干后加入TUNNEL反应液,37 ℃孵育1 h;PBS洗3次;与DAB反应;以苏木精染色细胞核。显微镜下(×100)随机取3个视野观察脑梗死中心区,细胞计数取平均值,阳性细胞核为棕色,阴性细胞核为蓝色,根据凋亡阳性细胞与细胞总数比值计算细胞凋亡率。
1.5 实时荧光定量PCR检测miR133b-3p表达
用Trizol从脑梗死中心区组织中提取总RNA;取1 μg在20 μL 体系中行逆转录,反应条件:37 ℃ 60 min,85 ℃持续5 min,4 ℃保存。用逆转录模板行qRT-PCR反应:95 ℃变性30 s,95 ℃变性10 s,65 ℃退火延伸30 s,40个循环。熔融曲线分析参数: 95 ℃ 15 s,60 ℃ 1 min。每个PCR混合物含2 μL逆转录反应产物,4 μL 5×BlazeTaqqPCR混合物,0.1 μL ROX 参考染料,加无酶水至20 μL。miR133b-3p特异引物:5′-TCCCCTTCAACCAGCTAA-3′,使用5S RNA为miRNA内参。每个样本重复3次。采用2-ΔΔCt法计算miR133b-3p相对表达。
1.6 miR133b-3p靶基因预测
利用靶基因数据库(miRWalk和target scan)查找miR133b-3p对应的与凋亡相关的靶基因。
1.7 质粒构建
从大鼠基因组DNA的PCR中扩增包含miR133b-3p结合位点的bcl2l2基因的3′UTR序列,然后克隆至pmiR-RB-Report报告载体的SgfⅠ/XhoⅠ位点。使用以下引物组产生特异性片段:正向,5′-GCACTGCGATCGCTTCTTTTGAAGCCATCCATG-3′,反向,5′-GCGCTCGAGCCCTGAACCCCGATACATAA-3′。
1.8 双荧光素酶分析
实验分为2组:野生型bcl2l2+miR133b-3p模拟物组,野生型bcl2l2+miR133b-3p模拟物阴性对照组;人肾胚293T细胞于37 ℃,5%CO2常规培养;取对数生长期293T细胞,以1.0×104/孔细胞密度接种于96孔板,每孔100 μL,于37 ℃培养24 h;取5 μL opti-MEM稀释miR133b-3p模拟物或阴性对照,靶基因 3′UTR双报告基因载体或突变载体,5 μL opti-MEM稀释 0.25 μL转染试剂,分别静置5 min,二者混合,轻轻摇匀,静置 5 min;每孔加入90 μL培养基,再加入上述10 μL 混合液。其中,miR133b-3p模拟物转染浓度均为 50 nmol/L,质粒浓度为 50 ng/孔,每组设 3个复孔,转染 6 h;更换培养液,转染 48 h;每孔加入35 μL PBS和35 μL Luciferase底物,振荡10 min,转移至96孔板,测定荧光值。
1.9 统计分析
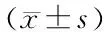
2 结果
2.1神经行为学评估和脑梗死体积比较
由图1可见,脑缺血再灌注组神经行为学评分明显高于假手术组(Z=-4.365,P<0.01)。肉眼观,TTC染色显示脑缺血再灌注组有梗死灶(白色为梗死组织),假手术组无梗死灶。脑梗死再灌注组梗死体积百分率约为(32.42±16.3)%,见图2。

图1 各组大鼠神经行为学评分
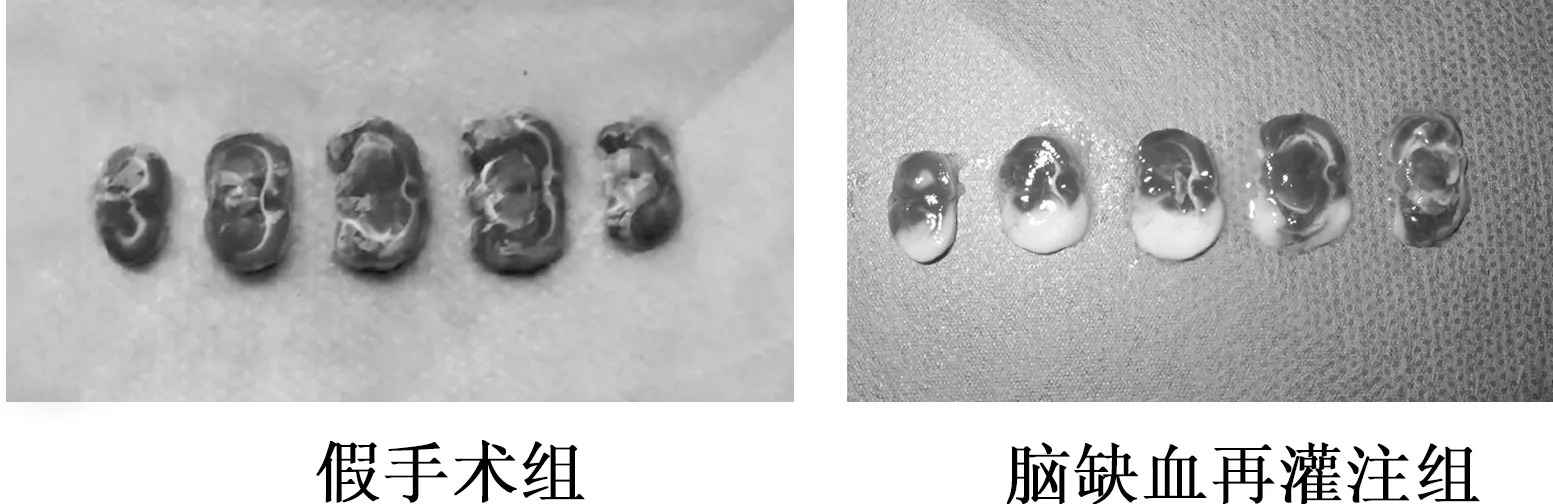
图2 两组大鼠脑组织TTC染色
2.2 脑梗死中心区细胞凋亡率比较
由图3可见,脑缺血再灌注组和假手术组大鼠脑梗死中心区均可见凋亡细胞;脑缺血再灌注组细胞凋亡率明显高于假手术组(t=-4.232,P<0.05),表明脑梗死后细胞凋亡明显。

图3 脑梗死中心区细胞凋亡率(×100,TUNNEL染色)
2.3 miR133b-3p在脑梗死组织中的表达
由图4可见,脑缺血再灌注组中miR133b-3p表达量较假手术组明显降低(t=4.91,P<0.01)。

图4 qRT-PCR检测miR133b-3p表达量
2.4 miRNA靶基因预测与功能分析
靶基因数据库预测结果显示,miR133b-3p可能与凋亡相关的靶基因为bcl2l2。
由图5可见,野生型bcl2l2+miR133b-3p模拟物组荧光强度明显低于野生型bcl2l2+miR133b-3p模拟物阴性对照组(t=5.295,P<0.05)。由此表明,bcl2l2可能是miR133b-3p靶基因。

图5 双荧光素酶靶点验证报告结果
3 讨论
本研究显示大鼠脑缺血再灌注损伤后miR133b-3p表达明显降低;此外,再灌注24 h脑梗死面积明显增大,神经行为学评分升高,细胞凋亡数增多,提示miR133b-3p可能参与脑缺血再灌注损伤后细胞凋亡。
研究表明,bcl2l2与其家族成员bcl-2功能类似,参与肿瘤发病[7]。另有研究证明,在细胞毒性条件下,bcl2l2可以抑制细胞凋亡,提高细胞存活率[8]。研究证实bcl2l2是与凋亡相关的靶基因,且与缺血性心脏病细胞凋亡相关[9]。此外,bcl2l2在脑缺血发病中发挥重要作用,过表达bcl2l2可逆转miR-29b诱导的神经元凋亡,miR-29b通过抑制bcl2l2,在一定程度上促进神经元死亡[10]。本研究中通过生物学信息技术分析miR133b-3p可能与凋亡相关的靶基因,双荧光素酶靶点验证报告提示转染miR133b-3p后,相对荧光强度明显下调(P<0.05),表明miR-133b-3p通过调控与凋亡相关的靶基因bcl2l2在脑缺血再灌注损伤模型中发挥作用。
综上所述,miR-133b-3p是一种新的与凋亡相关调控因子,可能通过与靶基因bcl2l2结合,参与缺血性脑梗死的发生。
