自噬核心蛋白ATG101对米色脂肪细胞分化和产热的影响
2020-07-23马静远李少博杨迪白宁宁米日阿依阿里木江杨颖韩峻峰
马静远, 李少博, 杨迪, 白宁宁, 米日阿依·阿里木江, 杨颖, 韩峻峰
(上海交通大学附属第六人民医院内分泌代谢科, 上海 200233)
脂肪组织是调节机体能量稳态的关键器官。当其功能失调,无法适当扩展以存储多余的能量时,会导致胰岛素抵抗以及异位脂肪沉积[1]。哺乳动物体内主要存在白色脂肪细胞和棕色脂肪细胞。其中,白色脂肪细胞主要存储多余的三酰甘油,而棕色脂肪细胞则有助于能量利用和产热[2-4]。近年来研究发现小鼠皮下白色脂肪组织中还存在第三类脂肪细胞—米色脂肪细胞:在基础条件下分子和形态特征与白色脂肪细胞相似,但是当暴露于低温或受到β-肾上腺素刺激时,可以表达棕色脂肪细胞的标志性基因[5-7],如解偶联蛋白1(uncoupling protein 1,Ucp1),PR结构域蛋白16(PR domain-containing 16,Prdm16)等。米色脂肪细胞的基本特征是可以响应外部刺激而对产热基因程序产生动态调节。通过遗传和药理学方法选择性激活米色脂肪细胞的产热作用,可以缓解肥胖和胰岛素抵抗[8-9]。研究表明自噬诱导的线粒体更新对于体内米色脂肪细胞的功能维持和能量消耗至关重要[10-11]。
自噬相关基因101(autophagy related gene 101,ATG101)于2009年被两个独立的课题组分别发现并命名[12-13],在哺乳动物肝脏、脂肪、心脏、脑、肠等组织和器官中广泛表达。编码人类ATG101的基因定位于染色体12q13.13,cDNA全长7 573 bp,编码蛋白含218个氨基酸。ATG101的氨基酸链N端有一HORMA结构域,可以与自噬相关基因13(autophagy related gene 13,ATG13)的C端HORMA结构域形成稳定的异二聚体[14-15]。ATG101和ATG13的稳定结合有助于维持unc-51样激酶1(unc-51 like kinase 1,ULK1)自噬起始复合体的稳定性,该复合物在自噬的启动阶段可以响应营养变化,并将其他下游ATG蛋白募集到自噬体结构中[16-18],因此,ATG101对自噬过程的正常进行十分关键。自噬对脂肪组织中营养代谢变化高度敏感,而ATG101在脂肪细胞中的作用尚未得到充分探索。本研究以小鼠的血管基质细胞(stromal vascular fraction,SVF)为研究模型,通过慢病毒介导shRNA敲减Atg101基因,在细胞水平上观察ATG101在米色脂肪细胞增殖、分化中的作用,并探究其对米色脂肪细胞产热功能的影响,以期为深入研究ATG101在脂肪组织重塑中的作用提供理论线索。
1 材料与方法
1.1 主要材料
12只6周龄雄性C57BL/6J小鼠(上海斯莱克实验动物有限公司);DMEM、胎牛血清(美国Gibco公司);3-异丁基-1-甲基黄嘌呤、地塞米松、罗格列酮、三碘甲状腺原氨酸、胶原酶(美国Sigma公司);胰岛素(常规优泌林,美国Lilly公司);Trizol试剂(美国Invitrogen公司);RIPA裂解液、蛋白酶抑制剂PMSF和BCA蛋白定量试剂盒(上海碧云天公司);油红O储液(美国Sigma公司);引物(上海生物工程有限公司);逆转录和SYBR Premix ExTaq(南京Vazyme公司);兔源性ATG101单克隆抗体,鼠源性β-微管蛋白单克隆抗体(美国Cell Signaling Technology公司);兔源性UCP1多克隆抗体(美国Abcam公司);鼠源性GAPDH多克隆抗体(上海康城生物公司)。
1.2 方法
1.2.1 SVF向米色脂肪细胞诱导分化 6只6周龄C57BL/6J雄性小鼠过量麻醉处死,取皮下脂肪,缓冲液反复冲洗后,剪至肉糜状,胶原酶37℃振荡消化30 min,冰上放置20 min后2 400 r/min离心10 min。弃去上清液,加入DMEM后再次离心去除上清液,所得沉淀即为SVF,加入DMEM吹打均匀后铺板。
用含10%胎牛血清的DMEM培养SVF细胞,细胞生长至接触抑制后,加入诱导液A(10%胎牛血清的DMEM含0.5 mmol/L 3-异丁基-1-甲基黄嘌呤、1.7 μmol/L胰岛素、1 μmol/L地塞米松、10 μmol/L罗格列酮、10 nmol/L三碘甲状腺原氨酸),隔天更换诱导液B(10%胎牛血清的DMEM含1.7 μmol/L胰岛素、10 μmol/L罗格列酮、10 nmol/L三碘甲状腺原氨酸),之后继续使用诱导液B培养,直至出现大量脂滴。
1.2.2 慢病毒侵染敲减Atg101 含有shATG101载体的慢病毒购自上海吉凯基因。使用感染复数(MOI)35侵染SVF,阴性对照病毒作为对照组。侵染48 h后在荧光显微镜下观察绿色荧光蛋白阳性的细胞数量来评估感染效率,通过实时定量PCR和蛋白质印迹评估Atg101的敲减效率。确定敲减成功后,进行细胞传代并诱导分化为成熟米色脂肪细胞,用于之后的实验。
1.2.3 实时定量PCR测定米色脂肪细胞成脂和产热标志基因mRNA表达 分别收取诱导分化不同时间的细胞,使用Trizol试剂抽提RNA,经逆转录成为cDNA,并由PCR试剂盒进行扩增。引物序列如下:Atg101上游5′-ATGAACTGTCGATCAGAAGTGC-3′,下游5′-CCTATGGAGTACGTGCCCT-3′;Ucp1上游5′-AGGCTTCCAGTACCATTAGGT-3′,下游5′-CTGAGTGAGGCAAAGCTGATTT-3′;脂肪酸结合蛋白4(Fabp4)上游5′-AAGGTGAAGAGCATCATAACCCT-3′,下游5′-TCACGCCTTTCATAACACATTCC-3′;Prdm16上游5′-CAGCACGGTGAAGCCATTC-3′,下游5′-GCGTGCATCCGCTTGTG-3′;葡萄糖转运体4(Glut4)上游5′-GTGACTGGAACACTGGTCCTA-3′,下游5′-CCAGCCACGTTGCATTGTAG-3′;诱导细胞死亡DNA片断化因子α样效应因子(Cidea)上游5′-TGACATTCATGGGATTGCAGAC-3′,下游5′-CATGGTTTGAAACTCGAAAAGGG-3′;36B4上游5′-AAGCGCGTCCTGGCATTGTCT-3′,下游5′-CCGCAGGGGCAGCAGTGGT-3′。PCR反应体系10 μL:cDNA 1 μL,上下游引物各0.4 μL,SBYR Premix ExTaq5 μL,去离子水3.2 μL。PCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸15 s,共45个循环。以36B4作为内参,计算目的基因mRNA的相对拷贝数2-△△Ct。
1.2.4 蛋白质印迹法检测ATG101、UCP1蛋白的表达 细胞总蛋白采用RIPA裂解液提取,经BCA蛋白定量试剂盒测蛋白浓度,最后95℃加热变性。取10 μg蛋白样本进行SDS-PAGE,将蛋白湿转至硝酸纤维素膜,用5%脱脂牛奶(TBST配制)封闭1 h,一抗稀释比例均为1 ∶ 1 000,4 ℃孵育过夜。次日TBST洗3次,每次10 min,辣根过氧化物酶标记的抗兔(鼠)二抗按1 ∶ 2 000比例稀释,室温孵育1 h后TBST洗3次,每次10 min。最后用Image Quant凝胶图像分析仪成像。
1.2.5 油红O脂滴染色 敲减Atg101后分化第6天的米色脂肪细胞弃掉培养基后,用预冷的PBS冲洗细胞2次,然后用4%多聚甲醛固定15 min,用PBS洗涤2次后,稀释好的油红O工作液室温孵育20 min,用双蒸水冲洗3次,然后直接用显微镜(Nikon)观察。
1.3 统计学处理
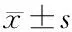
2 结果
2.1 ATG101的表达随米色脂肪细胞分化逐渐增加
在SVF细胞诱导分化为成熟米色脂肪细胞的过程中,实时定量PCR结果显示,Atg101mRNA表达水平从分化第2天起逐渐增加,并在分化第8天达到最高,与分化第0天相比,升高了约6倍(图1A)。分化过程中细胞裂解物的蛋白质印迹结果表明,ATG101的蛋白表达水平在分化过程中逐渐增加(图1B)。
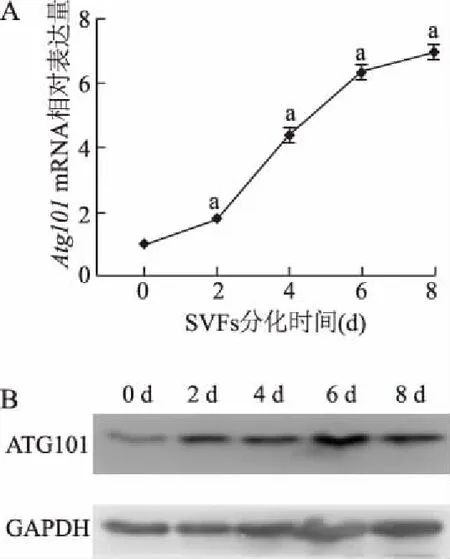
A:米色脂肪细胞分化过程中Atg101 mRNA表达;B:米色脂肪细胞分化过程中ATG101蛋白的表达。a:P<0.01,与0 d比较
2.2 Atg101敲减抑制米色脂肪细胞的成脂分化
慢病毒介导的shRNA在米色脂肪细胞分化过程中有效地降低了ATG101的表达,见图2。
分化第6天的米色脂肪细胞油红O染色显示,ATG101下调后导致分化的米色脂肪细胞中脂质积累减少(图3A)。在分化第6天,实时定量PCR的结果表明,成熟米色脂肪细胞标志基因Fabp4的表达降低至对照组的0.57,Cidea降低至0.46,而Glut4降低至0.68(P<0.01和P<0.05,图3B)。因此,ATG101在细胞水平上参与前脂肪细胞向成熟米色脂肪细胞的分化成脂过程。

A:蛋白质印迹; B:实时定量PCR;C:Atg101敲减后米色脂肪细胞分化第6天的绿色荧光(×100倍)。

A:Atg101敲减后米色脂肪细胞分化第6天的油红O染色(×100倍);B:Atg101敲减后成熟米色脂肪细胞标志基因的mRNA表达。a:P<0.01,b:P<0.05,与对照组比较
2.3 Atg101敲减抑制脂肪细胞产热过程
实时定量PCR结果显示,Atg101下调后在米色脂肪细胞分化早期Prdm16的表达降低,成熟棕色脂肪细胞标志基因Cidea和Ucp1显著下调。在敲减Atg101后,UCP1蛋白水平也明显下调,与mRNA变化一致,见图4。上述结果初步表明,下调Atg101可以部分影响小鼠皮下脂肪组织中米色脂肪细胞的产热过程。
3 讨论
自噬作为真核细胞中主要的降解途径,可以清除多余和受损的细胞器,回收利用细胞质,以适应营养条件的变化并参与维持细胞稳态[19-20]。之前关于自噬的研究主要集中在神经退行性疾病和肿瘤等方面,自噬与能量代谢的关系鲜有涉及。近来有研究指出脂肪分化过程可能是代表自噬活性极高的生理过程之一。在脂肪细胞诱导分化后的第6天,电子显微镜下的超微结构显示,分化细胞的胞质体积中有5%以上是自噬体[21]。自噬与脂肪细胞分化和功能密切相关,Singh等[22]发现在3T3-L1前脂肪细胞敲除自噬相关基因Atg7后,脂质合成减少、自噬功能抑制、脂肪细胞分化相关蛋白表达减少;而Baerga等[23]通过敲除自噬相关基因Atg5后得到了类似的结果,提示自噬参与脂肪细胞的正常分化过程。因此,自噬在脂肪细胞的分化、脂质代谢等方面发挥着重要作用。本研究结果表明ATG101在米色脂肪细胞分化期间表达增加,在SVF细胞敲减Atg101并诱导分化后,米色脂肪细胞的分化明显受损,脂质沉积减少。其确切机制尚不清楚,推测可能是Atg101的缺失导致了ULK1自噬起始复合物形成抑制,自噬活动清除多余或受损细胞器的功能部分受损,从而影响了脂肪细胞分化过程。
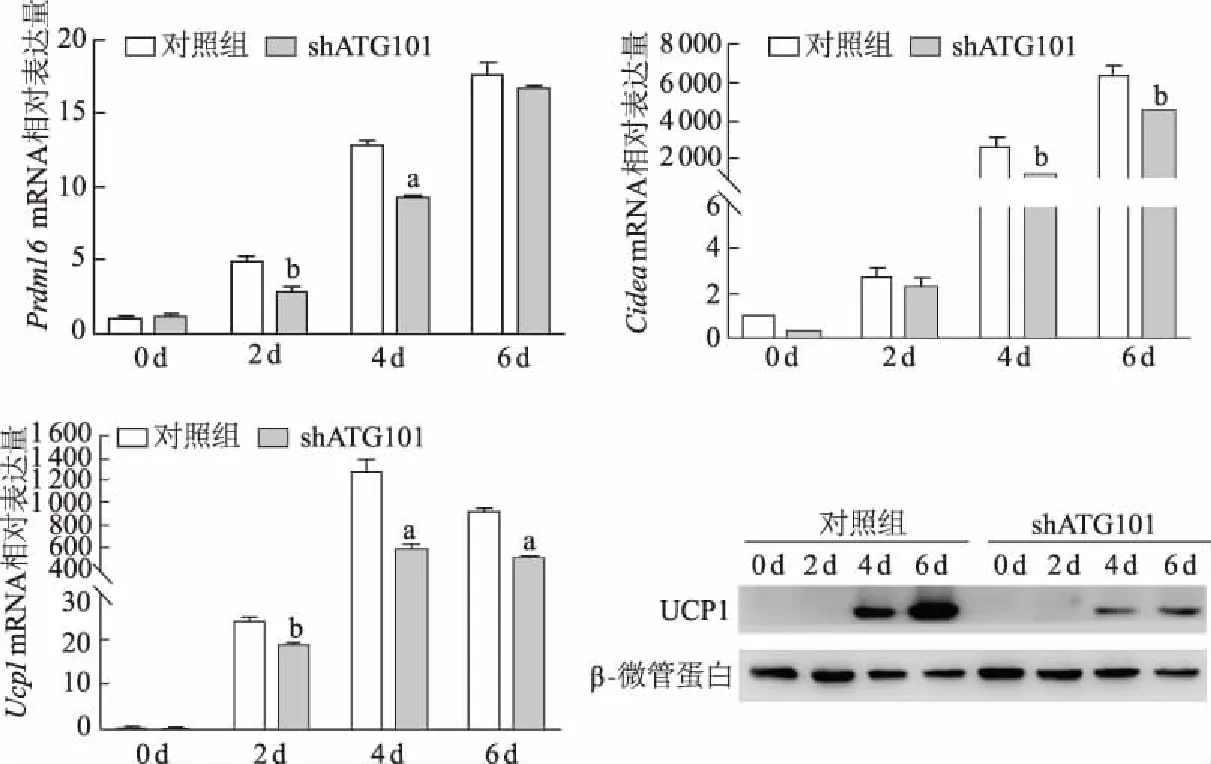
a:P<0.01,b:P<0.05,与对照组比较
白色脂肪细胞肥大、增生和(或)米色、棕色脂肪细胞萎缩、发育不全会导致脂肪因子分泌、游离脂肪酸释放、脂质代谢和产热功能受损,均与肥胖发生发展密切相关。最近有研究在肥胖和糖尿病患者白色脂肪细胞中观察到过度自噬,机体高血糖状态会引起脂肪组织自噬增加[24];自噬激活后会吞噬线粒体,米色或棕色脂肪细胞则转化为白色脂肪细胞[11]。通过脂肪组织特异性敲除Atg5或Atg7后,可有效改善小鼠肥胖表型[23,25],这说明机体可以通过调节自噬活性以适应不同代谢状况,来确保脂肪组织代谢和功能平衡,从而预防糖尿病和肥胖症等代谢性疾病的发生。通过白色脂肪细胞棕色化增加能量消耗治疗肥胖及其并发症成为新的研究热点[26-27]。Prdm16作为米色脂肪细胞重要的转录因子,可激活棕色脂肪特异性基因,是维持棕色脂肪组织活性和白色脂肪组织中米色脂肪细胞生成所必需的[28];Ucp1在产生ATP的氧化代谢解偶联中发挥关键作用[29],Cidea则可以促进脂肪细胞脂解和产热,这些都是米色脂肪细胞产热的标志性基因。本研究中ATG101在米色脂肪细胞分化过程中的表达增加,通过shRNA体外敲减Atg101后,Ucp1、Prdm16和Cidea水平显著下调,提示米色脂肪细胞的产热过程受到抑制。表明ATG101的表达变化与米色脂肪细胞的产热过程密切相关。
总之,本研究结果表明ATG101在米色脂肪成脂分化和产热过程中可能发挥重要作用,这为剖析自噬在脂肪重塑过程中的作用提供了新证据。但未来还需要进行在体实验以深入探讨ATG101对于维持机体能量稳态和参与肥胖发生等病理过程的调节作用。ATG101可能参与脂肪组织的重塑并调节机体代谢,解析其表达调控网络有望为研发肥胖症防治药靶开启新路径。
