白细胞介素35和白细胞介素37与结直肠癌临床病理学特征及预后的相关性研究
2020-07-21陈飞儿谈振宇夏庆华包士三董志恒
陈飞儿,张 凤,谈振宇,夏庆华,包士三,陶 琨,董志恒
1.北华大学医学院病理教研室,吉林 吉林 132000;
2.上海交通大学医学院附属同仁医院病理科,上海 200336;
3.上海市长宁区疾病预防控制中心,上海 200050
结直肠癌(colorectal cancer,CRC)在中国男性癌症死亡率中排第5位,女性癌症死亡率中排第4位[1]。城市的发病率高于农村地区,经济较发达地区的发病率较高[1]。有研究显示,宿主免疫在肿瘤发生中起着重要作用[2],炎症性肠病中持续存在的肠道炎症会显著增加CRC的患病风险[3-4]。白细胞介素(interleukin,IL)-12家族的成员IL-35为抗炎因子,IL-1家族的成员IL-37同样也是一种抗炎因子[5]。最新研究显示,IL-35具有强烈抑制免疫细胞的功能,并且在溃疡性结肠炎中起到减轻结肠组织炎症损伤的作用[6],血清中IL-37水平升高与卵巢癌患者的不良预后相关[7]。但IL-35和IL-37的表达水平是否与CRC的发展有关、是否可以作为CRC患者术后生存的独立预测指标,仍有待研究。
本研究应用免疫组织化学(immunohistochemistry,IHC)染色法将191例CRC患者的癌组织与匹配的切缘组织(即非癌组织)染色,并运用Image-Pro Plus软件将IHC染色阳性部分进行定量分析,结合随访结果,探讨CRC组织与非癌组织中IL-35和IL-37表达水平与CRC临床病理学特征及预后的相关性,探究IL-35和IL-37在CRC诊断和治疗中的意义。
1 资料和方法
1.1 实验对象
1.1.1 患者临床病理学资料
收集2013—2017年在上海交通大学医学院附属同仁医院接受治疗的CRC患者术后的病理学组织蜡块和临床资料,并排除黏液腺癌。因为黏液腺癌在显微镜下呈现为大片黏液,在IHC染色中没有特异性。
1.1.2 实验组与对照组的选取
收集CRC患者191例,将其中CRC癌组织作为实验组,同一患者的形态学正常的手术切缘组织作为对照组,切缘组织距离肿瘤>5 cm。对照组的总例数为141例。
1.1.3 随访
随访资料来源于上海市长宁区疾病预防控制中心,在收集到的191例CRC患者中,共获得了76例患者的随访信息。截至2018年5月,随访到的患者信息如下:51例患者生存,25例患者死亡,在这些CRC患者中,最长的生存时间为53个月。
1.1.4 患者肿瘤大小分组和年龄分组中间值的选择
选取肿瘤直径5 cm作为CRC患者分组的中间值,是影响患者5年生存率和5年局部复发率的独立因素[8],因此本次实验选择5 cm作为CRC患者分组的中间值。有研究[9]表明,CRC患者诊断的中位年龄约为70岁,因此本次实验选择70岁作为分组的中间值。
1.2 主要试剂与仪器
IL-35抗体(编号ab131039)购自英国Abcam公司,IL-37抗体(编号ab57187)购自英国Abcam公司,兔血清购自武汉博士德生物工程有限公司,DAB显色液购自丹麦DAKO公司,苏木精购自珠海贝索生物科技有限公司,EDTA修复液购自丹麦DAKO公司,Olympus BX63光学显微镜购自日本Olympus公司。
1.3 组织芯片的制作
由两名有高级职称的病理科医师在显微镜下复习档案切片,并对比蜡块确定CRC组织实验组和非癌组织对照组的代表性区域(以下称为癌组织和非癌组织)。由病理科技师从石蜡块中取出直径2.0 mm的代表性区域的组织,放入预制蜡块中,制成组织芯片。将制好的组织芯片于80 ℃烤箱高温处理10 min后进行切片。切片厚度为4 μm。将H-E染色切片的镜下形态与原选定区域进行对比,形态高度一致则为最终的组织芯片。
1.4 IHC染色
将制备好的组织芯片切片后,按顺序进行烤片,67 ℃烘箱2 h;脱蜡,二甲苯5 min,梯度乙醇100%、95%、80%中振洗1 min。修复:PT Link抗原修复仪,EDTA修复液,30 min。阻断:0.3% H2O2,室温下温育30 min。封闭:兔血清浓度1∶1000,室温下温育30 min。加一抗,IL-35浓度1∶12000,IL-37浓度1∶300,室温下温育30 min。加二抗,HRP标记的鼠兔通用二抗聚合物,1∶1对倍稀释,室温下温育30 min。显色、复染、脱水干燥封片[10-11]。
1.5 拍照
将IHC染色后的组织切片置于Olympus BX63光学显微镜下拍照,物镜为60倍空气镜。每张芯片中的每个组织拍30~40张图片。调整拍摄全程中显微镜的光源为日光色温的白色光,保证显微镜光源稳定。使用手动控制曝光时间,保持拍照全程曝光一致。使用同样的显微镜工作条件(室内温度、光线等)与相机工作条件,一次性拍摄完所有照片。
1.6 Image-Pro Plus 9.1软件量化IHC染色
选取拍摄图片上带有IHC染色阳性色调的区域为目标区域,测量该区域的累计吸光度(D)值,选择并测量有效统计区域的面积,计算平均D值,计算同一块组织上的各照片的平均值及标准差,用统计学方法分析各个实验组的平均D值之间差异是否有统计学意义,以每组所拍照片的平均值作为最终量化后的数值[12-13]。
1.7 生存分析中高表达组与低表达组截断值的判定
将76例随访患者CRC组织中IL-35和IL-37的表达量分别进行排序,选择中位数作为区分高表达组与低表达组的截断值(IL-35的截断值为2.23×103,IL-37的截断值为0.98×105)。癌组织中IL-35或IL-37的表达量高于中位数的CRC患者为高表达组;癌组织中IL-35或IL-37的表达量低于中位数的CRC患者为低表达组。
1.8 统计学处理
使用Mann-WhitneyU检验法对两组进行比较,使用GraphPad Prism 7软件绘制柱状图;使用Kaplan-Meier方法、GraphPad Prism 7软件绘制生存曲线,并通过log-rank检验法进行检验;使用COX比例风险模型对影响患者预后的因素进行单因素和多因素生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 CRC患者的临床病理学信息
本实验共收集191例CRC患者,其中男性120例,女性71例。年龄范围24~94岁,且主要集中于62~78岁(四分位数:25%~75%),总体年龄偏大(<60岁,n=37/191)。按照CRC的病理组织学分类标准[14],高分化的患者例数为7例,中分化为146例,低分化为38例。在进行IL-37与CRC相关性的研究中由于组织芯片切片后位点丢失,漏掉3例患者的非癌组织。IL-35和IL-37 IHC染色量化后的数据均呈现偏态分布,因此使用中位数±四分位数间距来反映数据情况,详细信息见表1。
2.2 IL-35和IL-37在CRC组织和非癌组织中表达量的差异分析
在非癌组织中,IL-35和IL-37的表达主要定位于肠黏膜上皮细胞的细胞质中(图1C~D)。与非癌组织相比,CRC组织中的IL-35蛋白的表达相对较弱,并在分化较差癌细胞的细胞质和细胞核中呈扩散式分布(图1G)。与非癌组织相比,CRC组织中的IL-37蛋白的表达相对较强,并在分化较差癌细胞的细胞质和细胞核中呈扩散式分布(图1H)。
与非癌组织相比,CRC组织中IL-35的表达量减少了50%(图2A)。CRC组织与非癌组织中IL-35蛋白表达量的差异有统计学意义(P<0.0001)。与非癌组织相比,CRC组织中IL-37的表达量增加了40%(图2B)。CRC组织与非癌组织中IL-37蛋白表达量的差异有统计学意义(P=0.012)。
2.3 CRC组织中IL-35和IL-37的表达量与CRC患者生存时间的生存曲线分析
癌组织中IL-35高表达组与低表达组在CRC患者的生存率中有差异,IL-35高表达组的CRC患者的生存率相对高;IL-35低表达组的CRC患者的生存率相对低,并且当生存天数<800 d时,高表达组与低表达组之间的差距最为明显,但整体差异无统计学意义(P=0.18,图3A)。癌组织中IL-37高表达组与低表达组在CRC患者的生存率中同样有差异,IL-37高表达组的CRC患者的生存率相对高;IL-37低表达组的CRC患者的生存率相对低,并且在生存时间>500 d后,其离散趋势十分明显,但整体差异无统计学意义(P=0.14,图3B)。

表1 CRC患者的临床病理学信息Tab.1 Clinical pathology information of CRC patients
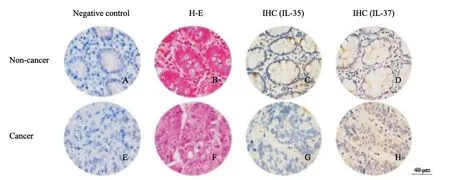
图1 CRC癌组织和非癌组织的阴性对照组、H-E染色以及IL-35和IL-37的IHC染色Fig.1 IHC staining of negative control groups,H-E staining and IHC staining of IL-35 and IL-37 in CRC tissues and non-cancerous tissues The bar represented 40 μm
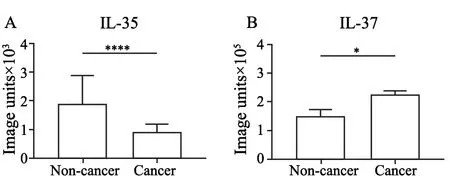
图2 IL-35和IL-37在CRC组织与癌组织之间表达的差异Fig.2 Difference in expression of IL-35 or IL-37 between non-cancerous tissues and CRC tissues
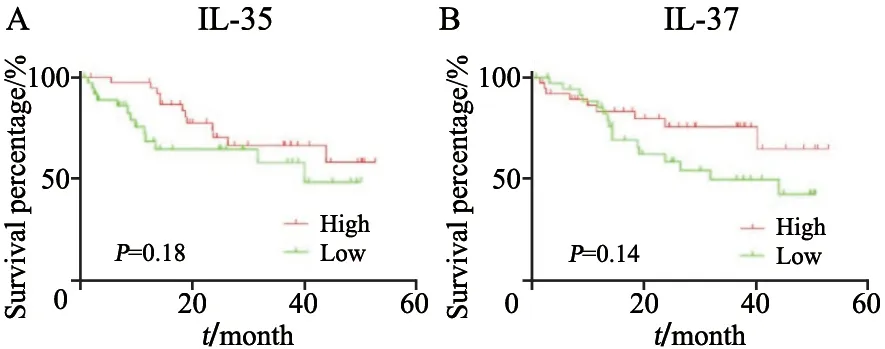
图3 CRC组织中IL-35和IL-37的表达量与CRC患者生存时间的生存曲线Fig.3 Survival curves of the relationship between the expression of IL-35 or IL-37 in CRC tissues and the survival time among CRC patients
2.4 CRC患者癌组织中IL-35和IL-37的表达量与其他临床病理学特征的单因素和多因素生存分析
单因素生存分析中显示,淋巴结转移(HR=2.80,95% CI:1.25~6.25,P=0.01)、肿瘤侵袭深度(HR=2.89,95% CI:1.25~6.70,P=0.01)及TNM分期(HR=2.48,95% CI:1.46~4.23,P=0.001)均为可以作为CRC患者预后的预测指标。IL-35(HR=0.59,95% CI:0.27~1.29,P>0.05)不能作为CRC患者预后的预测指标。
多因素生存分析中显示,IL-35(HR=0.39,95% CI:0.16~0.97,P=0.04)、肿瘤侵袭深度(HR=2.42,95% CI:1.05~5.60,P=0.04)是CRC患者术后生存的独立预测指标。其他因素如IL-37、性别、年龄、肿瘤大小、淋巴结转移、肿瘤分化及TNM分期在CRC的多因素分析中无显著差异(表2)。
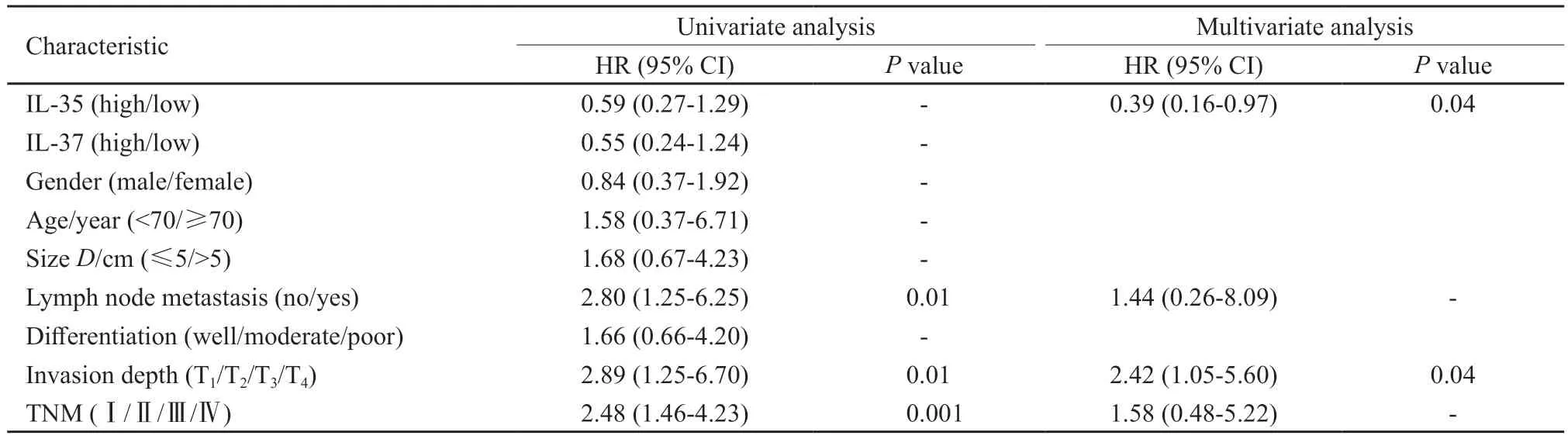
表2 CRC患者癌组织中IL-35和IL-37表达量与其他临床病理学特征的单因素和多因素生存分析表Tab.2 Univariate and multivariate analysss of IL-35,IL-37 and clinicopathological factors affecting survival of patients with CRC
3 讨 论
与健康人群相比,炎症性肠病患者发生CRC的风险更高,并且肠炎的病程长和广泛性是炎症性肠病患者最终患有CRC的危险因素[15-16]。炎症性肠病中持续存在的肠道炎症会显著增加CRC的风险,并且结肠炎演变而来的CRC的存活率比普通CRC患者低[17]。
CRC的进展会受到癌细胞和肿瘤微环境之间复杂相互作用的影响。免疫细胞对肿瘤进展的影响已在各种癌症类型中广泛报道[18]。免疫细胞可以具有肿瘤抑制作用并在免疫监视和平衡期控制肿瘤生长,同时,肿瘤进展也可以由慢性炎症诱导,刺激癌细胞的增殖并促进血管生成和转移[19]。
IL-35与肿瘤进展及预后的关系尚未得到充分证明。在本实验研究结果中,IL-35蛋白在CRC组织中的表达量比非癌组织减少了50%,提示IL-35在CRC组织中的作用可能与抑制肿瘤细胞生长有关。当IL-35表达水平高时,可能通过诱导G1期细胞周期停滞等功能,从而抑制CRC的发生,而IL-35表达水平降低,使IL-35在CRC组织中抑制肿瘤细胞生长的功能减弱,从而导致了CRC的进展。
本研究结果显示,CRC组织中IL-35和IL-37的高表达均可能有利于CRC患者术后生存时间的延长,这可能与IL-35和IL-37作为抗炎因子,其高表达有利于患者术后恢复有关。Mohammed等[20]也认为抗炎药物的应用有助于CRC患者术后的治疗。但在本研究中,CRC组织中IL-35和IL-37表达量的高低与患者术后生存时间的差异无统计学意义,这可能是由于随访的患者数量较少所致。
本研究结果显示,CRC组织中IL-37的蛋白表达量在单因素与多因素生存分析中均不是影响患者术后生存时间的因素。而IL-35的蛋白表达量在单因素生存分析中不显著,但在多因素生存分析中可以作为影响CRC患者生存时间的独立因素。其原因可能是在统计分析中IL-35的真实作用在单因素分析中被其他临床病理学特征掩盖,因此其在单因素生存分析中差异无统计学意义。而通过多因素分析去除其他影响因素后,显现出了IL-35的蛋白表达量对CRC患者术后生存时间的真实作用,即IL-35可能是CRC患者术后生存的独立预测指标。
总之,IL-35和IL-37的表达水平在CRC癌组织与非癌组织中存在差异。癌组织中IL-35的表达水平可能是CRC患者术后生存的独立预测指标。
