头颈部弥漫大B细胞淋巴瘤患者临床特征及预后模型分析研究
2020-07-21
上海交通大学医学院附属第九人民医院血液内科,上海 200011
头颈部弥漫大B细胞淋巴瘤(head and neck diffuse large B-cell lymphoma,HN-DLBCL)是起源于头颈部淋巴结或结外淋巴组织的侵袭性恶性淋巴瘤[1]。局限性低危HN-DLBCL患者采用含有利妥昔单抗免疫化疗方案可以取得良好疗效,但仍有部分患者在缓解后短期内复发或对标准免疫化疗治疗应答欠佳而成为复发/难治性病例[2]。近年来临床研究[3-5]显示,早期发现这些可能成为复发/难治性病例的高危HN-DLBCL患者给予新型靶向药物、造血干细胞移植以及嵌合抗原受体T淋巴细胞输注等细胞免疫疗法,这些高危患者的缓解率和无病生存率可以显著提高。因此,寻找HN-DLBCL患者预后影响因素并建立有效甄别高危患者的预后模型有其必要性和重要临床意义。已有研究[6-8]显示,在免疫化疗时代,改良国际预后指数(International Prognosis Index,IPI),包括美国国家综合癌症网络-IPI(National Comprehensive Cancer Network-IPI,NCCN-IPI)和西班牙淋巴瘤/自体骨髓移植工作组-IPI(GELTAMO-IPI),与传统IPI比较,其区分高危DLBCL患者具有一定优势,但有关改良IPI在HN-DLBCL患者应用的系统比较研究仍鲜有报道。鉴于此,本研究回顾性分析134例HNDLBCL患者的临床特点与其预后相关性,并比较IPI、NCCN-IPI和GELTAMO-IPI的分层能力。
1 资料和方法
1.1 研究对象
本研究纳入2010年1月—2018年12月上海交通大学医学院附属第九人民医院血液内科收治的134例HN-DLBCL患者,其中男性91例,女性43例,中位年龄64岁(19~93岁),纳入标准:①病理学检查符合2008年世界卫生组织(World Health Organisation,WHO)造血和淋巴组织肿瘤诊断标准[9];② 原发为头颈部淋巴结或结外淋巴组织或累及并以该解剖部位病变为首发临床表现;③临床和随访资料完整;④ 接受免疫化疗和(或)局部放射治疗。排除标准:①既往有造血和淋巴组织肿瘤;② 妊娠或哺乳期患者;③来院就诊后短期失访患者。
1.2 临床资料采集
采集患者临床资料主要包括:患者年龄、性别、B症状(发热、盗汗、乏力)、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分、合并症、病理学标本免疫组织化学分型(参照Hans分型标准)、淋巴瘤细胞Ki-67增殖指数和Bcl-2表达、临床分期、结外受累情况、血清乳酸脱氢酶(lactate dehydrogenase,LDH)和β2微球蛋白(β2 microglobulin,β2-MG)水平、乙型肝炎病毒表面抗原(hepatitis B virus surface antigen,HBsAg)表达情况以及治疗方式。
1.3 治疗方法
134例HN-DLBCL患者中单纯化疗109例,25例患者化疗后序贯累及野放疗(19例接受了适形调强放射治疗,6例接受普通放射治疗,放疗剂量30.0~50.0 Gy)。化疗方案主要为R-CH(D)OP(利妥昔单抗+环磷酰胺+表多柔比星/脂质体多柔比星+长春新碱+泼尼松)或CH(D)OP。
1.4 预后分层
按照淋巴瘤IPI、NCCN-IPI和GELTAMO-IPI的计分标准对所有HN-DLBCL患者进行危险度分层,共分为低危、低-中危、中-高危和高危组,其中IPI和NCCN-IPI评估因子包括年龄、Ann-Arbor临床分期、ECOG评分、LDH水平和结外累及情况,而GELTAMO-IPI用β2-MG水平替代结外累及情况作为预后评估因子[6-8]。
1.5 统计学处理
采用SPSS 22.0软件包对数据进行统计分析,计量资料以表示,计数资料以率和构成比表示;无进展生存期(progression-free survival,PFS)定义为从确诊到疾病进展、复发或随访结束,总生存期(overall survival,OS)定义为从确诊到患者因任何原因死亡或随访结束,应用Kaplan-Meier法计算OS和PFS并绘制生存曲线,并以log-rank检验进行生存率组间比较和单因素分析,多因素分析采用COX回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 临床和病理特征
134例HN-DLBCL患者的中位年龄为64岁(19~93岁),其中82例患者年龄超过60岁;在性别比例方面,男性占优势,男女比例为2.27∶1.00;患者最常见起病部位为韦氏环(包括扁桃体、口咽、鼻咽和舌根)38例(41.3%),其次为鼻窦鼻腔18例(19.6%)、腮腺16例(17.4%)和上下颌骨15例(16.3%);47例(35.1%)患者在发病同时伴有B症状;骨髓活检证实26例(19.4%)患者存在骨髓受侵;根据Ann Arbor分期,Ⅲ~Ⅳ期患者77例(57.5%);ECOG评分≥2分患者29例(21.6%);65例(48.5%)患者伴有心脑血管疾病;血清LDH和β2-MG水平升高患者分别为66例(49.3%)和91例(67.9%),另有31例(23.1%)患者HBsAg阳性(表1)。HN-DLBCL患者中非生发中心B细胞(non-germinal center B-cell,non-GCB)来源71例(53.0%),生发中心B细胞(germinal center B-cell,GCB)来源48例(35.8%),另有15例患者由于缺乏完整的免疫组织化学结果未能进一步分型,Ki-67增殖指数高表达(>60%)88例(65.7%),Bcl-2阳性表达98例(73.1%)(表1)。
2.2 生存率分析
截至2018年12月,全组134例患者中位随访时间为20个月(2~105个月),全组3年OS和PFS率分别为66.1%和54.7%(图1)。Ann-ArborⅢ~Ⅳ期患者3年OS和PFS明显低于Ⅰ~Ⅱ期患者(OS:52.7%vs85.9%,P=0.004;PFS:42.2% vs 72.3%,P=0.027);GCB型HN-DLBCL患者OS明显高于non-GCB型患者,但二者PFS差异无统计学意义(OS:80.5%vs55.5%,P=0.019;PFS:65.3%vs48.6%,P=0.262);血清LDH水平升高患者3年OS和PFS明显低于LDH水平正常患者(OS:49.7%vs81.7%,P<0.01;PFS:36.0%vs69.6%,P=0.008);血β2-MG水平升高患者OS也明显低于β2-MG水平正常患者,但PFS差异无统计学意义(OS:59.5%vs80.5%,P=0.037;PFS:48.2%vs67.8%,P=0.247,表1)。单因素分析显示,Ann Arbor临床分期、non-GCB亚型、血清LDH和β2-MG水平是OS的预后相关因素,而Ann Arbor临床分期、血清LDH和肿瘤细胞Ki-67增殖指数是PFS的预后相关因素(表1)。将单因素分析中差异有统计学意义的因素纳入多因素Cox分析显示,LDH水平为OS的独立危险因素(P=0.03,表2)。

表1 HN-DLBCL患者临床病理特征和预后影响因素的单因素分析Tab.1 Clinicopathologic features and univariate analysis of prognostic factors in patients with HN-DLBCL
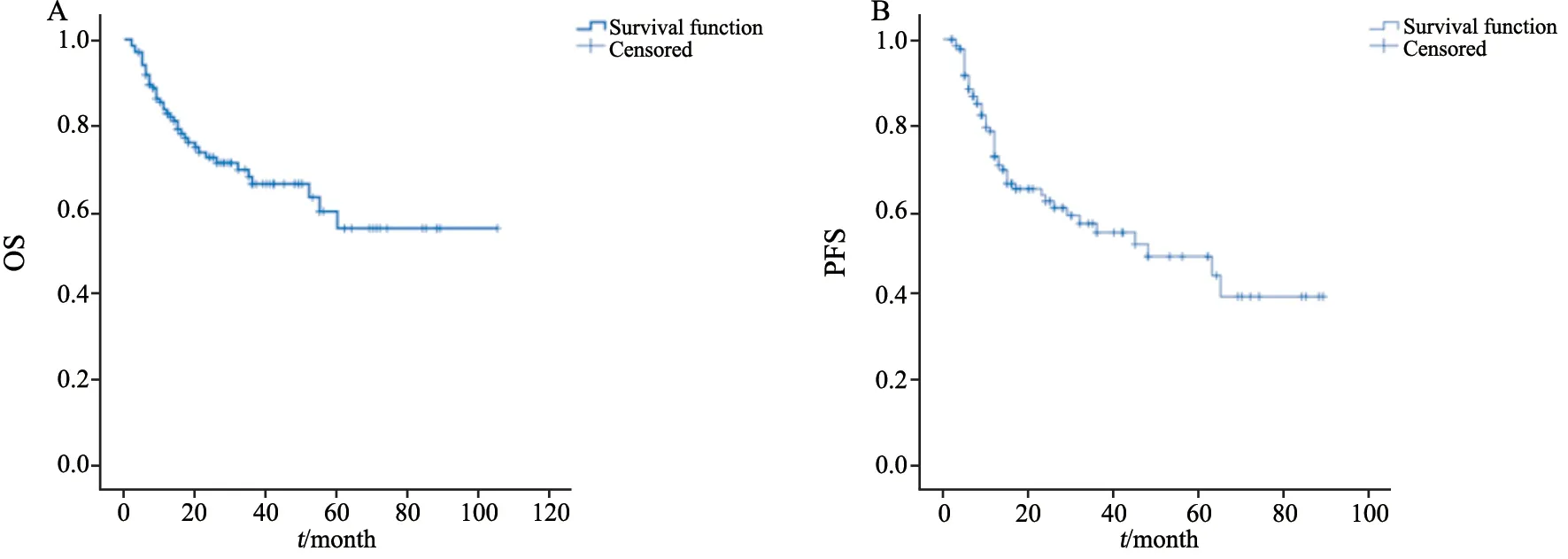
图1 HN-DLBCL全组患者总生存曲线Fig.1 Survival curves of HN-DLBCL patients in the whole series
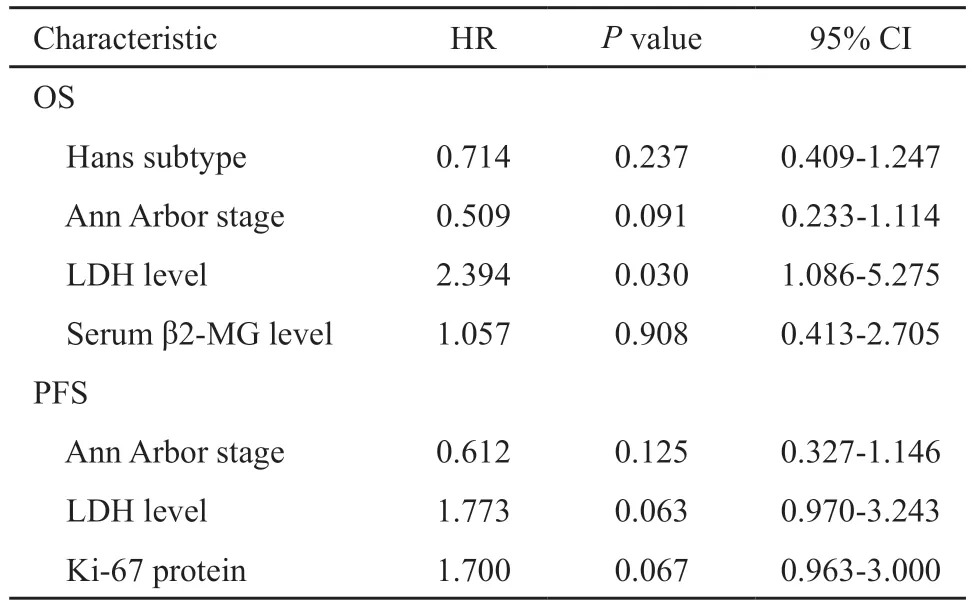
表2 HN-DLBCL患者预后影响因素的多因素分析Tab.2 Multivariate analysis of prognostic factors in patients with HN-DLBCL
2.3 3种预后评分系统中不同危险程度患者生存率比较
采用IPI预后评分,低危、低-中危、中-高危和高危患者比例分别为30.6%、27.6%、23.1%和18.7%,其3年OS分别为82.3%、72.7%、48.7%和44.7%,差异有统计学意义(OS:χ2=13.466,P=0.004);3年PFS分别为71.5%、59.4%、32.8%和44.3%,低-中危组和中-高危组患者有明显差异(χ2=15.452,P=0.038);使用NCCNIPI评分时,低危、低-中危、中-高危和高危患者比例分别为12.7%、48.5%、26.9%和11.9%,其3年OS分别为93.8%、76.8%、46.5%和36.8%,差异有统计学意义(χ2=21.454,P<0.01);3年PFS分别为82.4%、58.1%、46.8%和20.7%,中-高危组和高危组患者有明显差异(χ2=14.237,P=0.046);根据GELTAMO-IPI评分,低危、低-中危、中-高危和高危患者比例分别为6.7%、64.9%、16.4%和11.9%,其3年OS分别为87.5%、72.3%、58.3%和32.8%,差异有统计学意义(χ2=13.987,P=0.003);3年PFS分别为66.7%、58.7%、53.8%和16.3%,中-高危组和高危组患者有明显差异(χ2=19.731,P=0.027,图2、表3)。
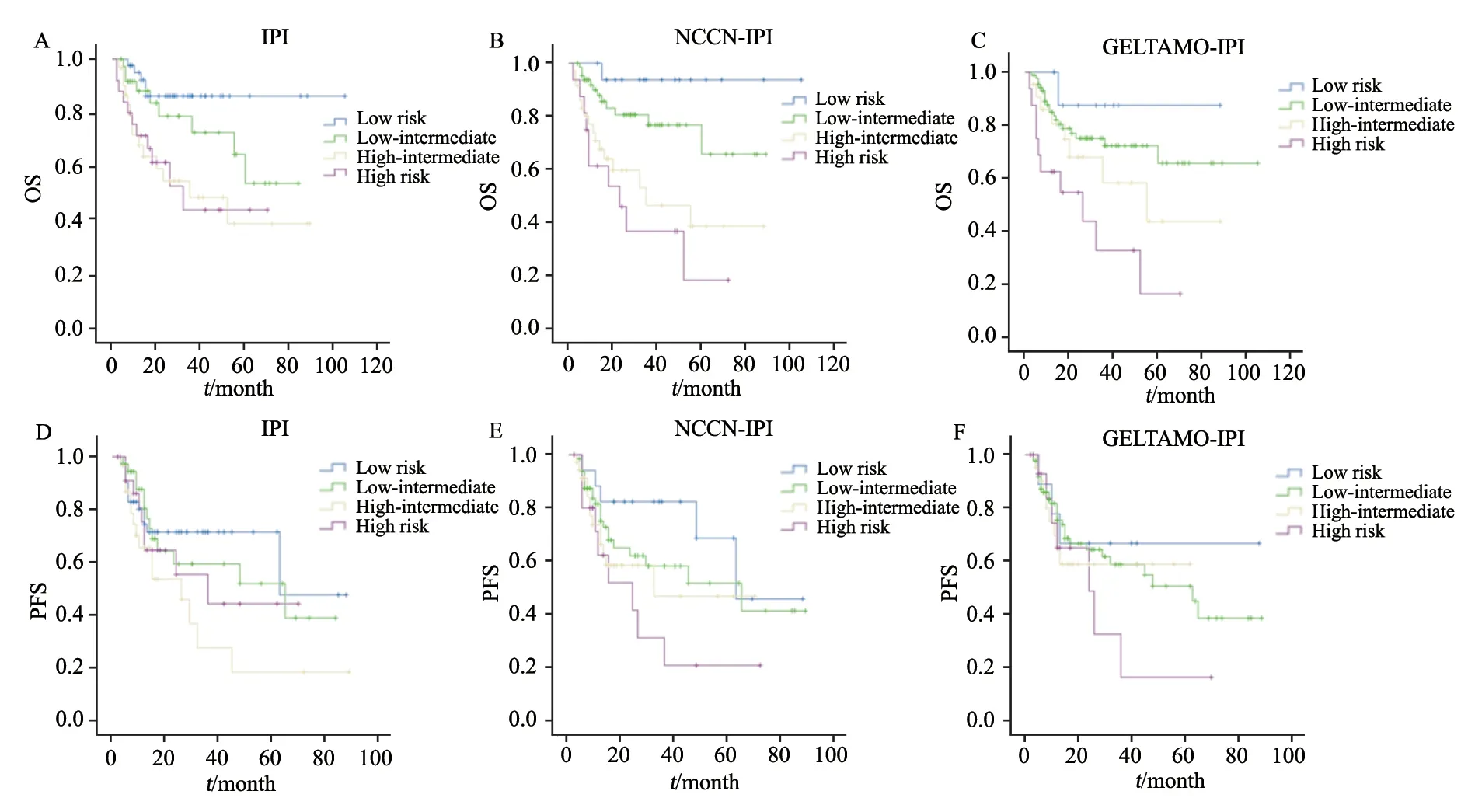
图2 IPI、NCCN-IPI和GELTAMO-IPI不同危险分组患者生存曲线Fig.2 Survival curves of HN-DLBCL patients with different risk groups by using IPI,NCCN-IPI and GELTAMO-IPI scores

表3 IPI、NCCN-IPI和GELTAMO-IPI不同危险分组患者PFS和OS比较Tab.3 Comparison of PFS and OS in HN-DLBCL patients with different risk groups by using IPI,NCCN-IPI and GELTAMO-IPI scores
NCCN-IPI和GELTAMO-IPI评分系统高危患者的3年OS和PFS(OS:36.8%和32.8%;PFS:20.7%和16.3%)明显低于IPI评分的高危患者(OS:44.7%;PFS:44.3%),由此可见,NCCN-IPI及GELTAMO-IPI更能分辨高危患者。
3 讨 论
头颈部是淋巴瘤第二常见好发部位,头颈部淋巴瘤约占该解剖部位所有恶性肿瘤的5%,其中HN-DLBCL是最常见的侵袭性恶性B细胞淋巴瘤[10]。已有研究显示,HN-DLBCL生物学行为、临床特征、病理学特点以及诊断和治疗模式与其他部位DLBCL存在差异[11],而且HNDLBCL患者生存预后具有异质性。因此,系统分析HN-DLBCL患者临床和病理学特点,筛查影响HN-DLBCL患者预后关键因素,建立基于预后分层的精准治疗是改善HN-DLBCL患者(尤其是高危患者)临床疗效和预后的有效途径。
一项回顾性研究[12]结果显示,HN-DLBCL好发于非生育年龄,男性患者比例较高,最常见起病部位为口咽部,其次为颈部淋巴结。本研究共纳入了134例接受治疗的新诊断HN-DLBCL患者,结果发现,患者中位年龄大于60岁,男性患者占优势,包括口咽部的韦氏环是最常见起病部位,这些结果与国外研究发现相一致,但本研究未单独统计颈部淋巴结起病患者,而且鼻窦、鼻腔和腮腺起病HN-DLBCL患者比例低于国外研究报道,这可能与统计人群偏移和统计方法差异有关。基于肿瘤细胞免疫组织化学CD10、Bcl-6 和MUM-1表达情况,Han’s分类法将DLBCL分为GCB和non-GCB型,其中来源于生发中心的GCB型有更好的治疗反应和预后[13]。本研究发现,GCB型患者OS明显高于non-GCB型患者,但二者PFS比较差异无统计学意义,这可能与免疫组织化学评估方法和阈值设定差异有关。另一方面,近期研究显示,肿瘤细胞Bcl-2高表达或发生基因重排的DLBCL患者预后较差[14],但本研究结果显示,Bcl-2阳性表达HN-DLBCL患者生存率与阴性表达者相近,提示基于单个基因重排或异常表达的预后评估可能存在局限性。
在免疫化疗时代,含有利妥昔单抗的R-CHOP或R-CHOP样方案治疗HN-DLBCL显示出良好疗效和安全性,但放疗作用一直有争议,已有临床研究显示,早期HN-DLBCL患者接受免疫化疗后序贯放疗与单纯化疗比较具有显著生存优势,而且对于化疗后未达完全缓解者,放疗可以显著改善其PFS和OS[15]。但本研究发现,化疗后放疗巩固治疗HN-DLBCL患者,其3年PFS和OS达到37.0%和53.2%,较单纯化疗者生存率偏低,可能本研究队列入组较多Ⅲ~Ⅳ期患者有关。本研究单因素分析结果还显示,Ann Arbor临床分期、病理分型、血清LDH、β2-MG和肿瘤细胞Ki-67增殖指数是HN-DLBCL患者OS和PFS的预后相关因素,进一步多因素分析显示,血清LDH升高是HN-DLBCL患者3年OS的预后不良因素,提示血清LDH水平可能代表淋巴瘤细胞生长和侵袭潜力。
尽管IPI仍然广泛应用于DLBCL患者预后分层,但在免疫化疗时代IPI区分高危患者效能有限。本研究系统比较IPI、NCCN-IPI和GELTAMO-IPI分层不同危险程度患者3年OS和PFS,结果发现,NCCN-IPI和GELTAMO-IPI评分系统高危HN-DLBCL患者生存率明显低于IPI评分高危患者,提示改良IPI能够更有效地甄别高危患者,具备更好分层能力。
综上所述,在免疫化疗时代,血清LDH水平是HN-DLBCL患者的独立危险因素,而改良国际预后模型NCCN-IPI和GELTAMO-IPI较传统IPI评分更能分辨高危患者。但本研究系单中心回顾性研究,病例选择存在偏倚(临床分期Ⅲ~Ⅳ患者比例偏高),纳入分析评估指标均为临床常规检测项目,缺乏患者肿瘤标本分子分型等新型预后分层指标,也未明确患者是否为双重或三重打击淋巴瘤,因此,本研究结果具有一定局限性。今后要进一步扩大样本量并对肿瘤标本进一步检测以便获取更多预后分层信息。
