西地那非通过AKT/GSK3β信号通路保护小鼠肾纤维化的作用机制
2020-07-15许春花王永双金美花
许春花,王永双,金 福,金美花
0 引 言
肾纤维化(renal fibrosis,RF)是慢性肾疾病持续进展的基本病理过程,一旦形成难以逆转。肾固有细胞开始损伤出现炎症反应,表现为慢性肾炎的特征,细胞功能丧失,转变为终末期肾衰竭,目前是个很严峻的问题。RF发展漫长,与多种因素相关,如氧化应激活性氧的产生,凋亡因子的产生和炎症因子等[1]。由环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)介导的PI3K /Akt/GSK-3β信号通路在肾生理和病理中有着重要作用[2],Akt 除参与淋巴细胞、成纤维细胞等多种细胞的增殖、活化外, 还可能参与调节机体的免疫炎症反应,GSK3抑制剂已被证明可以预防炎症性疾病,GSK3的调节因子包括导致PKB/Akt激活的PI3K途径以及血清和糖皮质激素诱导激酶(glucocorticoid inducible kinase,SGK)亚型[3]。西地那非(Sildenafil,Sil)是一种对cGMP特异的 5 型磷酸二酯酶(phosphodiesterase-5,PDE5)选择性抑制剂,具有免疫调节、抗炎、抗聚集作用[4]。
本实验通过建立小鼠单侧输尿管梗阻(unilateral ureteral obstruction,UUO)肾损伤模型,测定UUO小鼠血清肌酐、尿素氮含量,采用HE和MASSON染色观察UUO模型小鼠肾组织的病理改变,Western blot方法检测p-Akt /Akt、p-GSK-3β/GSK-3β蛋白表达,探讨Sil对小鼠RF的保护作用,为临床应用Sil治疗肾纤维化相关疾病提供实验依据。
1 材料与方法
1.1 动物分组及给药方法本实验选用昆明雄性小鼠共90只,6周龄,体重(15±5)g,由延边大学动物实验中心室提供,实验动物许可证号为SCXK(吉)2017-0003,90只昆明小鼠随机数字表法分为3组,假手术组(n=30),小鼠仅做输尿管分离,不结扎及剪断输尿管,1 mL/(10 g·d) 给予0.9% NaCl 溶液皮下注射;UUO模型组(n=30),小鼠分离及结扎输尿管并1 mL/(10 g·d )给予0.9% NaCl 溶液皮下注射制备UUO模型;UUO+Sil给药组(n=30),小鼠于UUO模型成功后第1天开始每天同一时间皮下注射西地那非[12 mg/(kg·d)],共注射14 d。实验第3、7、14 天每组随机选择10只,取眼球血测定血清肌酐和尿素氮,取左侧肾组织行HE和Masson染色观察肾组织的病理改变,采用蛋白免疫印迹法检测肾组织中Akt和GSK-3β蛋白及其磷酸化水平。
1.2主要试剂西地那非(批号:Lot#LRAA9454)由美国sigma公司提供;SDS PAGE制胶盒购自北京索莱宝科技有限公司;肌酐、尿素氮、Akt一抗、p-Akt一抗、GSK-3β一抗、p-GSK-3β一抗、β-actin一抗体由Santa ctuz biotechnology公司提供。
1.3模型制备及给药方法UUO 模型制备: 术前器械消毒, 用5%水合氯醛腹腔内注射麻醉,将小鼠俯卧位固定,备皮,常规消毒,戴无菌手套,铺无菌孔巾,在小鼠背部、左侧肋腰点下约0.5 cm、脊柱左侧约1 cm 作1.5~2 cm 长纵向切口,逐层进腹,见肾位于脊椎旁,充分暴露肾, 用小弯镊轻轻分离肾下极部分包膜及肾蒂处包膜,分离出输尿管,用5-0丝线在近左肾下极处双重结扎左侧输尿管 (分别在紧靠肾盂处及远离肾盂约1 cm 处结扎输尿管,在两结中间剪断输尿管),检查无渗漏和出血后逐层缝合腹壁各层及背部皮肤,消毒,盖无菌纱布。假手术组小鼠仅作分离,不结扎及剪断输尿管,模型组与治疗组做UUO模型,治疗组定期给药。
1.4血清肌酐和尿素氮测定血清采集和保存:小鼠水合氯醛麻醉后,取眼眶静脉血2 mL,以离心半径14 cm、2500 r/min,15 min,分离血浆后,置于-80 ℃冰柜中保存,按照试剂盒说明书操作测定血肌酐和尿素氮。
1.5肾病理检测取左侧肾组织按试剂盒说明书操作做HE和Masson染色观察肾组织的病理改变。
1.6Western blot检测肾组织蛋白提取后BCA法测定蛋白浓度,配制SDS-PAGE凝胶经上样、电泳、转膜后封闭,封闭液使用5%的脱脂奶粉2.5 g,将PVDF膜放入10 mL封闭液中,室温封闭60~90 min;加 一抗、二抗孵育之后 显影、定影。做出的光片进行扫描后,通过凝胶成像系统及图像分析软件对吸光度进行分析,计算其灰度值并分析结果,得出测定蛋白的相对表达量。

2 结 果
2.1 各组小鼠血清肌酐和尿素氮检测结果UUO 3、7、14 d后,UUO组小鼠血清肌酐、尿素氮含量明显高于假手术组(P<0.05),但较给药组降低(P<0.05)。见表1。


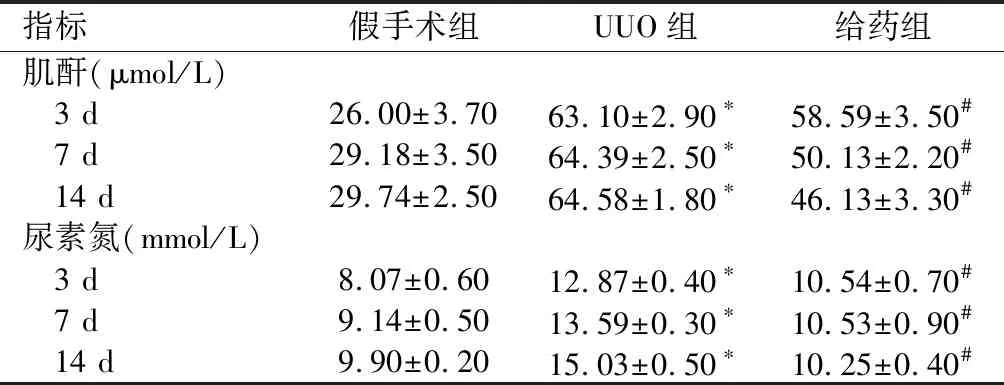
指标假手术组UUO组给药组肌酐(μmol/L) 3 d26.00±3.7063.10±2.90∗58.59±3.50# 7 d29.18±3.5064.39±2.50∗50.13±2.20# 14 d29.74±2.5064.58±1.80∗46.13±3.30#尿素氮(mmol/L) 3 d8.07±0.6012.87±0.40∗10.54±0.70# 7 d9.14±0.5013.59±0.30∗10.53±0.90# 14 d9.90±0.2015.03±0.50∗10.25±0.40#
与假手术组比较,*P<0.05;与UUO组比较,#P<0.05
2.2各组小鼠肾组织HE染色假手术组肾小球大小正常,间质区未见炎性浸润及纤维化。UUO组3 d时,肾可见部分肾小管上皮细胞空泡变性,部分管腔扩张,少量视野中可见肾间质水肿和少量炎性细胞浸润; 7 d时肾小管上皮细胞萎缩,管腔扩张,大小不等,间质明显水肿、增宽,炎性细胞增多,出现纤维化样细胞; 14 d时上述改变更为显著,肾小管明显变性、坏死,肾间质组织中出现大量纤维细胞增生,间质明显纤维化。给药组各时间点肾间质炎性细胞浸润程度较模型组明显减轻,给药后随时间延长,肾小管扩张减轻,炎性细胞减轻。见图1。
2.3各组小鼠肾组织Masson染色假手术组肾结构正常,仅仅肾小球基膜、系膜区及小管周围可见少量胶原纤维线性分布,UUO组3 d时肾小球数量减少,肾小管萎缩,可见炎症细胞浸润,间质区有胶原纤维分布, 7 d时肾小管萎缩明显,可见大量胶原纤维分布, 14 d时上述病理变化更为显著,纤维化较明显。给药组随给药时间延长,纤维化程度较UUO组有所减轻。见图1。
2.4Western blot测定与假手术组比较,UUO组p-Akt/Akt、p-GSK-3β/GSK-3β在中表达水平明显降低(P<0.05),与UUO组比较,给药组中p-Akt/Akt、p-GSK-3β/GSK-3β蛋白表达水平显著升高(P<0.05),见图2。

a:HE染色 ×40; b:Masson染色 ×100
图 1 肾组织形态学变化
Figure 1 Histomorphological changes of kidney
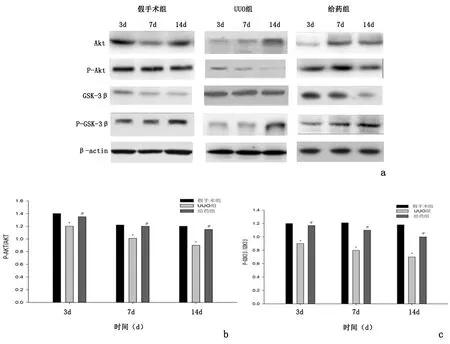
a:Western blot检测;b:P-Akt;c:P-GSK-3β
与假手术组比较,*P<0.05;与UUO组比较,#P<0.05
图 2 肾组织各蛋白表达含量
Figure 2 The protein content of renal tissue
3 讨 论
RF是发展慢性肾脏疾病最终共同通路[5],虽然慢性肾病(chronic kidney disease,CKD)发病率在增加,但目前没有有效的药物治疗,分子和细胞机制对于研究鉴别和发展有效的肾脏治疗还是有必要的[6]。研究表示,RF的机制可能会累及很多连锁反应,包括建立信号传导通路等多个环节,其过程关联到许多细胞及分子,多种因素一起作用,机制复杂。肾细胞的丢失和间质中细胞外基质(extracellular matrix,ECM)的替代证明了CKD的发展[7],ECM保持稳态,会由各种分泌蛋白共同调控,肾小球硬化的发病与肾小管间质纤维化有着很大的相似性,如果刺激后发生转化,RF就达到瘢痕构成阶段,从而驱使ECM堆积,RF形成,所以,在初期必须消除纤维化发生,然后再进行组织的再生和重建[8]。
对于CKD来说动物模型是重要的实验工具,用于研究新的机制途径,UUO模型基本已成为高通量体内模型,因为它概括了在相对较短的时间跨度内代表所有形式的CKD基本致病机制[9-10]。CKD的高患病率让我们必须重视能有效停止、预防或逆转肾纤维化,本实验中,UUO模型小鼠肾组织HE染色结果病理改变显著,Masson染色小鼠肾组织的蓝色胶原纤维增多,与文献报道一致。尿素氮、肌酐是人体代谢的产物,径肾小球代谢到体外,两个指标升高证明肾小球滤过功能减退,本实验中UUO模型小鼠模型组的血清尿素氮、肌酐比对照组显著升高,小鼠肾组织病理改变和肾功能改变证实UUO小鼠模型制备成功。CKD患者处于炎症状态可归因于多种因素,表现出血浆中炎性分子水平的升高,引起氧化应激和活性氧增多,反过来,它可以启动激活促炎基因的细胞内信号级联反应表达[11-12]。在慢性进行性肾损害中,炎症细胞浸润是重要的病理特征。本实验病理涂片结果,UUO模型小鼠炎细胞浸润,随着时间的增加,炎细胞浸润越多。
AKT又名蛋白激酶B(protein kinase B,PKB),可使丝氨酸/苏氨酸(Ser/Thr)磷酸化,故又称丝氨酸/苏氨酸激酶[13]。GSK是一种丝氨酸蛋白激酶,分为GSK3a和GSK3β两种亚型,GSK-3β是丝氨酸/苏氨酸多功能激酶,GSK3β磷酸化丝氨酸的9号位,被AKT介导,可对GSK3β活性有抑制作用,因此,AKT抑制可导致GSK-3βSer9 被磷酸化,从而使得GSK3β活性增加。GSK-3β是调节底物识别和激酶活性的关键节点,活化的Akt在许多细胞类型中起存活作用[14]。GSK3β在纤维化组织中表达,而表达的 GSK3β可加重肾小管上皮细胞纤维化,由此证明 GSK3β是促进RF的重要因素。 GSK3抑制剂已被证明可以预防炎症性疾病[15]。
Sil在生殖,心血管系统、呼吸系统及肺动脉高压起保护作用[16-17],亦是一种肾脏保护剂,国外有文献报道,已经证实了Sil在急性和慢性肾损伤模型中具有肾保护作用,Sil的抗氧化,抗炎和抗凋亡特性归因于其在肾脏中的保护作用。PDE抑制剂(Sil)增加No的释放并改善内皮功能。PDE有很多型,特别是PDE5和PDE11在肾中表达,PDE5多数在人输尿管平滑肌组织中的表达[18]。Sil中PDE5抑制剂的血管舒张效应原因是激酶的激活通过释放内源性介质如缓激肽或腺苷和NO合成。Sil为选择性PDE5抑制剂预计会在各种肾脏并发症中产生有利结果[19]。NO主要是通过cGMP途径来激活PI3K/Akt信号通路[20],Sil通过NO-cGMP途径发挥作用[21],Sil可通过抑制PDE增加cGMP浓度[22],使得PKG活性增强,从而调节P13K/AKT/GSK3β通路上的信号分子,使得Akt活性增加,GSK-3βSer9磷酸化,进而使得GSK-3β失活,对肾组织起到保护作用。
本实验Westen blot 测定结果,小鼠UUO模型组p-Akt/Akt,p-GSK-3β/GSK-3β与模型组相比较,其比值降低,Akt、GSK-3β的活化都由磷酸化表达,肾损伤抑制了Akt的活性,使p-Akt表达含量下降,降低了对GSK-3βSer9磷酸化作用,GSK-3β活性增强,对RF有加重作用。Sil给药组小鼠肾组织p-Akt/Akt、p-GSK3β/GSK-3β比值比模型组增高,说明通过 Sil作用使Akt激活,进而使GSK-3β失活,降低了对RF的作用,抑制了氧化应激反应,说明Sil的干预作用对肾损伤起保护作用。
