胆管癌相关淋巴管上皮细胞高表达因子对淋巴管生成的促进作用
2020-07-15孙铭阳巫雪茹朱明玉唐思敏葛贤秀
张 雯,孙铭阳,巫雪茹,朱明玉,李 响,唐思敏,葛贤秀,缪 林
0 引 言
胆管癌起源于胆道上皮细胞,起病隐匿,恶性程度高,难以医治且预后极差,5年存活率仅为5%[1]。胆管癌细胞可以通过淋巴管进行远隔器官及淋巴结的转移[2],无法切除肿瘤的患者平均生存期约为6个月[3]。淋巴管上皮细胞(lymphatic epithelial cells LECs)是淋巴脉管的初始部位,属于肿瘤微环境中的重要一环,也是淋巴转移的重要参与部分[4]。肿瘤区域丰富的淋巴管网络也可像肿瘤相关血管一样为肿瘤生长提供营养支持[5]。此外淋巴管重塑更利于肿瘤细胞进入淋巴脉管,增加转移的可能[4]。我们通过研究胆管癌细胞调节的重组人趋化因子CXCL5(LECs)中趋化因子和炎症因子的表达情况,发现胆管癌细胞刺激LECs后,LECs分泌上皮中性粒细胞活化肽-78(epithelial neutrophil-activating peptide-78, ENA-78)蛋白的含量增加。研究表明ENA-78通过与IL-8B受体结合来传递信号[6-7]。我们发现ENA-78发挥促进淋巴管生成的作用可能也与IL-8B受体相关。这可能成为胆管癌肿瘤微环境中抗肿瘤生长转移进程的一个潜在靶点。
1 材料与方法
1.1 实验材料胆管癌细胞株RBE、HCCC9810购于中国科学院典型培养物保藏委员会细胞库。胎牛血清、DMEM培养基、0.25%胰蛋白酶购于美国GIBCO公司。淋巴管上皮细胞LECs、上皮细胞完全培养基(ECM)、纤连蛋白购于美国ScienCell公司。0.45 μm过滤器(SLHV033RB)购于美国Millipore公司。人类ENA-78 ELISA试剂盒(#ab100506)购于英国Abcam公司。炎症因子和趋化因子抗体芯片(QAH-INF-3&QAH-CHE-1)购于美国RayBiotech公司。Matrigel胶(356231)购于美国BD Biosciences公司。IL-8B抑制剂SB225002(SML0716)购于美国Sigma公司。活性蛋白ENA-78 (#300-22)购于美国Peprotech公司。ENA-78中和抗体(鼠单克隆抗体;MAB254) 购于美国R&D公司。CCK8试剂盒购于中国武汉金开瑞公司。
1.2 实验方法
1.2.1 细胞培养胆管癌细胞株RBE,HCCC9810在含10%胎牛血清、1%青霉素链霉素溶液的DMEM培养基中培养,淋巴管上皮细胞LECs在纤连蛋白包被过夜的培养瓶及ECM完全培养基中生长。细胞在含5%CO2、37 ℃恒温培养箱中培养,传代按1∶3的比例进行。
1.2.2 条件培养基(CM)的制备与分析胆管癌细胞(RBE, HCCC9810)的条件培养基(CCM)的制备:在T150培养瓶中培养胆管癌细胞,当其达到80%融合时用PBS温柔润洗2次,无血清培养基润洗1次,用8 mL无血清培养基培养细胞24 h。收集上清液离心过滤去除杂质。胆管癌相关淋巴管上皮细胞(RBE-LECs, HCCC9810-LECs)的条件培养基的制备:用T75组织培养瓶培养LECs,当细胞达到30%融合时,用胆管癌条件培养基(CCM∶ECM=1∶3)培养LECs 3~4 d达到80%细胞融合后,然后换4 mL含1% FBS的ECM培养基。48 h后,将上清液离心并过滤。所得的条件培养基分装储存在-80℃冰箱,避免反复冻融,且储存时间不可超过2个月。
1.2.3 炎症因子和趋化因子抗体芯片检测与分析条件培养上清中的炎症因子和趋化因子通过RayBiotech抗体芯片(QAH-INF-3&QAH-CHE-1)检测,具体操作步骤按照Raybiotech公司的标准操作流程进行。分析条件培养基中80种常见炎症因子与趋化因子的分泌情况,并进行数据分析筛选目标因子。
1.2.4 确定CCM-LECs分泌ENA-78的平台期通过收集不同时间点(第0、24、48、72、96小时)的RBE-LECs及HCCC9810-LECs对应的条件培养上清,ELISA检测发现RBE-LECs及HCCC9810-LECs的条件培养上清中ENA-78的含量在第24小时和第48小时浓度逐步上升,并且在第48小时到达平台期,此后因子浓度基本维持或轻度下降。确定后续实验中CCM的最佳收集时间为48小时。
1.2.5 ELISA根据人类ENA-78 ELISA试剂盒的操作步骤,进行不同条件培养基中ENA-78蛋白的浓度测定。每个样品进行了3次独立实验。
1.2.6 细胞增殖实验在96板中种入100 μL LECs细胞悬液。每组制备6个重复孔。贴壁后换空白培养基饥饿处理4 h后给予上清或药物处理,处理方法与淋巴管形成实验中处理方式相似。处理24 h后,加入10 μL CCK8后避光37 ℃孵育2~4 h后进行450 nm吸光度检测。每个样品进行了3次独立实验。空白对照组:由DMEM和ECM按浓度1∶1配置。CCM组培养基由第48小时收集的CCM和ECM按浓度1∶1配置。CCM+Anti-ENA-78组:在CCM组培养基制备基础上加入1 μg/mL ENA-78中和抗体。Anti-ENA-78组:在空白对照组的基础上加入1 μg/mL ENA-78中和抗体。ENA-78组:在空白对照组培养基制备基础上加入20 ng/mL的ENA-78活性蛋白。ENA-78+SB225002组:在ENA-78组培养基制备基础上加入100 nM SB225002。SB225002组:在空白对照组培养基制备基础上加入100 nmol/L SB225002。
1.2.7 淋巴管形成实验250 μL基质胶于4 ℃冰箱过夜,用预冷的枪头在冰板上将基质胶快速加入预冷的24孔板中,并轻晃使其分布均匀。将24孔板在37 ℃孵育使基质胶凝结。将LECs在含有1%FBS的血清ECM中孵育6 h,随后均匀种于包被基
质胶的24孔板中,并且加入制备好的的条件培养基,分组情况如1.2.6。在37 ℃温育24 h后,拍摄内皮细胞的管状结构,观察毛细管状结构的个数。进行了3次独立实验。
2 结 果
2.1 胆管癌调节的LECs高表达ENA-78蛋白通过统计分析趋化因子和炎症因子在CCM-LECs与正常LECs培养上清中的浓度,显示ENA-78、IP-10、GCP-2、MCP-2、MCP-3、MIP-3a、HCC-1、Lymphotactin在CCM刺激后的LECs上清中表达增高,其中ENA-78在CCM-LECs中调变程度最显著。I-TAC、MIP-1d、IL-10、MIG、PDGF-BB、CXCL16因子呈现表达下调。见图1。
2.2 CCM及CCM-LECs中ENA-78含量测定结果发现,在RBE和HCCC9810的肿瘤细胞培养上清中,ENA-78蛋白表达量均<5 pg/mL 。ENA-78蛋白在RBE-LECs、HCCC9810-LECs上清中浓度[(1190.94±120.64、1650.38±103.76)pg/mL]较正常LECs[(354.03±32.50) pg/mL]升高(P<0.01)。
2.3 CCM对淋巴管形成的影响CCM组和CCM+Anti-ENA-78组LECs增殖和淋巴管成管数均较对照组显著增强(P<0.05)。CCM+Anti-ENA-78组较Anti-ENA-78组的增殖和成管能力均有明显增强(P<0.05);但CCM+Anti-ENA-78组增殖和成管能力较CCM组明显减弱(P<0.01)。见表1,图2。
2.4 外源性ENA-78对淋巴管形成的影响ENA-78组的细胞增殖和成管能力均较空白对照组显著增加(P<0.05)。ENA-78+ SB225002增殖和成管能力较ENA-78组有明显减弱(P<0.05)。见表2,图2。

a:上调因子; b:下调因子
图 1 条件培养上清中炎症因子及趋化因子的表达水平
Figure 1 Secretion of inflammatory factors and chemokines in culture medium

a:CCM中ENA-78对淋巴管形成的影响; b:外源性ENA-78对淋巴管形成的影响
图 2 CCM中ENA-78对淋巴管形成的影响
Figure 2 The effect of ENA-78 in CCM on lymphangiogenesis



组别细胞增殖(A450值)淋巴管成管数对照组0.31±0.033.00±0.82CCM组1.19±0.14∗27.67±5.73∗CCM+Anti-ENA-780.59±0.07∗#7.67±1.25∗#Anti-ENA-78 0.34±0.02#2.67±1.70#
与对照组比较,*P<0.05;与CCM组比较,#P<0.05


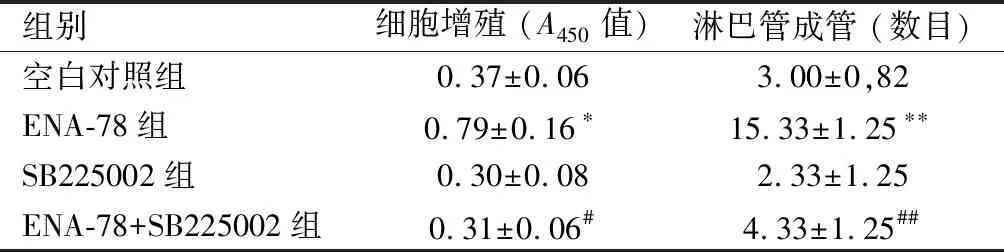
组别细胞增殖 (A450值)淋巴管成管 (数目)空白对照组0.37±0.063.00±0,82ENA-78组0.79±0.16∗15.33±1.25∗∗SB225002组0.30±0.082.33±1.25ENA-78+SB225002组0.31±0.06#4.33±1.25##
与空白对照组相比,*P<0.05、**P<0.01;与ENA-78组相比,#P<0.05、##P<0.01
3 讨 论
近年来癌症领域的研究者不再仅仅局限于肿瘤细胞自身的研究,更关注肿瘤微环境在癌症发生发展转移中发挥的作用[8-9]。肿瘤微环境是一个复杂的网络,包含各种宿主细胞,免疫细胞,血管和淋巴管网,细胞外基质,理化因素等一系列因素,与肿瘤发生发展以及转移都息息相关[10]。我们主要关注微环境中淋巴脉管发挥的作用,其中LECs是基质淋巴管的一个重要组成部分[4]。故我们选择LECs作为胆管癌微环境中一个重要的间质细胞进行下一步研究。
ENA-78属于CXC型趋化因子家族的成员,又被称为CXCL5。据研究报道,ENA-78在一些肿瘤组织中高表达,例如胰腺癌,肺癌,大肠癌[11-13]。研究表明,与癌旁和正常志愿者血清相比,ENA-78在肿瘤样品和患者血清中过表达[14-15]。通过TCGA数据库也初步发现ENA-78在胆管癌患者肿瘤组织中表达增高。研究表明ENA-78的高表达与总生存期短和肿瘤复发率高呈正相关[14]。这表明ENA-78是预测胆管癌的一个潜在指标。高ENA-78表达组根治性手术后仍然表现出较差的总体生存率[16]。这给予了我们一个启示:ENA-78可能不仅仅对肿瘤细胞产生作用,也与微环境中基质细胞[16]、免疫细胞[14]或其他组成成分相互联系。
ENA-78可以促进肿瘤增殖、转移,并且促进许多免疫相关细胞的浸润与激活[14,17-20]。我们证实CCM能促进淋巴管形成,并且CCM中ENA-78起到了重要的作用。阻断CCM中ENA-78的表达,可以显著减弱CCM的淋巴管成管能力。但因为CCM中成分复杂,因子表达繁多,ENA-78虽然是重要的促进淋巴管生成的因子,但不是唯一。正因如此,ENA-78的中和抗体,不能完全的阻断CCM促进淋巴管生成的能力。为排除CCM中其他因子的干扰,我们设计了外源性ENA-78促进淋巴管形成的实验。我们发现外源性ENA-78对淋巴管生成有直接促进的作用,并且可以被IL-8B抑制剂有效阻断,这表明ENA-78促淋巴管生成可能与其受体IL-8B结合有关。
此外,研究表明ENA-78也可通过招募中性粒细胞来促进血管和淋巴管的生成[21]。在胆管癌中,肿瘤细胞依赖PI3K-Akt和ERK1/2信号通路直接招募中性粒细胞[14]。关于胆管癌细胞是否能体外直接增加细胞增殖和转移能力的研究目前尚有争议。有研究者认为ENA-78可以在体内实验中提高肿瘤生长和转移能力,但不改变体外肿瘤细胞增殖和侵袭能力[14]。主要因为ENA-78发挥作用依赖体内中性粒细胞的浸润及介导[14]。但也有研究认为体外能直接增加细胞增殖和转移能力[16]。这样的差异主要取决于研究中使用的实验细胞株不同。这些争议性研究也给予了我们一个新的思考。ENA-78对胆管癌细胞的作用可能有个体差异,这也许取决于不同个体的肿瘤细胞上受体表达的差异。受体差异性表达也许是指导癌症患者的个体化治疗的一个潜在方向。
综上所述,我们的研究表明,胆管癌微环境中的LECs分泌ENA-78蛋白量增加,ENA-78可能通过受体IL-8B发挥促进淋巴管生成的作用。阻断ENA-78/IL-8B轴有望成为胆管癌肿瘤微环境抗肿瘤转移的一个新方向。
