氧化石墨烯量子点用于牙周膜干细胞活细胞荧光标记的研究
2020-07-15冉秋池龙盛荣苗雷英
姚 敏,冉秋池,龙盛荣,苗雷英
0 引 言
近年来,采用干细胞治疗疾病一直是国内外研究的热点。在实验及临床转化研究中,对干细胞进行无创、有效的荧光标记具有重要的意义。荧光标记技术不同于放射物标记法、生物酶标记法等,具有无放射污染、低细胞毒性、检测技术成熟等优点。氧化石墨烯荧光量子点(graphene oxide quantum dots, GOQDs)是一种新型无机纳米材料,被广泛应用研究于荧光标记探针技术,具有发光波长宽、稳定性好、不易被细胞分解、标记时间长的优势,被认为是细胞成像研究最有前途的荧光标记物之一。
牙周膜干细胞(periodontal ligament stem cells, PDLSCs)作为一种牙源性的成体干细胞,由Seo等[1]于2004年分离并证明其具有多向分化潜能,可作为种子细胞用于组织再生治疗当中。PDLSCs作为组织工程的三大要素之一,其在组织内的存活、迁移、分布等方面尚未十分明确,因此,选择一种低毒性、光学性能较好的标记材料进行有效的干细胞示踪方式具有一定的意义。本研究旨在探究纳米GOQDs作为PDLSCs的活细胞荧光标记材料使用的可能性,评价GOQDs材料的生物安全性,活细胞荧光标记效应。
1 材料与方法
1.1 主要试剂与细胞氧化石墨烯量子点(XF042,先丰纳米,中国);PBS磷酸缓冲溶液(Hyclone,美国);胎牛血清、α-MEM培养基、青霉素-链霉素溶液、0.25 %胰蛋白酶溶液(Gibco,美国);茜素红、油红染液(Sigma,美国);抗细胞波形蛋白多克隆抗体、抗角蛋白多克隆抗体(谷歌生物,中国);CCK-8(同仁化学,日本);PDLSCs由正畸减数离体牙提取分离、培养扩增后冻存,受赠于南京市口腔医院中心实验室,P3-P5用于本研究。
1.2 主要仪器
透射电子显微镜(TEM,JEM-200CX,日本);动态光衍射仪(DLS,Brookhaven,美国);流式细胞仪(BD FACSCalibur,美国);SpectraMax M3 酶标仪(Molecular Devices,美国);激光共聚焦显微镜(Nikon A1,日本)。
1.3 方法
1.3.1GOQDs的表征将GOQDs水溶液超声处理30 min后,吸取少量液体滴于有碳膜支持的铜网上,烘干后重复1次,进行TEM检测,将拍摄的图像导入ImageJ软件中,测定GOQDs的粒径大小,测定粒子数目>50个;GOQDs经完全培养基稀释后的分散粒径采用DLS检测;对GOQDs的水溶液进行紫外-可见分光光度计和荧光分光光度计(PL)用于表征样品的光学性能。测试数据导入Origin绘制曲线图。
1.3.2PDLSCs的培养及鉴定将冻存的细胞于37 ℃水浴复苏,培养48 h后消化,1000 r/min, 4 ℃,离心5 min,制备细胞爬片,细胞融合率约80%后,使用4%的多聚甲醛固定细胞30 min,采用波形蛋白、角蛋白一抗封闭,PBS作为阴性对照。4 ℃过夜孵育后37 ℃复温1 h,免疫组织化学法检测波形蛋白、角蛋白的表达。PDLSCs消化后铺板,细胞融合率在60%左右,替换培养基为成骨、成脂肪诱导培养基[2],每3天换液,分别培养14 d、21 d后进行油红O及ARS染色。
1.3.3GOQDs生物相容性检测将PDLSCs计数后铺于96孔板中,1000/孔,贴壁后,采用不同浓度的GOQDs处理细胞(0、5、10、25、50、100、200、400 μg/mL),分别孵育24 h、72 h,每孔加入10%的CCK-8后37 ℃孵育2 h,于采用酶标仪测450 nm处吸光度(A值),计算细胞活性;将细胞铺于96孔板,采用不同浓度的GOQDs孵育(0、10、25、50 μg/mL),在培养1、3、6、10 d后换液加入10%的CCK-8,37 ℃孵育 2 h 后,测吸光度绘制增殖曲线。PDLSCs进行GOQDs(0、50 μg/mL)处理后72 h,收集细胞,制备为单细胞悬液,用体积分数为70%乙醇固定2 h后4 ℃保存,染色前用 PBS 洗去固定液,加 100 μL RNase A 37℃水浴 30 min,再加入 400 μL PL染色混匀,4 ℃避光 30 min。最后上机检测,记录激发波长 488 nm 处红色荧光。
1.3.4GOQDs对PDLSCs的荧光标记作用PDLSCs接种于玻璃底板的共聚焦小皿中,在细胞融合率约为60%时替换培养基为含50 μg/mL GOQDs的完全培养基,分别于孵育24 h和72 h,采用PBS清洗细胞3遍后置于激光共聚焦显微镜下观察,探究GOQDs对PDLSCs的活细胞荧光标记作用。

2 结 果
2.1 GOQDs的表征干燥后的GOQDs具有较好的分散性,粒子大小均匀,测定粒径大小为(6.36±1.41)nm。光学性质检测结果可见,在紫外-可见吸收光谱中显示,GOQDs的水溶液在365 nm附近有1个吸收峰。PL荧光结果显示GOQDs在365 nm的激发光下,455 nm处具有较好的发射,呈现蓝光。见图1。

a:透射电子显微镜;b:动态光散射;c:紫外吸收波谱;d:PL光谱
图1 GOQDs的表征
Figure 1 The characterization of GOQDs
2.2 PDLSCs的培养鉴定PDLSCs 抗波形蛋白染色阳性,抗角蛋白染色阴性,说明所提取的干细胞为间充质来源。PDLSCs的多向诱导分化实验结果显示,在成骨诱导培养21 d后,PDLSCs可形成矿化结节,大小不一,茜素红染色阳性,而成脂诱导培养14 d的油红染色可见有脂滴形成。说明本研究的hPDLSCs有多向分化潜能,具有干细胞的特性。见图2。
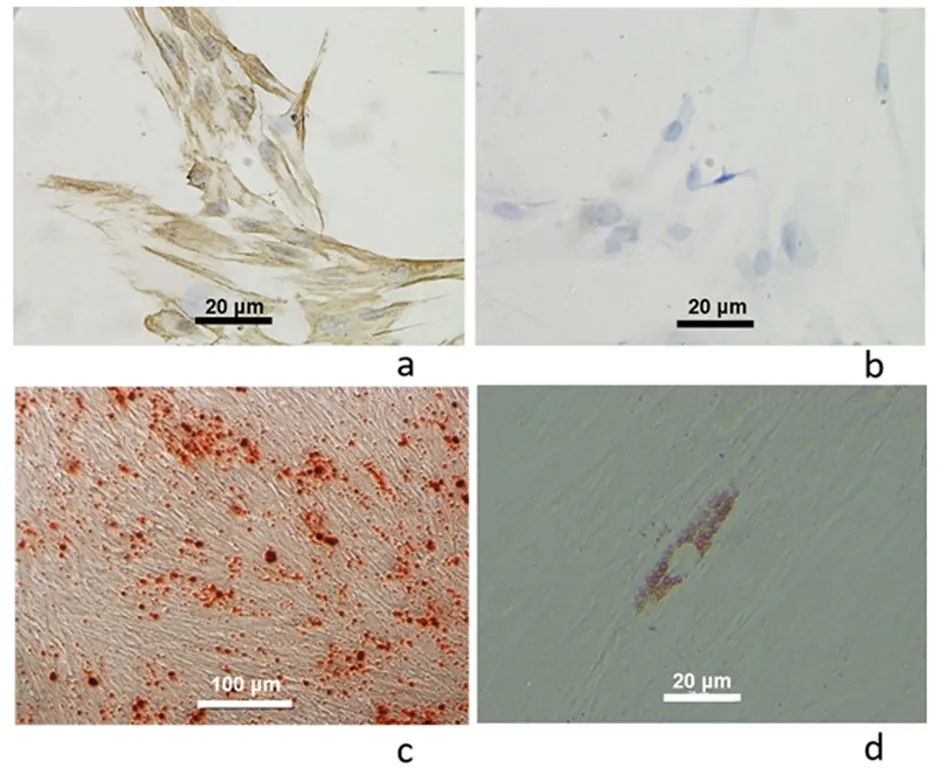
a:抗波形蛋白染色;b:抗角蛋白染色;c:成骨分化可见矿化结节;d:成脂诱导可见细胞内脂滴
图 2 PDLSCs的鉴定
Figure 2 The identification of hPDLSCs
2.3 GOQDs的生物相容性细胞毒性检测结果显示,各浓度(0、5、10、25、50 μg/mL)GOQDs的细胞活性差异无统计学意义(P>0.05),且24 h细胞活性与72 h比较无明显下降(P>0.05)。0、10、25、50 μg/mL的GOQDs对细胞增殖的影响差异无统计学意义(P>0.05)。0 μg/mL和50 μg/mL GOQDs的S期、G1期、G2期的细胞百分比差异无统计学意义(P>0.05),对细胞周期不产生影响。因此选取后续实验的标记浓度为50 μg/mL。见图3。
2.4 GOQDs荧光标记hPDLSCs在加入GOQDs培养24 h时,可见量子点进入细胞质内,405 nm处显示蓝光,而随着孵育时间延长,GOQDs在细胞内出现累积现象,细胞形貌更为明显,荧光强度增强。见图4。

a: 细胞毒性;b: 细胞增殖;c、d:分别为0、50 μg/mL GOQDs细胞周期百分比
图 3 GOQDs的生物相容性
Figure 3 The biocompatibility of GOQDs
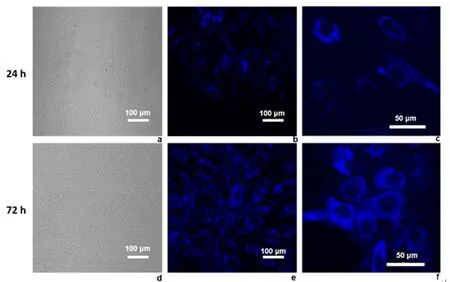
a、d:激光共聚焦显微镜; b、c、e、f:荧光标记
图示随着孵育时间延长,GOQDs在细胞内出现累积现象,细胞形貌更为明显,荧光强度增强
图 4 PDLSCs与GOQDs共培养时荧光显微镜图片
Figure 4 Thefluorescent images of PDLSCs when co-culture with GOQDs
3 讨 论
酶解组织块法是一种高效的原代培养PDLSCs的方法[3]。本研究前期证实在组织工程领域,有序静电纺丝可诱导PDLSCs骨向分化, PDLSCs在组织工程中具有潜在应用价值[5]。既往研究,已有大量关于牙源性成体干细胞PDLSCs作为种子细胞进行组织修复的文献报道[6]。hPDLSCs可获取于离体的智齿或者正畸减数牙,具有较强的增殖分化能力。牙周膜干细胞用于治疗疾病的研究目前多处于体外及动物模型阶段,因而对干细胞的有效、无创荧光标记方法的选择显得尤其重要。
纳米材料和纳米医药的发展,为活细胞生物标记技术提供了新思路[7]。氧化石墨烯是石墨烯的氧化衍生物,具有优秀的理化性能及生物学性能,能够进一步的功能化,作为药物/基因载体、同时具有标记作用[8-9]、组织工程[10]等。石墨烯量子点在多种细胞的活细胞标记当中被应用研究[11],包括神经干细胞[12]、牙髓干细胞[13]、Hela细胞[14]、人肺癌及乳腺癌细胞[15]等。PDLSCs作为牙周组织再生工程中良好的种子细胞,石墨烯量子点标记PDLSCs活细胞对于PDLSCs存活力及治疗效果评估意义重大。既往的研究报道中,尚缺乏应用PDLSCs作为标记对象的石墨烯基材料的相关实验数据。本研究首次采用GOQDs对PDLSCs进行体外标记,进一步证实了GOQDs在干细胞体外标记领域的应用。本研究所用的GOQDs由TEM图可见,粒径较小,在10 nm以内,分散性好,在水溶液中能够长期稳定;DLS结果表明GOQDs在完全培养基中能够形成稳定的胶体溶液,石墨烯量子点材料的分散性和稳定性是其较为关键的性能。此外,GOQDs的荧光性能是与石墨烯的主要区别之一,也是其重要特性之一。在紫外-可见吸收光谱的插图中可见,GOQDs具有明显的蓝色荧光,在365 nm左右的吸收峰可知,GOQDs在该激发波长下,于455 nm左右处有较好的发射,波谱较宽。以上检测说明本研究的GOQDs具有良好的荧光效果。
纳米材料的生物标记应用的前提应当是其具有较低的生物毒性[16]。在干细胞用于组织再生治疗的过程当中,细胞的活性以及细胞在局部存留的数量显得尤其重要[17],甚至能够直接影响再生的水平。本研究发现,在选择的标记浓度下,GOQDs对细胞的活性、增殖及周期并无影响,说明材料在一定的应用浓度范围内生物安全性能良好。使用本文的量子点材料标记牙髓干细胞同样发现生物相容性良好,同时荧光标记时间长[12]。另外,Yang等[18]关于乳牙牙髓干细胞的验证中,发现GOQDs除了荧光标记作用,还能够促进干细胞的成骨分化。本研究中,GOQDs标记PDLSCs的荧光效果图片可见,GOQDs孵育后的细胞形貌正常,在激发波长为405 nm时,细胞激发蓝光,且随着孵育时间的增加,细胞的形貌更为清晰,说明GOQDs易进入细胞,并且主要位于细胞质和细胞膜,与之前的研究[19]类似。本研究采用GOQDs与PDLSCs共培养后经荧光显微镜观测发现,量子点在进入细胞前后,细胞形态及各项细胞功能指标(细胞的活性、增殖及周期)均无明显变化,提示GOQDs对PDLSCs具有荧光标记作用且不影响干细胞在体外的生物学行为。
综上所述,本研究结果表明,GOQDs材料具有良好的材料学性能,其稳定性、荧光性能较好,且对干细胞的活性影响较小,生物相容性良好,在PDLSCs的活细胞标记当中,具有一定的应用潜能。
