吲哚衍生物的合成及其海洋防污性能
2020-07-15陈俊华杨建新
董 苗, 胡 玥, 陈俊华, 林 强, 杨建新*
(1. 海南大学 化学工程与技术学院 海南省精细化工工程技术研究中心,海南 海口 570228;2. 海南师范大学 化学与化工学院,海南 海口 571158)
在开发和利用海洋资源的过程中,常常会面对由海洋生物污损引发的问题[1]。海洋生物污损是指海洋动物、植物和微生物附着在海洋固体物表面并生长繁殖的现象。这会给海洋设施和海洋生产科研活动造成严重危害[2]。例如降低航速、增加航行阻力、腐蚀船底和破坏船体等。为了减少海洋生物污损对海洋经济活动的影响,研究人员开发了形式多样的海洋防污技术,以减少海洋污损生物的危害[3-4]。
有机锡防污涂料是一种高效、广谱的海洋防污涂料。然而,这种涂料会在生物体内沉积,并可能沿着食物链影响人类健康。因此,国际海事组织(IMO)明确禁止在船舶上使用有机锡防污涂料[5]。除有机锡防污涂料,氧化亚铜防污涂料的使用率也较高。这种涂料长期使用后会造成铜元素富集效应,造成海藻等死亡[6]。
吲哚类化合物具有良好的生物活性和环境安全性,广泛应用于农药、医药和香料等领域[7-9]。吲哚化合物在海洋船舶防污涂料中也表现出潜在应用前景。Olguin等[10]发现6-溴吲哚-3-甲醛和2,5,6-三溴-1-甲基-3-二甲胺基吲哚对藤壶幼虫的EC50分别为5 μg/mL和1 μg/mL,其防污活性是三丁基氧化锡的两倍,5,6-二氯-1-甲基-3-二甲胺基吲哚的防污活性是三丁基氧化锡的4倍[11]。
本文以吲哚为原料,与碳酰氯或磺酰氯反应,合成了7个N-酰基取代的吲哚化合物(a~g, Scheme 1),其结构经1H NMR和元素分析确证。研究了化合物对球等鞭金藻、亚心形扁藻和舟形藻以及藤壶幼虫的生长抑制活性。
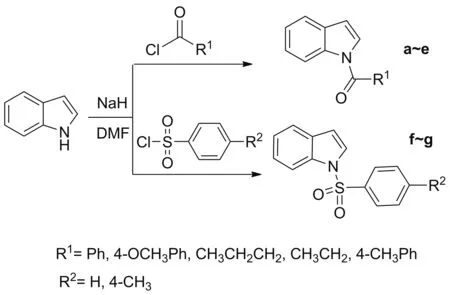
Scheme 1
1 实验部分
1.1 仪器与试剂
ZF-1型紫外分光光度计;BRUKER AV-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Vario Micro cube型元素分析仪;XTS30型体视显微镜。
所用试剂均为分析纯。
1.2 a~g的合成(以a为例)
在50 mL两口烧瓶中,依次加入NaH 0.38 g(0.015 mol)和无水DMF 10 mL,氮气保护,搅拌下于室温反应10 min。缓慢滴加0.94 g(0.008 mol)吲哚的DMF(10 mL)溶液,滴毕,搅拌下反应30 min。缓慢滴加酰氯,滴毕,搅拌下反应4 h。加入60 mL去离子水,用乙酸乙酯(35 mL)萃取,合并有机相,依次用去离子水洗涤,无水MgSO4干燥,减压蒸除乙酸乙酯得深黄色黏稠液体,经硅胶柱层析(乙酸乙酯/石油醚=1/20)纯化得a。
用类似的方法合成b~g。
N-苯甲酰基吲哚(a): 淡黄色液体,产率78.9%;1H NMR(400 MHz, CDCl3)δ: 8.44(d,J=8.0 Hz, 1H), 7.78(d,J=8.0 Hz, 2H), 7.63~7.66(m, 2H), 7.57(t,J=7.6 Hz, 2H), 7.43(t,J=7.6 Hz, 1H), 7.37(d,J=8.0 Hz, 1H), 7.34(d,J=3.6 Hz, 1H), 6.66(d,J=3.6 Hz, 1H); IRν: 3050(C=C), 1691(C=O), 1537, 1456(C=C), 1339(C—N), 722(C—H) cm-1; Anal. calcd for C15H11NO: C 81.43, H 5.01, N 6.33, found C 81.40, H 4.96, N 6.36。
N-对甲氧苯甲酰基吲哚(b): 淡黄色液体,产率56.1%;1H NMR(400 MHz, CDCl3)δ: 8.35(d,J=8.4 Hz, 1H), 7.77~7.72(m,J=8.0 Hz, 2H), 7.62(d,J=3.6 Hz, 1H), 7.40~7.34(m, 2H), 7.30(t,J=8.0 Hz, 1H), 7.05~6.98(m, 2H), 6.63(d,J=3.6 Hz, 1H), 3.90(s, 3H); IRν: 3056(C=C), 2957(CH3), 1630(C=O), 1556, 1461(C=C), 1380(CH3), 1344(C—N), 759(C—H) cm-1; Anal. calcd for C16H13NO2: C 76.48, H 5.21, N 5.47, found C 76.41, H 5.19, N 5.39。
N-丁酰基吲哚(c): 淡黄色液体,产率67.8%;1H NMR(400 MHz, CDCl3)δ: 8.52(d,J=8.4 Hz, 1H), 7.60(d,J=7.6 Hz, 1H), 7.51(d,J=4.0 Hz, 1H), 7.39(t,J=8.0 Hz, 1H), 7.31(t,J=8.0 Hz, 1H), 6.68(d,J=4.0 Hz, 1H), 2.94(t,J=7.2 Hz, 2H), 1.87~1.97(m,J=7.2 Hz, 2H), 1.12(t,J=7.2 Hz, 3H); IRν: 3058(C=C), 2962(CH3), 2924(CH2), 1709(C=O), 1635(C=C), 1537, 1453(C=C), 1384(CH3), 1339(C—N), 750(C—H) cm-1; Anal. calcd for C12H13NO: C 76.98, H 7.00, N 5.48, found C 76.91, H 6.96, N 5.39。
N-丙酰基吲哚(d): 淡黄色液体,产率53.3%;1H NMR(400 MHz, CDCl3)δ: 8.51(d,J=8.0 Hz, 1H), 7.60(d,J=8.0 Hz, 1H), 7.52(d,J=4.0 Hz, 1H), 7.39(t,J=8.0 Hz, 1H), 7.32(t,J=7.6 Hz, 1H), 6.68(d,J=4.0 Hz, 1H), 2.98~3.03(m,J=7.2 Hz, 2H), 1.39(t,J=7.2 Hz, 3H); IRν: 3058(C=C), 2960(CH3), 2925(CH2), 1710(C=O), 1634(C=C), 1537, 1454(C=C), 1382(CH3), 1344(C—N), 743(C—H) cm-1; Anal. calcd for C11H11NO: C 76.28, H 6.40, N 5.44, found C 76.33, H 6.32, N 5.39。
N-对甲苯甲酰基吲哚(e): 淡黄色液体,产率57.6%;1H NMR(400 MHz, CDCl3)δ: 8.42(d,J=8.4 Hz, 1H), 7.69(d,J=8.0 Hz, 2H), 7.64(d,J=7.6 Hz, 1H), 7.42(t,J=8.0 Hz, 1H), 7.35(m, 4H), 6.65(d,J=3.6 Hz, 1H), 2.50(s, 3H); IRν: 3052(C=C), 2964(CH3), 1678(C=O), 1607(C=C), 1542, 1450(C=C), 1382(CH3), 1344(C—N), 750(C—H) cm-1; Anal. calcd for C16H13NO: C 81.68, H 5.57, N 5.95, found C 81.62, H 5.54, N 5.93。
N-苯磺酰基吲哚(f): 白色片状晶体,产率61.9%;1H NMR(400 MHz, CDCl3)δ: 8.04(d,J=8.4 Hz, 1H), 7.92(d,J=8.0 Hz, 2H), 7.61(d,J=3.6 Hz, 1H), 7.55~7.58(m, 2H), 7.47(t,J=8.0 Hz, 2H), 7.35(t,J=8.0 Hz, 1H), 7.23(t,J=7.6 Hz, 1H), 6.71(d,J=3.6 Hz, 1H); IRν: 3056(C=C), 1633(C=C), 1545, 1445(C=C), 1371(C—N), 1177, 1128(O=S=O), 726(C—H) cm-1; Anal. calcd for C14H11NO2S: C 65.35, H 4.37, N 5.44, found C 65.33, H 4.32, N 5.39。
N-对甲苯磺酰基吲哚(g): 白色针状晶体,产率66.7%;1H NMR(400 MHz, CDCl3)δ: 7.98(d,J=8.4 Hz, 1H), 7.76(d,J=8.4 Hz, 2H), 7.57(d,J=3.6 Hz, 1H), 7.53(d,J=8.4 Hz, 1H), 7.31(t,J=7.2 Hz, 1H), 7.21~7.24(m, 3H), 6.66(d,J=3.6 Hz, 1H), 2.34(s, 3H); IRν: 3031(C=C), 2958(CH3), 1632(C=C), 1493, 1444(C=C), 1368(C—N), 1171, 1127(O=S=O), 679(C—H) cm-1; Anal. calcd for C15H13NO2S: C 66.40, H 4.83, N 5.16, found C 66.33, H 4.72, N 5.27。
1.3 抑藻活性测试
参考文献[12]方法测定稀释液的吸光值和藻液浓度平均值,绘制藻液浓度(y)和吸光值(x)之间的线性回归方程。配制0.1 g/mL的测试化合物溶液,取1 mL加入锥形瓶中,每个化合物设定3组平行样,以纯藻液为阴性对照,吲哚(YD)的藻液为阳性对照。每隔12 h测定各锥形瓶内藻液的吸光度值,根据线性回归方程换算出对应的藻液浓度,绘制时间-藻液浓度曲线[13]。
1.4 抑制藤壶幼虫生长实验
参考文献[14]方法进行藤壶幼虫生长抑制实验。配制浓度为3.0、 2.5、 2.0、 1.5、 1.0 mg/L的待测化合物溶液,每个培养皿中放置30只新鲜的藤壶幼虫,分别加入化合物,在12 h、 24 h时用显微镜观察,记录每个培养皿中藤壶幼虫的存活情况。藤壶幼虫停止游动超过15 s,可认为已经死亡。及时取出已经死亡的幼虫,防止影响实验的准确性。
1.5 浅海挂板实验
按《防污漆样板浅海浸泡试验方法》(GB/T 5370-2007),研究a~g的防污性能[15]。以a~g为防污剂,制备涂料。涂料基料采用丙烯酸磁漆,受试化合物的质量浓度为10%,对照组为含相同浓度的YD涂料实验样板及空白样板。将制作好的实验样板做好标记并以拍照方式记录初始状态,平均浸海深度为1 m,每月观察一次并记录。实验地点为海南省海口市秀英港码头。
2 结果与讨论
2.1 表征
以化合物a为例,分析了目标化合物的1H NMR谱图(图略)。由图可知,苯环氢的特征峰位于δ8.43~8.45, 7.77~7.79, 7.63~7.66, 7.57~7.59, 7.33~7.37,五元环中双键氢的特征峰位于δ7.41~7.44, 6.65~6.66。
2.2 藻类生长抑制活性
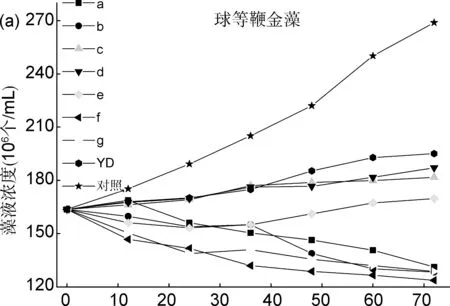
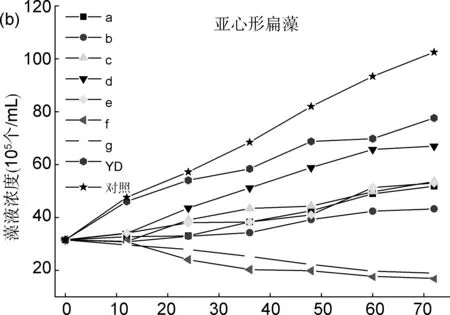
以时间(h)为横坐标,根据藻液浓度(y)-吸光值(x)的线性回归方程,换算出藻液浓度为纵坐标,分析了目标化合物a~g在72 h内对藻类的生长影响情况(图1)。
时间/h
时间/h
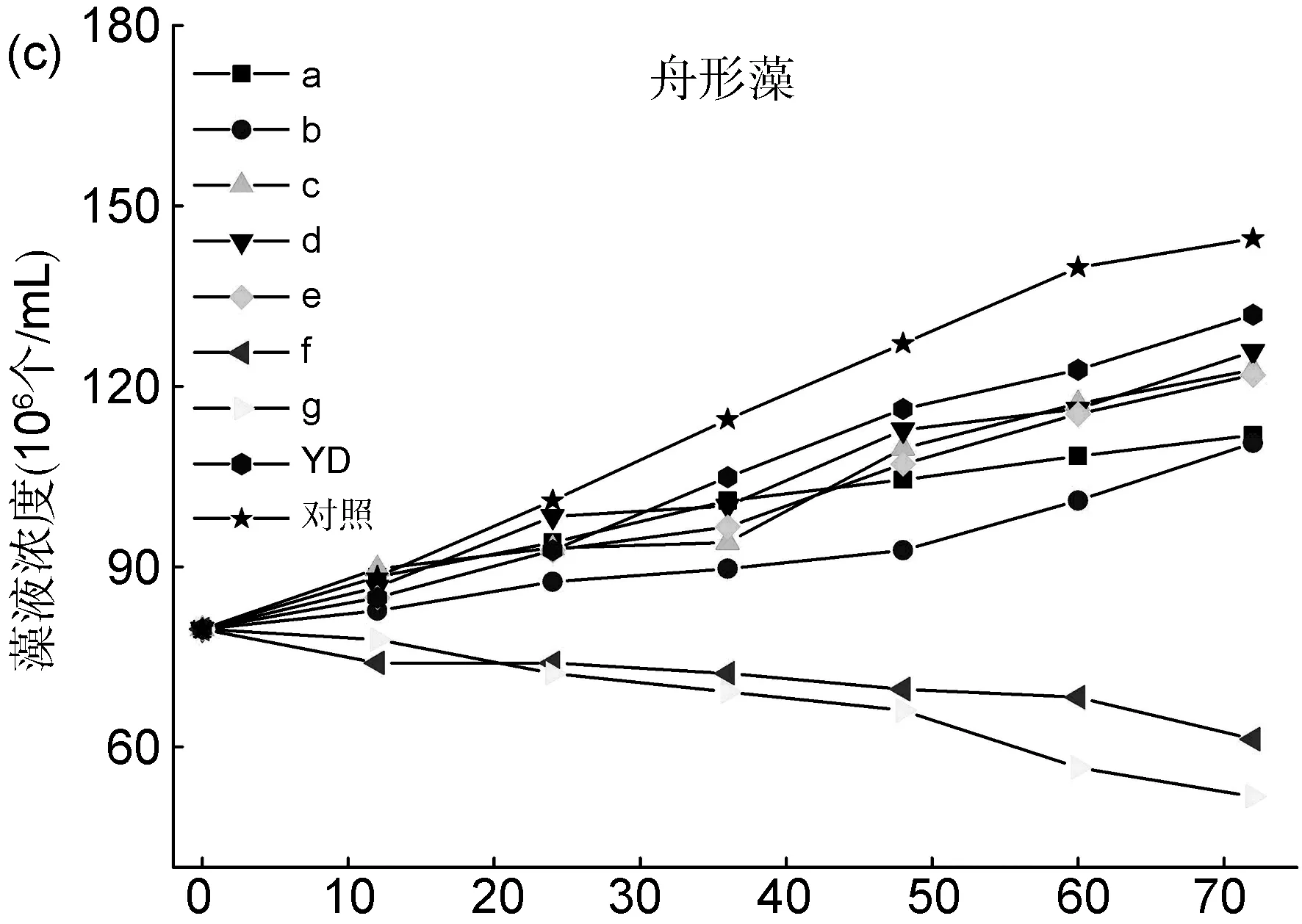
时间/h图 1 目标化合物a~g在72 h内对球等鞭金藻(a)、亚心形扁藻(b)和舟形藻(c)的生长影响情况
由图1a可知,培养24 h后,苯甲酰基取代的化合物a对球等鞭金藻的抑制作用显著,随着时间的延长,化合物a、b、f、g随时间的增加抑制作用增强。加入苯磺酰基取代化合物f、g的藻液浓度在72 h内一直较低,且随时间的延长持续下降。说明苯磺酰基取代化合物的抑制作用比苯甲酰基类化合物强。对于苯甲酰基取代的化合物b,藻液培养浓度持续低于化合物e的浓度,说明苯环上连接吸电子基团的化合物(b)对球等鞭金藻生长抑制作用优于连接供电子基的化合物(e)。
图1b为目标化合物对亚心形扁藻的生长影响。由图可知,含有待测化合物的藻液在培养12 h后,所有测试的化合物作用均不明显,说明该种藻类对这种化合物表现出较好的耐受性。培养时间延长到24 h,测试化合物开始表现出对亚心形扁藻的抑制作用。其中,磺酰基取代的化合物f和g的藻液在72 h内,藻液浓度一直处于较低水平,且随着时间的增长逐渐降低,明显优于苯甲酰基取代的化合物及对照组YD。
图1c为目标化合物对舟形藻的生长影响。由图可知,培养时间超过24 h,化合物f、g与其它化合物的差异非常明显:随着培养时间增长显示出明显的抑制作用,且连接供电子基团(CH3)时,对藻类生长抑制作用增强。
综上可知,化合物f、g对3种藻类的抑制活性最好。整体而言,各化合物对球等鞭金藻的抑制活性较高,舟形藻较低,亚心形扁藻居中。
2.3 藤壶幼虫生长抑制实验结果
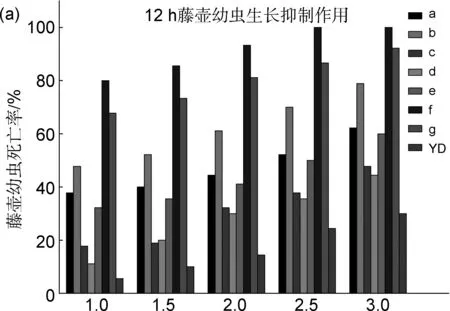
图2为目标化合物溶液对藤壶幼虫的抑制率。由图2可知,化合物对藤壶幼虫均有一定的生长抑制作用,且效果均优于对照组YD。其中,以1.0 mg/L待测化合物溶液培养藤壶幼虫12 h,苯磺酰基取代的吲哚化合物f和g的溶液中藤壶幼虫死亡率较高(80%和67.78%),其次为苯甲酰基取代的化合物a和b(37.78%和47.78%),说明在此浓度下化合物f和g的抑制作用较强。
表1为化合物的半致死浓度(LC50)[16]。由表1可知,目标化合物在 12 h和24 h的LC50均低于对照组YD,说明目标化合物对藤壶幼虫生长抑制作用均强于YD。
浓度/mg/L
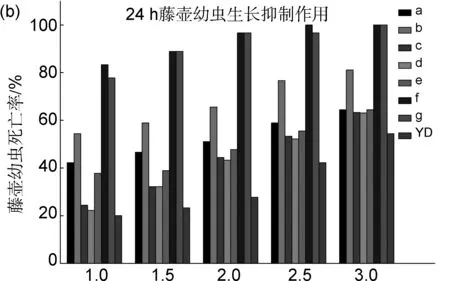
浓度/mg/L图 2 藤壶幼虫12 h(a)和24 h(b)的死亡率
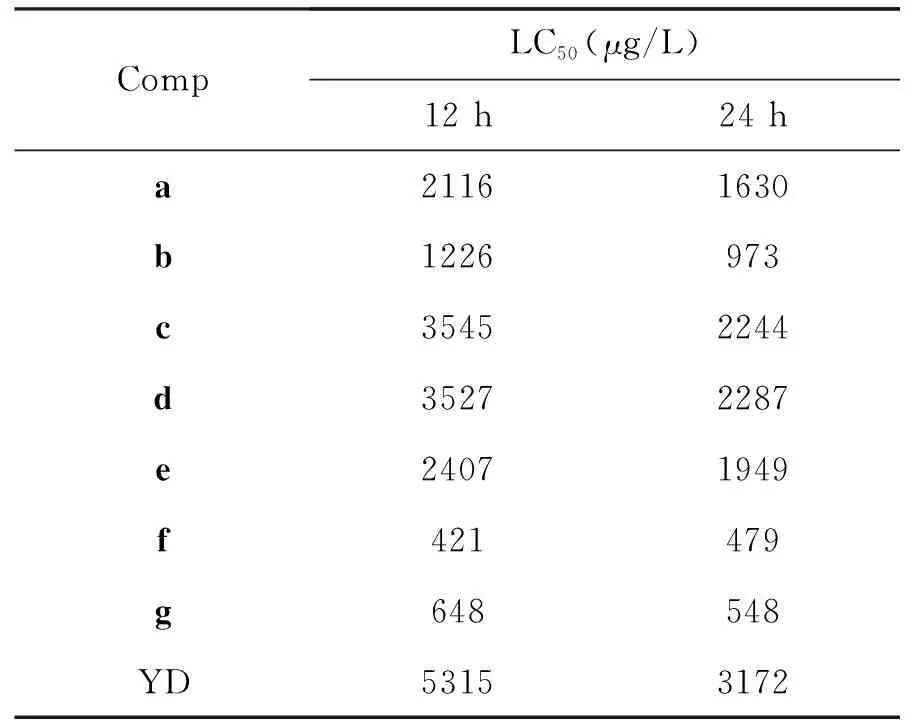
表 1 化合物a~g对网纹藤壶二期无节幼虫的LC50
2.4 浅海挂板实验
图3为海洋挂板90 d后,实验板的变化情况。图4为生物统计数据图,横坐标为藤壶的平均密度。由图可知,以合成的系列吲哚类化合物作为防污剂,涂料漆膜表面成体藤壶生长平均密度为98~574个/m2,远低于对照组YD的平均生长密度(1288个/m2)和空白实验样板的平均密度(2111个/m2)。其中以化合物f为防污剂的实验样板表面光滑,几乎没有藻类沉积,仅有少量藤壶及牡蛎等污损生物附着,藤壶附着平均密度均小于100个/m2,防污性能最好。
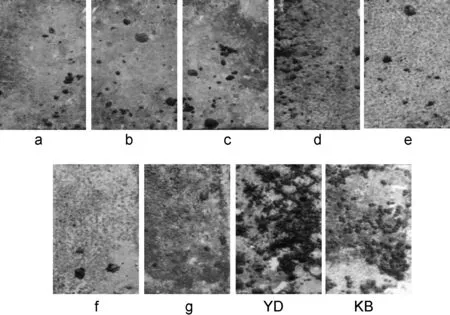
图 3 浸海实验样板照片

个/m2图 4 藤壶的平均密度
3 结论
以吲哚为底物,合成了系列N-酰基取代吲哚衍生物并测试了它们对部分海洋藻类和藤壶幼虫的生长抑制活性。结果表明,当吲哚结构连接电负性较高的基团时,化合物对藻类和藤壶幼虫的生长抑制性较好,其中以连接苯磺酰基化合物的抑制效果最佳。目标化合物对藤壶幼虫12 h和24 h的半致死浓度(LC50)明显低于底物吲哚,其中以苯磺酰基取代的化合物最低。采用目标化合物制备的海洋防污涂料,浅海挂板90 d后,对海洋污损生物的附着表现出明显的抑制作用。
