miR-19b-3p靶向LRIG1调控喉癌细胞凋亡和放射敏感性分子机制研究
2020-07-13刘磊峰邱海涛惠明朗王代红庄双豪
刘磊峰 邱海涛 江 枫 惠明朗 王代红 庄双豪 姚 俊
(广东医科大学附属医院耳鼻咽喉科,湛江 524000)
喉癌是一种呼吸道恶性肿瘤,其发病率仅次于肺癌,但患者5年生存率低于50%。放射治疗对喉癌的疗效较好,但肿瘤细胞放射抵抗性是导致患者放射治疗后复发的重要原因[1]。因而积极探寻喉癌细胞放射抵抗性相关标志物对提高患者治疗效果及其生活质量均具有重要现实意义。研究表明微小RNA-19b(microRNA-19b,miR-19b)在非小细胞肺癌组织中高表达,并可参与其发生及发展过程[2]。miR-19b在黑素瘤细胞中表达升高,可能作为黑素瘤治疗的潜在靶点[3]。miR-19b-3p在结肠癌组织及细胞系中表达上调,并可促进结肠癌细胞增殖[4]。miR-19b-3p在鼻咽癌中表达上调,miR-19b-3p过表达可降低鼻咽癌细胞的放射敏感性,抑制miR-19b-3p表达可增强鼻咽癌细胞的放射敏感性[5]。但miR-19b-3p在喉癌组织及细胞中的表达及其对喉癌细胞放射敏感性的影响尚未可知。富含亮氨酸重复和免疫球蛋白样结构域(lecucine-nich repeats animmunoglobulin-like domains-1,LRIG1)在食管癌和胃癌组织中低表达,提示其可能有抑癌作用[6,7]。LRIG1在口腔疣状癌组织中表达降低,可能通过抑制Bcl-2的表达抑制口腔疣状癌的发生发展[8]。胶质瘤SHG44细胞中过表达LRIGl基因,可通过下调EGFR表达,抑制sHG44细胞的恶性生物学行为,增加放疗敏感性[9]。通过靶基因预测,miR-19b-3p的靶基因可能是LRIG1,但miR-19b-3p是否通过调控LRIG1的表达影响喉癌细胞的凋亡和放射敏感性目前还尚未可知。因此,本研究通过体外观察miR-19b-3p表达对喉癌细胞凋亡及放射敏感性的影响分析其是否靶向调控LRIG1而发挥作用,为增强喉癌细胞放射敏感性奠定理论基础。
1 材料与方法
1.1材料
1.1.1实验细胞与主要试剂 喉癌Hep2细胞购自中国科学院上海生命科学研究院细胞资源中心。RPMI1640培养基与胎牛血清均购自美国Gibco公司;Lipofectamine2000转染试剂、TRIzol试剂、反转录试剂盒均购自美国Invitrogen公司;SYBR Green PCR试剂盒购自罗氏公司;双荧光素酶报告基因检测试剂盒购自上海碧云天生物技术有限公司;LRIG1、B淋巴细胞瘤-2(Bcl-2)、B淋巴细胞瘤-2相关蛋白(Bax)、活化的半胱氨酸天冬氨酸蛋白酶-3(cleaved-caspase3)抗体均购自美国Abcam公司;辣根过氧化物酶(HRP)标记的IgG二抗购自美国Santa Cruz公司;miR-19b-3p抑制剂(anti-miR-19b-3p)、miR-19b-3p模拟物(miR-19b-3p mimics)、si-LRIG1及其各自阴性对照均购自上海吉玛生物科技有限公司;Annexin V-FITC/PI凋亡检测试剂盒购自美国Sigma公司;增强化学发光试剂盒购自武汉博士德生物公司。
1.1.2研究对象及一般资料 以2016年2月~2017年12月本院收治的30例喉癌患者为研究对象,所有患者均经临床病理证实为喉癌,男16例,女14例,年龄为56~75岁,平均为(65.47±3.56)岁,患者均接受手术并于术中切取喉癌组织及癌旁组织,迅速放入液氮中,术后将其转移至-80℃超低温冰箱。所有患者术前均未接受放疗或化疗,本研究经本院伦理委员会批准,所有患者知情且签署同意书。
1.2方法
1.2.1细胞转染与分组 喉癌Hep2细胞放入含有10%胎牛血清及青霉素-链霉素的RPMI1640培养基,培养于含有5%CO2的37℃恒温培养箱,待细胞培养融合度达到80%时转染。将喉癌Hep2细胞分为anti-miR-19b-3p组(转染miR-19b-3p抑制剂anti-miR-19b-3p)、anti-miR-NC组(转染miR-19b-3p的阴性对照)、pcDNA-LRIG1组(转染LRIG1过表达载体pcDNA-LRIG1)、pcDNA组(转染LRIG1空载体)、anti-miR-19b-3p+si-LRIG1组(共转染anti-miR-19b-3p与si-LRIG1)、anti-miR-19b-3p+si-NC组(共转染anti-miR-19b-3p与si-NC)、miR-19b-3p组(转染miR-19b-3p mimics)、miR-NC组(转染miR-19b-3p阴性对照)。转染后6 h换液,加入含有10%胎牛血清的新鲜完全培养液。置于含有5%CO2的37℃恒温培养箱继续培养48 h。anti-miR-19b-3p组、anti-miR-NC组、pcDNA组、pcDNA-LRIG1组、anti-miR-19b-3p+si-NC组 anti-miR-19b-3p+si-LRIG1组分别接受0、2、4、6、8 Gy照射,照射条件为:源皮距100 cm,照射野(35 cm×35 cm),5 Gy/min剂量率,实验均重复3次。
1.2.2qRT-PCR检测喉癌组织及Hep2细胞中miR-19b-3p、LRIG1 mRNA表达 分别收集喉癌组织及各组对数生长期Hep2细胞,采用TRIzol法检测miR-19b-3p、LRIG1 mRNA表达,反转录试剂盒合成cDNA,反转录体系20 μl:10×RT Primer 2 μl、10×RT Buffer 2 μl、dNTP Mixtrue 1 μl、Quant KTase 0.5 μl、上、下游引物各1.5 μl RNase-free ddH2O 11.5 μl。miR-19b-3p上游引物为:5′-TGTCATAATCACTGTGCAAATCC-3′,下游引物为:5′-TATGGTTGTTCAGCTCTCTGTCTC-3′,产物120 bp;LRIG1上游引物为5′-AGATCGCCTGGCAGAAAGAC-3′,下游引物为:5′-ACGGTGGTCCTTCATTTCCT-3′。产物460 bp。qRT-PCR反应体系20 μl:2×miRcute miRNA Premix 10 μl、上下游引物各0.4 μl、cDNA 2 μl、RNase-free ddH2O 7.2 μl;反应程序:95℃预变性2 min循环1次;95℃变性30 s,60℃退火45 s,72℃延伸30 s循环40次。LRIG1以GAPDH为内参基因,miR-19b-3p以U6为内参基因,所有样本均设置3次重复,以2-ΔΔCt法计算miR-19b-3p、LRIG1 mRNA相对表达量。
1.2.3蛋白免疫印迹(Western blot)检测喉癌组织及细胞中LRIG1、Bcl-2、Bax、cleaved-caspase3蛋白表达 收集喉癌组织及各组Hep2细胞,预冷PBS洗涤细胞2次×5 min,加入400 μl裂解液(Tris-HCl、NaCl、EDTA、NP-40、PMSF、pepstain A),加入20 μg 蛋白样本进行SDS-PAGE电泳,转膜,加入一抗孵育24 h(1∶400)、加入二抗孵育1 h(1∶1 000),应用Image J软件分析蛋白条带灰度值。
1.2.4检测细胞凋亡率 按照细胞凋亡检测试剂盒说明书操作,用预冷的PBS洗涤转染后各组喉癌Hep2细胞,加入100 μl binding缓冲液重悬细胞,调整细胞密度为1×106个/ml,加入5μl Annexin V-FITC(避光孵育15 min,1 000 r/min离心3 min)与5 μl PI(避光孵育15 min),上机于1 h内流式细胞仪检测细胞凋亡。
1.2.5克隆形成实验 收取转染后各组经不同照射剂量X线照射的喉癌Hep2细胞,用胰蛋白酶消化,收集细胞后置于10 ml EP管,加入RPMI1640培养基重悬细胞,重新计数,稀释细胞后接种于6孔板,每组每孔分别接种1 000个细胞,每组均设置3个复孔,置于37℃恒温培养箱培养10~14 d,每隔2 d 更换一次培养液;用无水乙醇固定20 min,加入0.5%结晶紫染色30 min,洗去多余染液,风干后置于显微镜下观察克隆数,细胞克隆形成率=(有效克隆数/接种细胞)×100%,细胞存活分数=(受照射细胞克隆形成率/对照细胞克隆形成率)×100%,同时用细胞存活分数拟合单击-多靶模型曲线,每组实验均重复3次。
1.2.6双荧光素酶报告基因实验 利用Target Scans靶基因预测软件筛选出LRIG1可能为miR-19b-3p的靶基因,发现LRIG1的3′非翻译区(3′UTR)可能是miR-19b-3p的结合位点。将含有miR-19b-3p结合位点的LRIG1 3′UTR序列及其突变体插入荧光素酶报告基因载体中得到WT-LRIG1、MUT-LRIG1,另将喉癌Hep2细胞接种于24孔板,miR-19b-3p mimic或miR-NC分别与WT-LRIG1、MUT-LRIG1共转染入喉癌Hep2细胞,置于含有5%CO2的37℃恒温培养箱内继续培养24 h,收集细胞,细胞裂解后置于室温下振荡20 min,采用双荧光素酶报告基因检测试剂盒检测细胞荧光素酶活性。

2 结果
2.1miR-19b-3p和LRIG1在喉癌组织中的表达 miR-19b-3p在喉癌组织中的表达水平较癌旁组织明显升高(P<0.05),而LRIG1 mRNA及蛋白表达水平均显著降低(P<0.05),见图1。
2.2抑制miR-19b-3p表达对喉癌Hep2细胞凋亡的影响 qRT-PCR实验验证转染anti-miR-19b-3p的转染效果,结果显示,anti-miR-19b-3p组喉癌Hep2细胞中miR-19b-3p的表达水平与anti-miR-NC组相比明显降低(P<0.05)。流式细胞术检测结果显示,与anti-miR-NC组相比,anti-miR-19b-3p组喉癌Hep2细胞凋亡率显著增加(P<0.05),Bcl-2蛋白表达水平明显降低(P<0.05),而Bax、cleaved-caspase3蛋白表达水平均明显升高(P<0.05),见图2。表明抑制miR-19b-3p表达可通过调控细胞凋亡相关蛋白表达进而诱导喉癌细胞凋亡。
2.3抑制miR-19b-3p表达对喉癌Hep2细胞放射敏感性的影响 抑制miR-19b-3p表达后检测喉癌Hep2细胞存活分数变化,不同剂量(2、4、6、8 Gy)X线照射下,anti-miR-19b-3p组细胞存活率较anti-miR-NC组显著降低(P<0.05),单击-多靶模型分别拟合细胞存活曲线及模型参数,见图3、表1,anti-miR-19b-3p组喉癌Hep2细胞增敏比(SER)为1.654。表明抑制miR-19b-3p表达可增强喉癌Hep2细胞放射敏感性。
2.4LRIG1过表达对喉癌Hep2细胞凋亡和放射敏感性的影响 Western blot实验检测LRIG1过表达(P<0.05),明显促进Bax表达(P<0.05),而抑制Bcl-2表达转染效果,如图4A所示,pcDNA-LRIG1组喉癌Hep2细胞中LRIG1的蛋白表达水平较pcDNA组显著升高(P<0.05),提示转染成功。pcDNA-LRIG1组喉癌Hep2细胞凋亡率相较于pcDNA组显著升高(P<0.05),进一步用不同剂量X线照射结果显示,与pcDNA组相比,pcDNA-LRIG1组喉癌Hep2细胞存活分数明显降低(P<0.05),细胞增敏比(SER)为1.788,见图4、表2。表明LRIG1过表达可能通过促进喉癌Hep2细胞凋亡进而增强放射敏感性。

图1 miR-19b-3p和LRIG1在喉癌组织中的表达Fig.1 Expression of miR-19b-3p and LRIG1 in laryng-eal carcinoma

图2 抑制miR-19b-3p表达对喉癌Hep2细胞凋亡的影响Fig.2 Effect of inhibition of miR-19b-3p expression on apoptosis of laryngeal carcinoma Hep2 cells
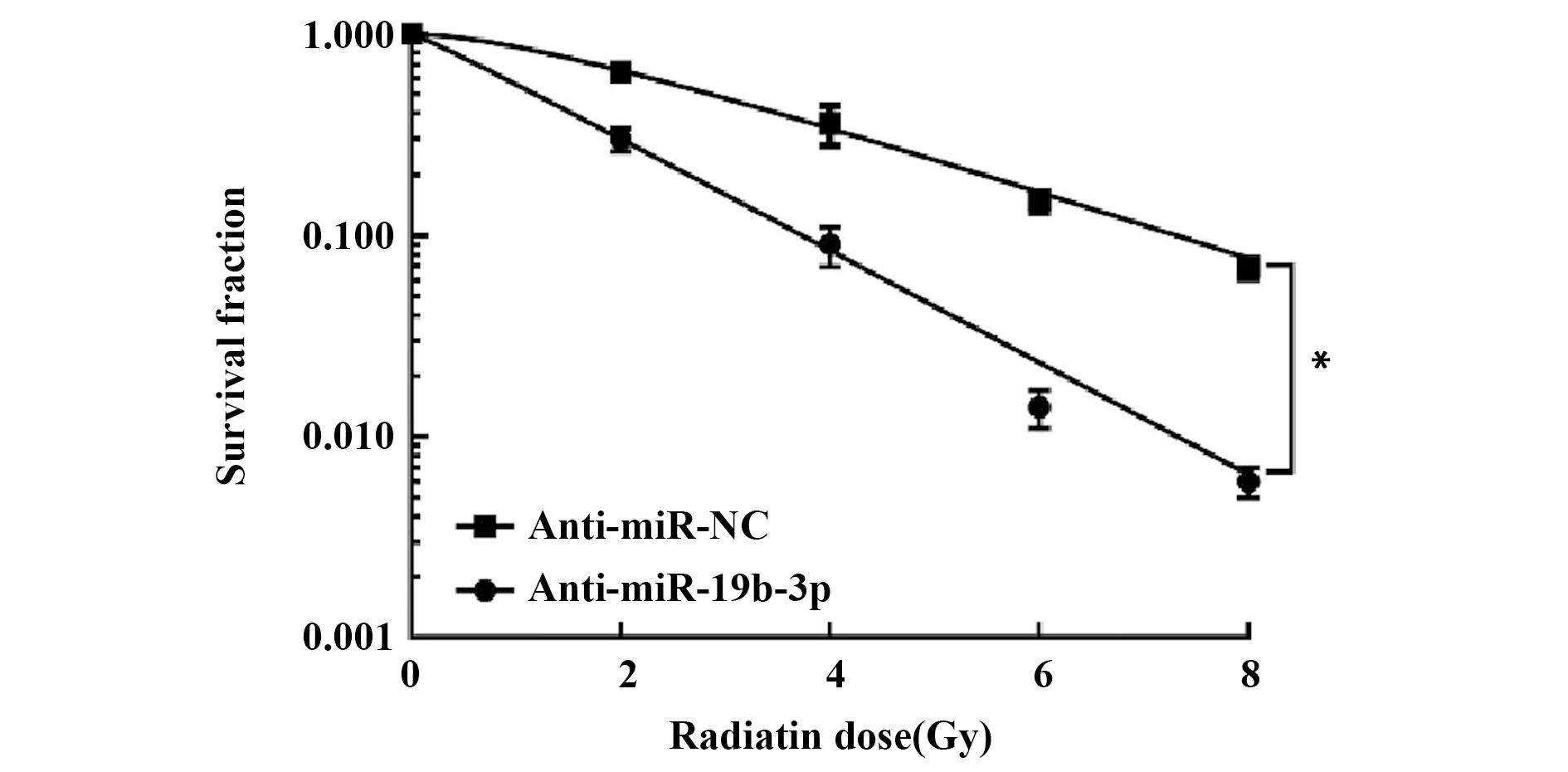
图3 抑制miR-19b-3p表达对喉癌Hep2细胞放射敏感性的影响Fig.3 Effect of inhibition of miR-19b-3p expression on radiosensitivity of laryngeal carcinoma Hep2 cells
2.5miR-19b-3p靶向调控LRIG1的表达 TargetScan预测miR-19b-3p靶基因,结果显示LRIG1可能为miR-19b-3p的功能性靶基因,miR-19b-3p预测结合LRIG1的3′UTR的靶点如图5A所示。共转染WT-LRIG1与miR-19b-3p mimics的荧光素酶活性较共转染WT-LRIG1、miR-NC的荧光素酶活性显著降低(P<0.05),而共转染MUT-LRIG1与miR-19b-3p mimics的荧光素酶活性与共转染WT-LRIG1、miR-NC的荧光素酶活性相比无显著性差异(P>0.05),见图5,表明LRIG1是miR-19b-3p的直接靶基因。与miR-NC组相比,miR-19b-3p组喉癌细胞中LRIG1的表达水平显著降低(P<0.05);与anti-miR-NC组相比,anti-miR-19b-3p组喉癌细胞中LRIG1的表达水平显著升高(P<0.05)。表明miR-19b-3p可负向调控靶基因LRIG1的表达。

表1 抑制miR-19b-3p的表达对Hep-2细胞增敏比及存活分数等相关参数的影响

图4 LRIG1过表达对喉癌Hep2细胞凋亡和放射敏感性的影响Fig.4 Effect of LRIG1 overexpression on apoptosis and radiosensitivity of laryngeal carcinoma Hep2 cells
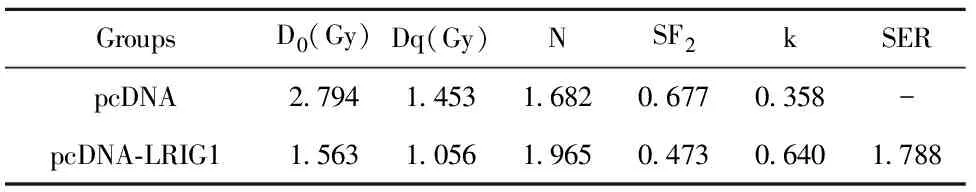
表2 LRIG1过表达对喉癌Hep2细胞增敏比及存活分数等相关参数的影响
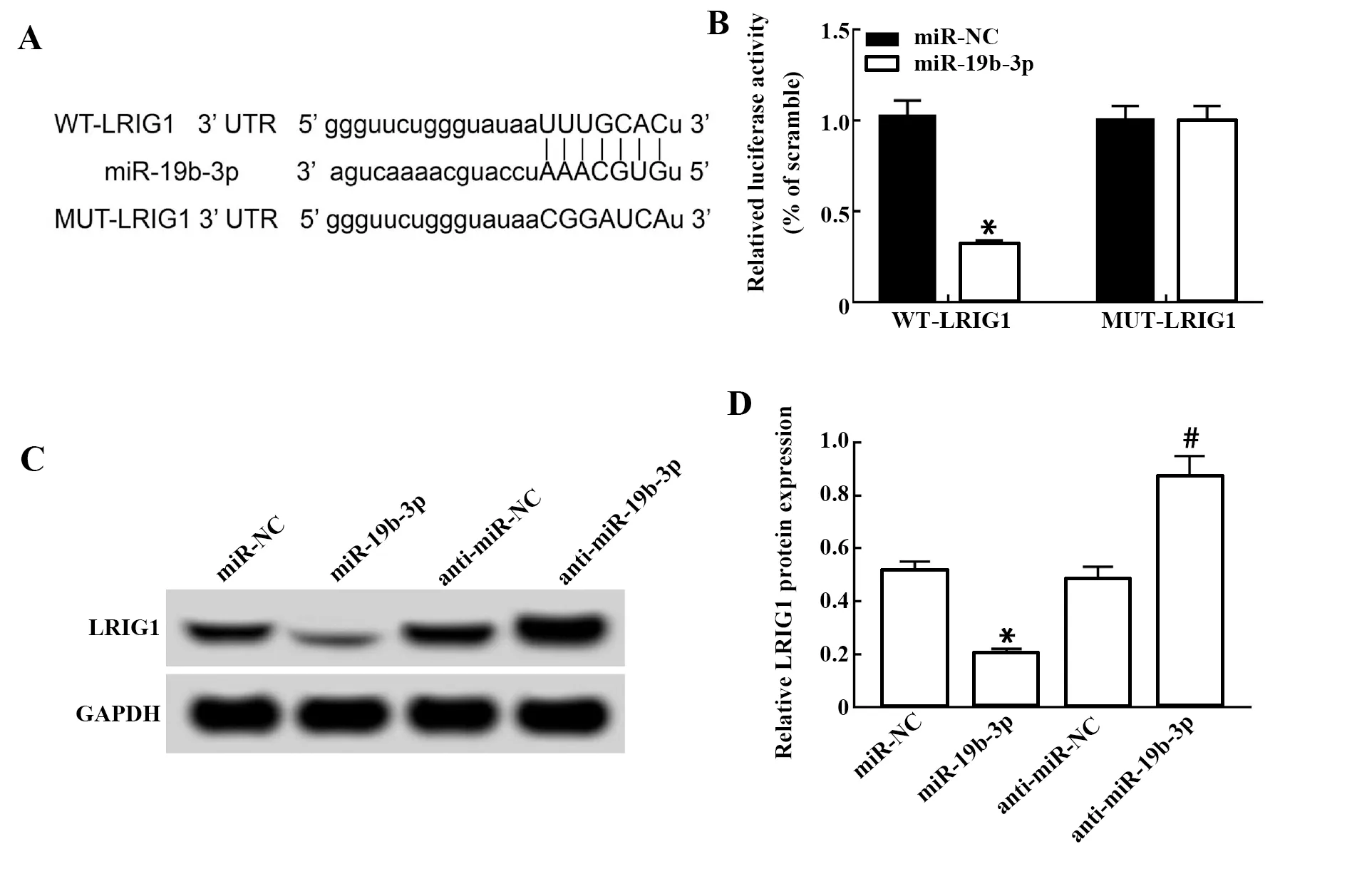
图5 miR-19b-3p靶向调控LRIG1的表达Fig.5 miR-19b-3p targeted regulation of LRIG1 expression
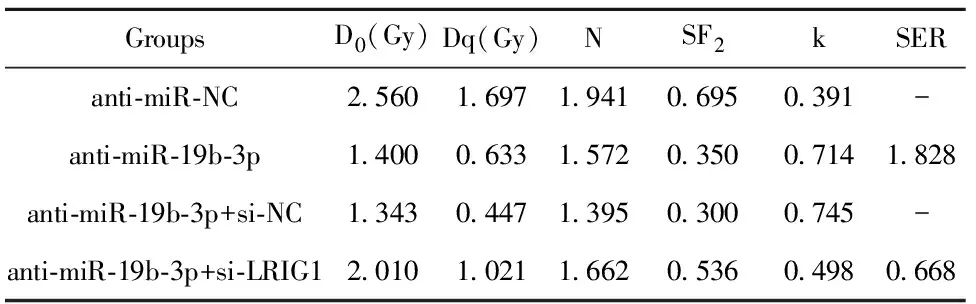
表3 抑制miR-19b-3p的表达及沉默LRIG1的表达对Hep-2细胞增敏比及存活分数等相关参数的影响
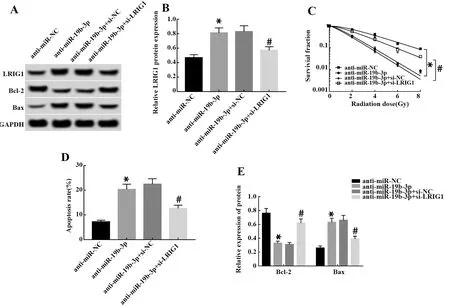
图6 抑制LRIG1表达逆转了抑制miR-19b-3p表达对喉癌Hep2细胞凋亡和放射敏感性的作用Fig.6 Inhibition of LRIG1 expression reverses effect of inhibition of miR-19b-3p expression on apoptosis and radiosensitivity of laryngeal carcinoma Hep2 cells
2.6抑制LRIG1表达逆转了抑制miR-19b-3p表达对喉癌Hep2细胞凋亡和放射敏感性的作用 与anti-miR-19b-3p+si-NC组相比,anti-miR-19b-3p+si-LRIG1组喉癌Hep2细胞凋亡率显著降低(P<0.05),Bcl-2蛋白表达上调(P<0.05),而Bax蛋白表达下调(P<0.05),细胞存活分数明显升高(P<0.05),细胞增敏比(SER)为0.668,见图6、表3。表明抑制LRIG1表达可恢复抑制miR-19b-3p表达对喉癌Hep2细胞凋亡的抑制作用及其增强细胞放射敏感性的作用。
3 讨论
喉癌放射敏感性与肿瘤细胞中癌基因或抑癌基因异常表达及其相关分子生物学机制有关[10,11]。可通过上调或下调miRNA表达增加喉癌细胞凋亡并增强放射敏感性[12]。但miRNA与喉癌放射敏感性的相关性研究相对较少,因此需进一步探讨miRNA对喉癌细胞放射敏感性的影响及其内在分子机制。
miR-19b-3p在胃癌、前列腺癌等恶性肿瘤中均呈高表达,其可能作为肿瘤早期诊断及评估患者预后的潜在生物标志物[13,14]。Wei等[15]研究表明,苦参碱可通过调控miR-19b-3p/PTEN轴进而抑制黑素瘤发生及发展进程。Jin等[16]研究表明下调miR-19b-3p可通过调节PI3K/Akt通路抑制乳腺癌细胞增殖并逆转塞卡替尼的抗性。本研究检测喉癌组织、癌旁组织及Hep2细胞中miR-19b-3p的表达,结果发现miR-19b-3p的表达水平均显著升高,体外培养Hep2细胞并转染入anti-miR-19b-3p而抑制其表达,进一步观察细胞凋亡情况,结果发现抑制miR-19b-3p表达后可明显促进喉癌细胞凋亡,并可促进Bax、cleaved-caspase3表达及抑制Bcl-2表达,已有研究报道指出Bcl-2属于抗凋亡基因,Bax属于凋亡基因,Bcl-2可通过调控线粒体凋亡通路激活caspase3级联反应进而促进细胞凋亡[17,18]。提示下调miR-19b-3p表达可通过调控细胞凋亡相关蛋白进而促进喉癌细胞凋亡。用不同剂量X线照射喉癌细胞结果发现,抑制miR-19b-3p表达后喉癌细胞存活分数显著降低,增敏比明显升高,提示抑制miR-19b-3p表达可显著增强喉癌细胞放射敏感性。
LRIG1可维持组织及细胞的结构和功能,其在多种肿瘤发生发展过程中均呈低表达,并可发挥抑癌基因作用[19]。沉默LRIG1可抑制卵巢癌细胞凋亡并降低细胞对药物的敏感性[20]。朱晓楠等[21]研究表明,上调LRIG1表达后可通过抑制RAD51蛋白表达而抑制双链DNA损伤修复进而增强人脑胶质瘤细胞放射敏感性。严泽军等[22]研究表明LRIG1可通过下调EGFR表达进而促进膀胱癌细胞凋亡并提高细胞对顺铂的敏感性。相关研究表明LRIG1过表达可通过下调靶基因EGFR表达逆转上皮-间质(EMT)转化进程,抑制脑胶质瘤细胞恶性生物学行为进而增强其放射敏感性[23]。与上述研究报道相似,本研究结果发现喉癌组织及细胞系中LRIG1的mRNA及蛋白表达水平均显著降低,通过上调LRIG1表达后发现喉癌细胞凋亡率显著升高,而细胞存活分数显著降低,提示LRIG1过表达可诱导喉癌细胞凋亡并增强其放射敏感性。通过生物学信息网站预测LRIG1可能为miR-19b-3p的靶基因,采用双荧光素酶报告基因实验验证LRIG1是miR-19b-3p的靶基因,进一步分析发现miR-19b-3p可负向调控靶基因LRIG1的表达,为探究miR-19b-3p是否可通过调控靶基因LRIG1表达进而参与喉癌细胞凋亡及放射抵抗性过程,本研究将anti-miR-19b-3p与si-LRIG1共转染入喉癌细胞,结果发现细胞凋亡率显著降低,细胞存活分数显著升高,细胞增敏比显著降低,提示下调miR-19b-3p表达可通过调控LRIG1进而诱导喉癌细胞凋亡并增强细胞放射敏感性。
综上所述,喉癌中miR-19b-3p、LRIG1表达异常与放射敏感性有关,靶向下调miR-19b-3p表达可上调靶基因LRIG1表达进而提高喉癌放射敏感性,其可能作为喉癌放疗的治疗靶点及判断放射敏感性的分子标志物。但关于其是否可在临床实践中广泛应用仍需临床实验证实。
