新风胶囊对关节炎模型大鼠PTEN/PI3K/AKT信号通路及血小板活化的影响①
2020-07-13黄传兵
黄传兵 万 磊 刘 健 刘 磊
(安徽中医药大学第一附属医院,合肥 230031)
类风湿关节炎(rheumatoid arthritis,RA)是一种累及多系统的、慢性、侵袭性自身免疫性疾病,四肢小关节受累最常见。滑膜组织血管新生,肥厚绒毛样突起形成血管翳,血管翳侵蚀关节软骨及软骨下骨是造成RA关节功能障碍的最主要原因[1]。RA 关节外表现形式多样,其中血小板活化较为多见[2,3]。血小板活化可发挥凝血、止血作用,但同样参与RA炎症反应等过程。血小板活化后可通过分泌血小板微粒(platelet microparticles,PMPs)参与RA免疫调节、血管新生等过程[4,5]。因此,观察关节炎患者体内血小板活化产物的变化及阐明药物干预机制意义重大。本研究采用弗氏完全佐剂构建佐剂关节炎(adjuvant arthritis,AA)大鼠模型,采用新风胶囊(XFC)干预AA大鼠,观察大鼠体内血小板活化物PMPs及磷酸酯酶与张力蛋白同源物(phospholipase and tensin homologue,PTEN)/磷脂酰肌醇三激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶(protein kinase,AKT)信号通路等变化,探讨XFC改善AA血小板活化的机制。
1 材料与方法
1.1材料 弗氏完全佐剂(批号:160861206)、PI3K特异性抑制剂LY294002(批号:52-0213)购自美国Sigma公司。Rabbit Antibody PENT、AKT、p-AKT(ser473)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关死亡启动因子(BAD)(Rabbit Antibody)、PI3K(Mouse Antibody)、血小板来源的生长因子(PDGF)购自美国Abcam公司。BX53型显微镜购自日本奥林巴斯公司。XL-ESPIC MCL型流式细胞仪购自美国Beckman-Coulter公司。JEM-1230型透射电子显微镜购自日本日立公司。
1.2方法
1.2.1模型分组 采用随机对照表将大鼠分为正常对照(NC)组、模型对照(MC)组,PI3K阻滞剂LY294002(LY294002)组、XFC组,每组6只。各组分别给予相应药物治疗(NC、MC组给予等体积生理盐水),给药30 d后观察各项指标变化。
1.2.2流式细胞术检测PMPs标志物 抗凝管腹主动脉采血2 ml。1 000 r/min离心20 min,上清即为富血小板血浆。取100 μl 富血小板血浆、5 μl CD61-FITC抗体、5 μl CD41-PE抗体、1 μl荧光微粒加入流式管,室温孵育30 min,PBS定容至0.5 ml,加入1 μl荧光微粒,流式细胞仪检测。CD61-FITC和CD41-PE双阳性颗粒即为PMPs,检测门内PMPs双阳性表达率CD61+CD41+PMPs(%)。
1.2.3血小板参数检测 采用全自动血细胞分析仪检测血小板计数(PLT)、血小板压积(PCT)、血小板体积(MPV)、血小板分布宽度(PDW)表达。
1.2.4电镜观察血小板超微结构变化 将采集的血液样本加于分离液中,离心后用吸管小心吸取第一层(血小板血浆层),加入10 ml清洗液,离心、弃上清、重悬细胞,再离心、弃上清,白色沉淀即为血小板。血小板固定、脱水、包埋,组织进行超薄切片,透射电镜观察摄片。
1.2.5ELISA法检测血清细胞因子 腹主动脉采血。离心取上清,ELISA法检测血清细胞因子血管内皮生长因子(VEGF)、缺氧诱导因子-1α(HIF-1α)、肿瘤坏死因子-α(TNF-α) 、内皮抑素(ES)、IL-10 OD值,查标准曲线计算VEGF、HIF-1α、TNF-α、ES、IL-10最终浓度。
1.2.6免疫组化、RT-qPCR法检测腹主动脉组织PDGF 取腹主动脉,石蜡包埋、切片、免疫组织化学染色。PDGF抗体1∶500稀释行染色,每张切片任选4个视野,采用图像分析软件进行分析,用积分光密度表示PDGF蛋白表达。腹主动脉提取RNA,引物序列如下:PDGF引物:上游5′-GTG CGG TCT TTG TTC TCC TC-3′,下游: 5′-TCG CTC TCT GTG ACA AGG AA-3′;β-actin引物:上游:5′-CCC ATC TAT GAG GGT TAC GC-3′,下游:5′-TTT AAT GTC ACG CAC GAT TTC-3′。逆转录,进行PCR反应,以β-actin为内参,2-ΔΔCt计算PDGF mRNA表达。
1.2.7免疫印迹法检测大鼠血小板细胞PTEN/PI3K/AKT蛋白表达 取上层血浆,离心,去上清。向沉淀加入血小板洗涤液轻轻摇动洗涤,再次离心,除去洗涤液。将蛋白提取液、蛋白酶抑制剂混合物加入离心管中,振荡、混匀,离心、取上清即为血小板蛋白。转膜、封闭、免疫反应。PTEN、PI3K、AKT、BCL-2、p-AKT、BAD抗体1∶2 000稀释;二抗抗体1∶5 000稀释,分析结果。

2 结果
2.1XFC对AA大鼠PMPs及血小板参数的影响 与NC组相比,MC组PMPs、PLT、PCT表达显著升高(P<0.01),PDW、MPV表达差异无统计学意义(P>0.05);与MC组相比,LY294002组、XFC组PMPs、PLT、PCT表达显著降低(P<0.01),PDW、MPV表达差异无统计学意义(P>0.05);XFC组、LY294002组PMPs、PLT、PCT、PDW、MPV表达差异无统计学意义(P>0.05),见图1、表1。
2.2各组血小板超微结构的变化 电镜下NC组
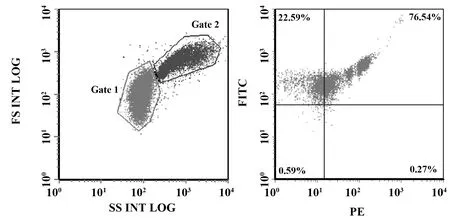
图1 标准荧光微球定位对照及血小板微粒流式设门图Fig.1 Standard fluorescent microsphere positioning control and platelet particle flow gate setting dragram
血小板形状规整,表面光滑,无伪足伸出,胞质中可见α颗粒、线粒体散在分布;MC组可见血小板外形稍膨胀,不规整,表面多处伪足伸出,胞质中α颗粒、线粒体显著减少,血小板结构破坏明显,部分血小板表面可见PMPs形成;LY294002组血小板细胞外形不规整,少量伪足伸出,胞质中α颗粒、线粒体分布; XFC组血小板呈椭圆形,状规整,有少许伪足伸出,胞质结构无明显损伤、胞质α颗粒、线粒体较MC明显增多。见图2。
2.3XFC对AA大鼠血清细胞因子的影响 与NC组相比,MC组血清VEGF、HIF-1α、TNF-α表达明显升高,ES、IL-10表达降低(P<0.01);与MC组相比,LY294002组和XFC组VEGF、HIF-1α、TNF-α表达降低,ES、IL-10表达升高(P<0.05或P<0.01);与LY294002组相比,XFC组TNF-α表达降低(P<0.05)。见表2、图3。
2.4XFC对AA大鼠腹主动脉PDGF表达的影响

图2 各组血小板超微结构 (×5 000)Fig.2 Platelet ultrastructure of each group (×5 000)
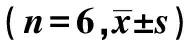
表1 各组血小板微粒、血小板参数变化
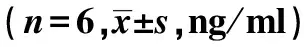
表2 各组血清细胞因子水平变化
免疫组化结果显示:与NC组相比,MC组大鼠腹主动脉PDGF表达升高(P<0.01);与MC组相比,LY294002组、XFC组PDGF表达降低(P<0.01);LY294002组、XFC组PDGF表达差异无统计学意义(P>0.05)。RT-qPCR结果显示:与NC组相比,MC组大鼠腹主动脉PDGF mRNA表达升高(P<0.01);与MC组相比,LY294002组、XFC组PDGF mRNA表达降低(P<0.05或P<0.01);与LY294002组相比,XFC组PDGF mRNA表达降低(P<0.05)。见表3、图4。

图3 各组血清细胞因子水平比较Fig.3 Comparison of serum cytokines levels in each group
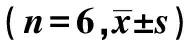
表3 各组大鼠腹主动脉PDGF表达变化
2.5血小板细胞PTEN/PI3K/AKT蛋白变化 与NC组相比,MC组大鼠血小板细胞PI3K、AKT、p-AKT、BCL-2蛋白表达升高,PTEN、BAD蛋白表达降低(P<0.01);与MC组相比,LY294002组、XFC组PI3K、p-AKT、BCL-2蛋白表达降低,PTEN、BAD蛋白水平升高(P<0.05或P<0.01);XFC组与LY294002组相比PTEN、PI3K、AKT、p-AKT、BAD、BCL-2差异无统计学意义(P>0.05)。见表4、图5。
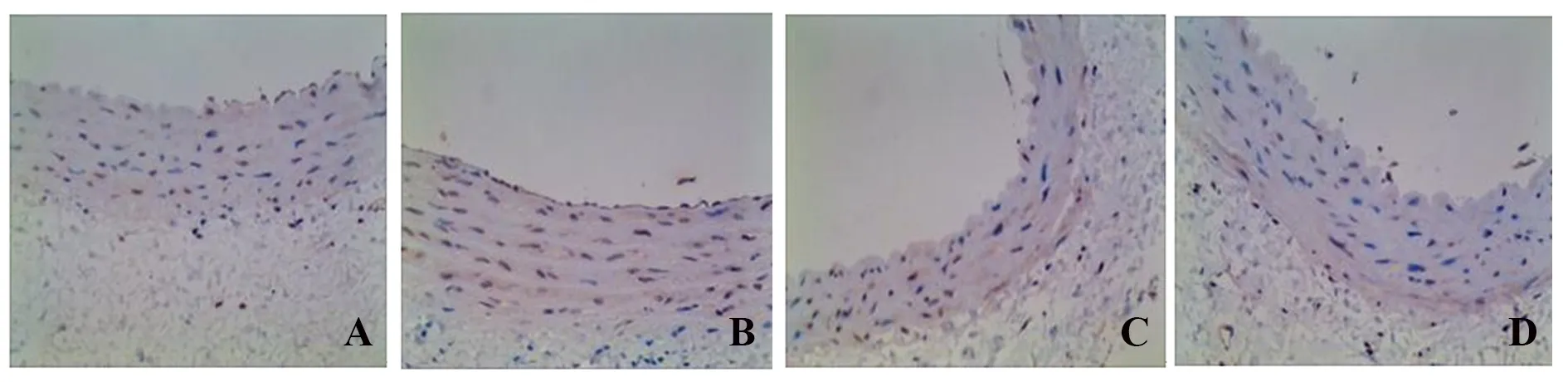
图4 各组腹主动脉组织PDGF表达(×400)Fig.4 PDGF expressions in abdominal aorta tissues of each group (×400)

图5 各组血小板细胞PTEN/PI3K/AKT蛋白表达Fig.5 Expressions of PTEN/PI3K/AKT protein in platelet cells of each group
表4 各组血小板细胞PTEN/PI3K/AKT蛋白表达变化
3 讨论
AA大鼠外周血PMPs释放增多,该过程受多种炎症因子、细胞因子和信号通路共同调控。机体抑炎因子与促炎症细胞因子平衡失衡、PI3K/AKT异常活化、凋亡指标BAD、抗凋亡指标BCL-2表达紊乱共同导致了外周血PMPs高表达,上调炎症因子分泌,介导炎症反应,诱导滑膜血管增生[6,7]。
PMPs是血小板细胞活化后释放进入微循环的小囊泡,可直接活化多种单核细胞、中性粒细胞,招募炎症趋化因子表达,分化为多种炎症因子,参与炎症反应。活动期RA患者外周血PMPs含量显著高于稳定期RA患者,RA患者关节液中PMPs含量显著高于外周血,表明PMPs与RA炎症反应有关[8]。RA早期,PMPs可诱导关节滑膜组织产生血管内皮生长因子,进而诱导滑膜炎症及血管增生。RA病变过程中,血小板参数PLT、PCT增高在一定程度上反映了关节滑膜侵蚀性炎症的活动程度,本研究发现,AA大鼠PMPs、PLT、PCT表达显著升高。既往研究发现,AA大鼠中PMPs与足跖肿胀度、AI呈正相关,说明PMPs介导关节及全身炎症反应[9-11]。本研究发现,AA大鼠体内炎症细胞因子VEGF、HIF-1α、TNF-α表达升高,导致AA血小板参数失衡及PMPs释放增多,PDGF表达升高。XFC干预后血小板计数降低、超微结构破坏改善,抑制血小板细胞产生、释放PMPs,降低炎症因子表达,减轻全身炎症反应,降低微血管密度,抑制血管增生和滑膜组织炎症反应。
PI3K/AKT信号通路是重要的细胞内信号转导通路,通过跨膜酪氨酸激酶受体和细胞内因子应答各种细胞内外信息,并调控细胞生长、增殖、分化、凋亡和细胞骨架重排等,在RA滑膜组织中广泛存在并处于异常激活状态,且与滑膜组织中纤维细胞样滑膜细胞凋亡有关[12,13]。本研究发现,AA大鼠机体促炎因子表达增多,激活PI3K/AKT信号通路形成正反馈,进一步促进PMPs释放,血小板细胞PI3K/AKT通路被异常激活。因此,抑制异常活化的PI3K/AKT 信号通路或抗凋亡分子的表达可以诱导RA细胞凋亡,抑制PDGF表达,治疗RA。LY294002为PI3K/AKT信号通路特异性抑制剂,可抑制PI3K/AKT通路激活[14]。采用LY294002处理的关节炎模型小鼠可显著改善关节滑膜增生,抑制滑膜内炎症细胞浸润产生抗炎作用。本研究发现,XFC和LY294002均可调节PI3K、p-AKT、BCL-2、PTEN、BAD表达,XFC可通过上调PTEN,负性调节PI3K/AKT通路,降低BCL-2表达,升高BAD,改善血小板参数,抑制血小板活化,下调PMPs表达,抑制PMPs介导的炎症反应。
综上所述,XFC可通过抑制血小板PTEN/PI3K/AKT信号通路,提高抑炎因子表达,调节Th1/Th2平衡,降低炎症因子表达,减轻全身炎症反应,降低PMPs表达,改善血小板参数,从而抑制RA患者炎症反应。
