电针刺激经Wnt/β-catenin信号通路促进脊髓损伤大鼠移植骨髓间充质干细胞的存活及分化
2020-07-13王文峰叶红晖
王文峰 叶红晖
(日照市中心医院康复医学科,日照 276800)
骨髓间充质干细胞(bone marrow mesench-ymal stem cells,BMSCs)是具有多向分化潜能、自我更新能力强、低免疫原性的多能干细胞,作为种子细胞广泛应用于再生医学领域[1]。脊髓损伤(spinal cord injury,SCI)是常见严重创伤性疾病,由神经元损伤、轴突髓鞘脱失及神经胶质细胞功能失调引起机体功能障碍[2]。研究显示,BMSCs移植在SCI治疗中具有较好的应用前景,但移植的BMSCs在体内存活率较低及向神经样细胞分化的效率不高[3,4]。电针(electro-acupuncture,EA)是治疗中枢神经系统损伤的常用方法,可用于SCI。研究显示,EA可诱导SCI后运动功能改善,并促进神经干细胞增殖和分化,可提高脊髓损伤干细胞移植的成功率,但具体作用机制尚未明确[5,6]。本研究以SCI模型大鼠为研究对象,探讨EA刺激对SCI后移植的BMSCs存活和分化的影响,为提高干细胞移植对SCI治疗的成功率提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级4周龄健康雄性SD大鼠10只,体质量80~100 g,10周龄健康雄性SD大鼠60只,体质量390~410 g,均由湖南斯莱克景达实验动物有限公司提供,许可证编号:SCXK(湘)2016-0002。分笼饲养,自由饮食进水,22~24℃,相对湿度50%~70%,昼夜12/12 h。
1.1.2主要实验试剂 DMEM/F12培养基购自美国Invitrogen公司;Wnt/β-catenin信号通路抑制剂IGC-001购自美国MedChemExpress公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)荧光标记的CD44和CD90抗体及苯肾上腺素(phenylephrine,PE)荧光标记CD29和CD45抗体均购自美国Becton Dickinson公司;大鼠神经营养素3(neurotro-phin-3,NT-3)ELISA试剂盒购自武汉伊莱瑞特生物科技股份有限公司;BrdU单克隆抗体、β-catenin单克隆抗体、c-Myc单克隆抗体、cyclin D1单克隆抗体、神经元特异性核蛋白(neuronal nuclei,NeuN)单克隆抗体和GAPDH单克隆抗体均购自美国Cell Signaling Technology公司;Alexa Fluor®488 goat anti-mouse IgG(H+L)和Alexa Fluor®594 goat anti-mouse IgG(H+L)二抗购自上海浩然生物技术有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗购自武汉博士德生物工程有限公司。
1.1.3仪器 环球牌针灸针(0.3×25 mm)购自苏州环球针灸医疗器械有限公司;HT-2温针电针综合治疗仪购自常州华音电子有限公司。
1.2方法
1.2.1BMSCs分离、培养及鉴定 从4周龄SD大鼠双侧股骨和胫骨一端缓慢冲洗骨髓腔,另一端收集细胞悬液,200目筛网过滤,离心吸取乳白色、云雾状液体层,DMEM/F12完全培养液重悬细胞并转移至细胞培养瓶,置于37℃、5%CO2培养箱中培养至第3代,胰酶消化后制备单细胞悬液,分别加入CD44-FITC、CD90-FITC、CD29-PE和CD45-PE荧光抗体进行标记,流式细胞仪检测BMSCs表面标志物。取第3代BMSCs接种于6孔板,细胞融合度达到60%时加入成骨诱导剂(1 mmol/L地塞米松、1 mol/L β-甘油磷酸钠和50 mmol/L抗坏血酸),3 d更液1次,诱导21 d后10%中性甲醛固定,茜素红和碱性磷酸酶染色观察。
1.2.2急性SCI模型的建立及BMSCs移植 将60只10周龄雄性SD大鼠随机分为假手术组(sham)、模型组(SCI)、BMSCs移植组(BMSCs)、BMSCs移植+EA组(BMSCs+EA)和抑制剂IGC-001干预组(BMSCs+EA+IGC-001),每组12只。除sham组外,其他各组SD大鼠均采用改良Allen′s打击法,建立SCI模型:1%戊巴比妥(30 mg/kg)腹腔注射麻醉大鼠,取俯卧位固定大鼠,备皮,在暴露T9-T11椎旁肌肉后,完全切断T10椎板显现脊髓,采用Allen′s撞击器(20 g)从3 cm高度处自由落体,撞击T10段脊髓,诱导脊髓挫伤,sham组大鼠暴露T10段脊髓后未撞击[7]。造模成功标准:脊髓损伤处缺血水肿,形成尾巴痉挛性颤动,双下肢躯体回缩样扑动,呈迟缓性瘫痪。手术完毕后青霉素盐水冲洗伤口,逐层缝合肌肉和皮肤,分笼饲养,辅助排尿。造模成功后,BMSCs组、BMSCs+EA组和BMSCs+EA+IGC-001组均尾静脉一次性注射0.5 ml(1×107个/ml)被BrdU标记的BMSCs,sham组和SCI组尾静脉注射等体积生理盐水。BMSCs+EA+IGC-001组大鼠尾静脉注射IGC-001(5 mg/kg),1次/d,共4周。
1.2.3EA治疗 麻醉复苏4 h后,BMSCs+EA组和BMSCs+EA+IGC-001组大鼠采用EA干预“大椎”和“命门”穴位。将不锈钢针灸针刺入选定穴位,倾斜15°~45°,深度0.5~0.7 cm,连接EA治疗仪,工作频率2 Hz,工作电流1 mA,持续20 min,隔天1次,治疗4周。
1.2.4神经功能评分 采用BBB(basso,beattie and bresnahan)运动评定量表评估大鼠术后第1、7、14、21、28天后肢运动功能。BBB评分范围为0~21分,0分表示后肢完全瘫痪,21分表示后肢运动功能完全正常,分数越低表示肢体功能障碍越严重[8]。
1.2.5ELISA检测损伤脊髓组织中NT-3含量 EA治疗4周后,各组随机取4只大鼠,1%戊巴比妥(30 mg/kg)腹腔注射麻醉大鼠,以T10节段为中心快速取出约1 cm长的脊髓组织,冰浴研磨,制备组织匀浆,取上清,按照试剂盒说明书进行ELISA分析,酶标仪测定450nm波长处OD值,绘制标准曲线,计算NT-3浓度。
1.2.6免疫荧光实验评估移植BMSCs的存活及分化 EA治疗4周后,BMSCs移植的各组随机取4只大鼠,麻醉后经心脏灌注4%多聚甲醛固定,完整取出T9-T11节段脊髓,将取出的脊髓组织放入4%多聚甲醛中固定过夜,放入30%蔗糖溶液中,至组织下沉到容器底部。T9-T11节段脊髓组织纵向连续冷冻切片,厚度25 μm,每连续5片取1片用于组织免疫荧光实验。取冰冻切片,含10%正常山羊血清的PBS室温封闭1 h,加入小鼠抗人anti-BrdU单克隆抗体(1∶200)和小鼠抗人anti-NeuN单克隆抗体(1∶50),4℃孵育过夜。PBS洗3次,加入二抗Alexa Fluor®488 goat anti-mouse IgG(H+L)或Alexa Fluor®594 goat anti-mouse IgG(H+L)室温避光孵育1 h,PBS洗3次,滴加防淬灭剂、封片,荧光显微镜下观察拍照。
存活的移植BMSCs数量计算:荧光显微镜下以anti-BrdU单克隆抗体单标显示的细胞记为存活的BMSCs。用校准的十字线目镜勾画,分布于每个切片的病灶部位,随机选取3个视野(0.09 mm2)进行细胞计数,以单位面积内被BrdU标记的细胞平均数表示存活细胞数。
分化的移植BMSCs数量计算:荧光显微镜下以anti-BrdU单克隆抗体和anti-NeuN单克隆抗体双标显示的细胞记为神经元样细胞。细胞计数方式同上,结果以单位面积内统计的神经元样细胞数量所占存活BMSCs的百分比表示。
1.2.7Western blot检测损伤脊髓组织Wnt/β-catenin通路相关蛋白表达 EA治疗4周后,取各组剩余大鼠,麻醉后迅速取出T10节段脊髓组织,PBS清洗,加裂解液,冰浴研磨,12 000 r/min离心25 min,收集上清,Bradford法测定蛋白浓度。取25 μg 蛋白,行SDS-聚丙烯酰胺凝胶电泳,并转移至PVDF膜,5%脱脂牛奶室温封闭1 h,TBST洗3次,加入一抗anti-β-catenin单克隆抗体、anti-c-Myc单克隆抗体、anti-cyclin D1单克隆抗体和anti-GAPDH单克隆抗体,4℃孵育过夜。TBST洗3次,加入HRP标记的山羊抗兔IgG二抗,室温孵育30 min,TBST洗涤3次,加入超敏发光底物,曝光显影,Image J分析条带灰度值,GAPDH作为内参。

2 结果
2.1BMSCs细胞的鉴定 结果显示CD44、CD90和CD29均呈阳性表达,表达率分别为(91.7±2.4)%、(94.1±1.9)%和(92.8±1.6)%,而CD45呈阴性表达,其表达率仅为(2.7±0.9)%,见图1。碱性磷酸酶染色结果显示,经染色后出现较多蓝黑色颗粒,茜素红染色结果显示,存在大量红色阳性克隆的钙化结节,见图2,分离所得细胞为BMSCs。
2.2EA刺激改善BMSCs移植后SCI大鼠神经功能 各时间点sham组大鼠BBB评分显著高于其他组(P<0.05);BMSCs移植后21 d到28 d,BMSCs组和BMSCs+EA组大鼠BBB评分均显著高于SCI组(P<0.05),BMSCs+EA组显著高于BMSCs组(P<0.05);BMSCs+EA+IGC-001组大鼠BBB评分显著低于BMSCs+EA组,见图3。
2.3EA刺激促进损伤脊髓组织NT-3表达 EA干预4周后, 与sham组相比,SCI组大鼠脊髓损伤部位NT-3含量显著降低(P<0.05);与SCI组相比,BMSCs组和BMSCs+EA组大鼠脊髓损伤部位NT-3含量显著增加(P<0.05),BMSCs+EA组显著高于BMSCs组(P<0.05);与BMSCs+EA组相比,BMSCs+EA+IGC-001组大鼠脊髓损伤部位NT-3含量显著降低(P<0.05),见图4。

图1 BMSCs表面标志物表达Fig.1 Expression of surface markers of BMSCs
2.4EA刺激促进损伤脊髓内移植BMSCs的存活及分化 各BMSCs移植组大鼠脊髓损伤处均有部分被BrdU标记绿色荧光,与BMSCs组相比,BMSCs+EA组存活的BMSCs数量显著增加(P<0.05),BMSCs+EA+IGC-001组存活的BMSCs数量较BMSCs+EA组显著减少(P<0.05),见图5。BMSCs+EA组神经元样细胞数目显著多于BMSCs组(P<0.05),而BMSCs+EA+IGC-001组显著少于BMSCs+EA组(P<0.05),见图6。
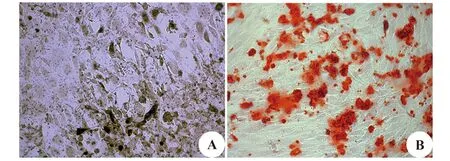
图2 BMSCs成骨诱导分化(×200)Fig.2 Osteoblasts induction of BMSCs(×200)
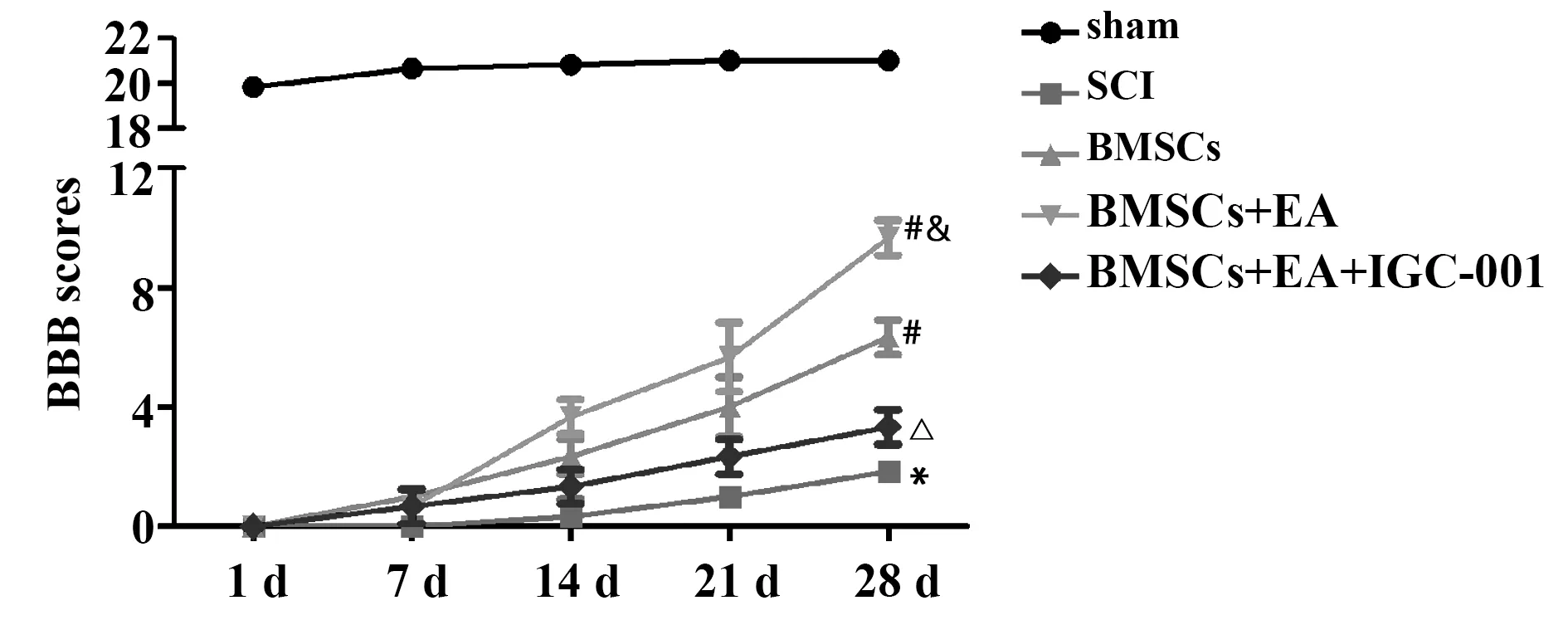
图3 各组大鼠各时间段BBB评分Fig.3 BBB scores of rats in each group at each time

图4 各组大鼠脊髓损伤部位NT-3含量Fig.4 NT-3 contents in spinal rats injured sites of each group
2.5EA刺激上调损伤脊髓内Wnt/β-catenin通路相关蛋白的表达 EA干预4周后, SCI组大鼠脊髓损伤处β-catenin、c-Myc和cyclin D1等蛋白表达水平与sham组差异无统计学意义(P>0.05);与SCI组相比,BMSCs组和BMSCs+EA组大鼠SCI处β-catenin、c-Myc和cyclin D1等蛋白表达水平显著上调(P<0.05),其BMSCs+EA组各蛋白表达水平显著高于BMSCs组(P<0.05);与BMSCs+EA组相比,BMSCs+EA+IGC-001组大鼠SCI处β-catenin、c-Myc和cyclin D1等蛋白表达水平显著下调(P<0.05),见图7。


图5 BrdU荧光标记检测各组BMSCs 移植后存活情况(×100)
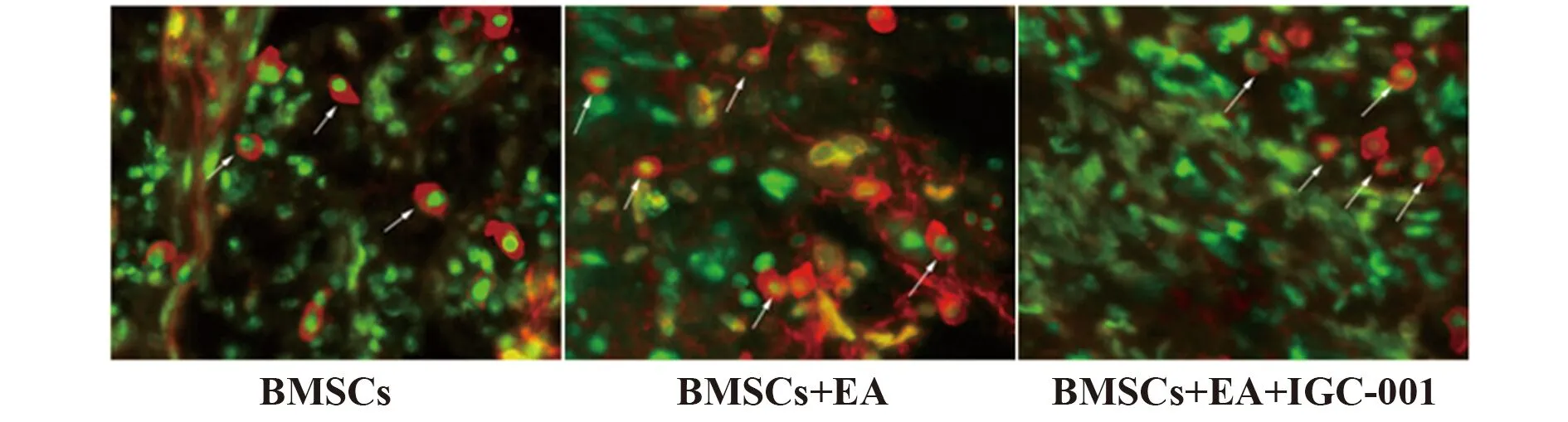

图6 移植BMSCs在SCI组织中的分化情况(×200)

图7 Wnt/β-catenin通路相关蛋白表达水平Fig.7 Expression levels of Wnt/β-catenin pathway associated proteins
3 讨论
神经干细胞(neural stem cells,NSCs)是修复中枢神经系统损伤最理想的移植细胞,但由于其潜在的伦理问题,临床应用受限。与NSCs相比,BMSCs不涉及伦理问题,且来源广泛、取材容易,在体外可诱导成神经元样细胞,备受青睐。研究证实,BMSCs移植治疗SCI有效可行,但机制复杂,可能通过促进轴突再生重建神经通路、分泌相关细胞因子促进神经重塑和血管再生,抑制氧化应激、减轻炎症及分化成神经元样细胞促进神经功能恢复等发挥治疗作用[9-11]。然而,BMSCs移植后在体内存活率较低以及向神经元样细胞分化效率不高,严重影响其疗效并限制其应用,如何提高BMSCs移植存活率及向神经元样细胞分化效率至关重要。本研究结果显示,BMSCs移植后采用EA干预可促进BMSCs在SCI大鼠脊髓损伤截面组织的存活及向神经元样细胞分化,并改善大鼠神经功能损伤,其机制可能与EA激活Wnt/β-catenin信号通路转导有关。
针刺作为我国传统康复手段,可缓解和预防各类神经类疾病并发症,促进神经损伤后的神经功能恢复。早期EA干预可减轻继发性损伤、促进神经轴突再生、加速神经干细胞增殖,从而促进脊髓受损神经功能修复[12]。本研究分离大鼠BMSCs,并采用流式细胞仪检测其表面标志物CD44、CD90和CD29及通过成骨诱导分化实验证实分离的细胞为BMSCs,尾静脉注射采用BrdU标记BMSCsEA干预治疗,结果显示,与BMSCs组相比,BMSCs+EA组大鼠BBB评分显著增加,说明EA刺激可显著提高BMSCs移植后SCI大鼠的后肢运动功能,与Ding等[13]研究结果一致。NT-3是重要的神经生长因子,在神经系统发育、神经元存活与分化、神经修复等方面发挥重要作用。研究显示,EA刺激联合MSCs移植可显著提高SCI病灶及周围组织中NT-3含量,促进神经损伤修复[14]。本研究显示,与BMSCs组相比,BMSCs+EA组大鼠SCI病灶组织中NT-3含量显著增加,提示EA干预可能通过提高NT-3表达,改善损伤脊髓的微环境,促进SCI大鼠后肢运动功能恢复。
BrdU是胸腺嘧啶核苷类似物,在细胞增殖时能够替代胸腺嘧啶掺入到正在复制的DNA中并传到子代,通过BrdU特异性抗体标记检测,可间接反映细胞增殖情况。本研究采用BrdU标记的BMSCs进行移植,检测BrdU在SCI组织中表达情况,反映BMSCs移植后的存活情况。免疫荧光实验结果显示,BMSCs+EA组大鼠SCI病灶组织中被BrdU标记的BMSCs细胞数目较BMSCs组显著增加,说明EA干预可促进BMSCs存活。刘建敏等[15]研究显示,EA刺激能够提高SCI大鼠NSCs移植后的存活率。NeuN是主要分布于神经元胞质和细胞核内的可溶性小蛋白,其表达水平反映神经元细胞的增殖能力,是神经元细胞的标志物[16]。本研究通过免疫荧光检测NeuN蛋白与BrdU共定位情况评估移植的BMSCs向神经元样细胞分化情况,结果显示,BMSCs+EA组大鼠SCI病灶组织中NeuN与BrdU共定位的BMSCs细胞数目较BMSCs组显著增加,说明EA干预可促进BMSCs向神经元样细胞分化。提示,EA刺激可促进移植的BMSCs存活和分化。
Wnt/β-catenin信号通路参与EA刺激介导的SCI修复过程。Zhang等[17]研究称EA刺激可激活Wnt/β-catenin通路促进SCI组织内源性NSCs增殖与分化,恢复SCI大鼠后肢运动功能。Wang等[18]研究显示,经“大椎”和“命门”EA刺激介导的SCI大鼠后肢运动功能改善,与SCI组织内Wnt1、Wnt3a和β-catenin表达上调有关,提示EA刺激可能通过调控Wnt/β-catenin信号通路促进脊髓损伤后移植BMSCs的存活和分化。本研究结果显示,与BMSCs组相比,BMSCs+EA组大鼠脊髓损伤处β-catenin、c-Myc和cyclin D1等蛋白表达水平显著上调,表明电针刺激可激活脊髓损伤组织微环境中Wnt/β-catenin信号通路的转导。采用Wnt/β-catenin信号通路抑制剂IGC-001干预后,与BMSCs+EA组相比,BMSCs+EA+IGC-001组大鼠BBB评分、损伤组织中NT-3含量、存活及分化的BMSCs细胞数目及β-catenin、c-Myc和cyclin D1等蛋白表达水平均显著下降,表明IGC-001干预可显著逆转EA刺激的作用。且研究表明,NT-3是Wnt/β-catenin信号通路的靶基因[19,20]。本研究中EA刺激可通过激活Wnt/β-catenin信号通路介导NT-3表达上调,进而促进移植BMSCs存活与分化,改善SCI大鼠后肢运动功能。
综上所述,EA刺激可促进移植的BMSCs在SCI部位存活并向神经元样细胞分化,改善SCI大鼠后肢运动功能,其机制可能是EA刺激激活Wnt/β-catenin信号通路,上调脊髓损伤组织微环境中NT-3表达,NT-3发挥其作为神经营养因子的功能,促进移植BMSCs分化及存活。但本研究未深入验证NT-3是Wnt/β-catenin信号通路的下游靶基因,需要进一步研究证实。
