人卵巢浆液性腺癌原代细胞的改良体外培养方法
2020-07-13张晨晨蔡泽宇江冬瑞
张晨晨,蔡泽宇,王 弦,江冬瑞,吴 强,3,王 晶
在女性常见肿瘤中卵巢癌的死亡率居高不下[1],其中卵巢浆液性肿瘤死亡率占卵巢癌死亡率的70%[2]。因早期卵巢癌临床症状不明显,导致大多数患者无法得到较好的治疗效果[3]。截至目前,国内外对于卵巢癌的研究多数以商品化的细胞株为材料[4-5],但相比之下原代培养的肿瘤细胞离体时间短,生物特性更接近体内状态,对卵巢癌防治的研究更有参考价值[6-7]。
目前国内对于人卵巢浆液性腺癌原代细胞(human ovarian serous adenocarcinoma cells, HOSACs)的培养常用组织贴壁法[8],但这种原代培养方法周期长、容易污染且成功率低,限制了其在卵巢癌领域的研究。该试验通过改良酶的类型选择和消化时间,成功建立一种快速高效的HOSACs培养方法。
1 材料与方法
1.1 材料
1.1.1标本 收集2018年1月~2019年5月安徽医科大学第一附属医院卵巢肿瘤减灭术的新鲜人卵巢浆液性腺癌标本25例,所有病例均经病理学诊断证实。所有患者在手术前未曾接受过化疗或放疗。依据最新的国家综合癌症网络(NCCN)指南,患者均为ⅡB~ⅢC期。上述组织标本的获取已由患者家属同意捐赠,并签署知情同意书,经医院医学伦理委员会批准。
1.1.2主要试剂 DMEM高糖培养基、磷酸盐缓冲液(PBS)购于美国Hyclone公司;0.25%胰蛋白酶-0.02%EDTA、胎牛血清(FBS)购于美国BI公司;透明质酸酶购于北京索莱宝科技有限公司;细胞无血清冻存液购于苏州新赛美公司;青霉素-链霉素购于上海赛默飞世尔公司;表皮生长因子(epidermal grow factor,EGF)购于美国PeproTech公司;CCK-8试剂盒、细胞角蛋白CK7抗体、DAPI 购于上海碧云天科技公司。
1.2 方法
1.2.1试验前准备 试验前准备包括:① 组织冲洗液:PBS+青霉素-链霉素双抗溶液;② 组织运转液:DMEM培养基+青霉素-链霉素双抗溶液;③ 改良版消化液:0.1 mg/ml透明质酸酶+0.25%胰蛋白酶-0.02% EDTA;④ 完全培养基的配制见表1。

表1 实验完全培养基的配置
1.2.2组织块基本处理 取手术切除的人卵巢浆液性腺癌组织,用无菌的生理盐水冲洗,以去除组织上多余的血污;随后将组织放入含有1%青-链霉素溶液的无血清DMEM高糖培养基(即组织转运液)中浸泡30~60 min;实验开始时,用含有高浓度双抗的PBS溶液(即组织冲洗液)漂洗2~3次,用眼科剪去除组织周围毛细血管、脂肪组织以及坏死组织等;将修好后的组织置入25 ml高压灭菌后的烧杯中,剪碎至1~3 mm3大小的组织块分成两等份,随机标记为改良组与传统组。
1.2.3改良组的细胞培养 将剪碎的组织转移到离心管中,加入与组织块等体积的改良版酶消化液,吹打混匀后置于37 ℃恒温箱消化2~3 min;当组织出现稍粘稠状态时应立即加入为消化液体积2~3倍的20% FBS的完全培养基终止消化;2 000 r/min离心5 min,弃上清液;加入细胞体积2~3倍的完全培养基吹打混匀细胞及组织块;吸取混匀后的组织细胞混悬液平铺在培养瓶中,总体积以1~2 ml(25 cm的培养瓶)最合适,随后放置细胞培养箱中培养;第2天换去一半培养基,以后每天根据培养基颜色及细胞爬出的具体情况2~3 d换1次液。
1.2.4传统组的细胞培养 将剪碎组织块均匀的平铺在培养瓶中,放置37 ℃含有5% CO2的培养箱中培养,静置20~30 min后轻轻地翻转瓶子,瓶底朝上;静置过夜10~16 h后缓慢翻转瓶子,并加入少许完全培养基,使组织浸入培养基中,置入细胞培养箱中继续静置培养24 h;待第3天补充少许培养基;以后每2~3 d换1次液。
1.2.5培养细胞形态学观察 通过相差显微镜来观察48 h和72 h时间段HOSACs的形态学特征。
1.2.6免疫荧光鉴定HOSACs细胞纯度 2种不同提取方法培养出的HOSACs在进行首次传代时,分别接种至20 mm玻璃底培养皿中,每皿2×105个细胞,置于细胞培养箱中培养48 h,用4%多聚甲醛细胞固定,0.3%的Triton X-100破膜和山羊血清的封闭,以CK7一抗浓度为1 ∶500、4 ℃孵育过夜,次日复温后加抗兔的二抗以浓度1 ∶200、37 ℃避光孵育2 h;再经DAPI室温下染细胞核5 min;用共聚焦显微镜观察细胞形态,计数CK7阳性细胞率。
1.2.7CCK-8检测细胞增殖能力并绘制细胞生长曲线 HOSACs培养到第2代时,用0.25%胰蛋白酶-0.02% EDTA消化细胞,置成单细胞悬液;改良组与传统组各一组,以每孔3 000个细胞,接种到96孔板中,设置5个平行孔;随后每隔24 h,取出待测的96孔板中5个孔,每孔加入10 μl CCK-8溶液,在加入CCK-8后2 h读450 nm处的吸光度(optical density, OD)值;连续观察7 d,以时间为X轴,以A450为Y轴分别绘制改良组与传统组的细胞生长曲线。

2 结果
2.1 2种原代培养方法的成功率原代细胞的培养过程中,在运输、取材和操作3个时间段内都是极易发生污染的;在25例标本中,改良组培养法有2例污染,无一例生长停滞。而传统组培养法有3例污染,10例生长停滞,1例均为成纤维,11例培养出来的原代细胞含有较多的成纤维细胞并且在整个培养过程中癌细胞生长极其缓慢。
2.2HOSACs的形态学观察
2.2.1相差显微镜观察 改良组的原代细胞在培养48 h后,见细胞团贴壁延伸, 呈类圆形,细胞成团状生长,符合卵巢癌细胞生长特性;而传统组处理的原代细胞在48 h后,仅有组织块的贴壁,极少量细胞从组织中爬出,见图1,图中箭头所指的阴影部分为组织块。在继续培养至72 h后改良组长满瓶底,细胞呈短梭形,类铺路石样特征,其间夹杂较少量多角形细胞以及极少量成纤维细胞;而传统组原代细胞在72 h后仅见少量短梭形细胞从组织块中爬出,见图2。

图1 人卵巢浆液性腺癌不同提取方法后48 h细胞形态 ×100

图2 人卵巢浆液性腺癌不同处理方法后培养72 h的细胞形态 ×100

图3 HOSACs形态及CK7表达 免疫荧光细胞化学染色 ×400
2.2.2HOSACs细胞纯度 培养的原代细胞经CK7免疫荧光细胞化学染色后,共聚焦荧光显微镜下观察发现CK7阳性细胞发出绿色荧光,同时记录DAPI染核细胞总数,改良组的原代细胞算出CK7阳性细胞比率接近100%,说明细胞纯度高;传统组的原代细胞阳性率仅有50%(P<0.05)。见图3。
2.3 CCK-8法测定HOSACs生长曲线2种处理方法所获得的原代细胞增殖能力通过OD值可看出均符合肿瘤细胞的生长规律,见图4A。在细胞接种第3与第7天后,可见改良组增殖速度明显高于传统组,差异有统计学意义(P<0.01),见图4B、C。
3 讨论
近年来,随着人们对肿瘤的深入研究,实体肿瘤的原代细胞培养已经成为肿瘤基础研究方法的热点,拥有离体时间短、与体内细胞的生物学状态相接近以及能极大限度的保存细胞内的蛋白分子等优点[8]。原代细胞常用的传统培养方法有组织贴壁法和酶消化法,其中组织贴壁法最为常用。组织贴壁法在培养过程中不易游离出细胞,细胞生长易停滞且易污染。酶消化法常用的有胰酶和胶原酶,其中胶原蛋白酶消化能力弱、耗时长,从组织块消化到絮状物出现至少要数小时到数十个小时不等,在长时间的消化过程容易增加污染的概率,因此使用较少。胰蛋白酶-EDTA制剂的应用范围最为广泛,但是高浓度的胰酶由于消化能力过于强烈,若不能严格控制消化时间容则易对细胞造成损伤。
通过总结传统培养方法的优点,本研究探索出一种简单、高效提取HOSACs的方法。经反复试验研究,证实了改良组使用0.1 mg/ml透明质酸酶+0.25%胰蛋白酶-0.02% EDTA在37 ℃消化2~3 min的培养方法成功率最高。本试验方法的优点有:① 高纯度:HOSACs最多的杂细胞为成纤维细胞,但成纤维细胞对于胰蛋白酶的敏感性要高于HOSACs,所以在首次消化时能去除绝大部分的成纤维细胞,从而提高HOSACs的纯度;② 提取细胞速度快:对于间质较少的卵巢浆液性腺癌软组织在强大消化能力的胰蛋白酶作用下可以快速消化成单细胞团;加上透明质酸酶水解透明质酸的能力,降低细胞间质的黏性,加速细胞分离[8];因此在两者的同时作用下可以快速分离出细胞[9];③ 细胞生长快速:结合组织块贴壁法,保留消化后的粘稠状组织块并继续培养是试验成功获取癌细胞的关键步骤之一。在胰酶刺激后从组织块中爬出的细胞数量与速度都要远高于传统组织块法;加上改良组消化液消化后得到的细胞悬浮液给组织块提供了一个类似体内肿瘤的微环境,更加有利于细胞的生长。此外,研究[8]证明,表皮生长因子有助于细胞在对数生长期的增殖,因此在培养基中加入EGF(epidermal grow factor ,EGF),在细胞培养过程中是有助于上皮性卵巢癌的生长。
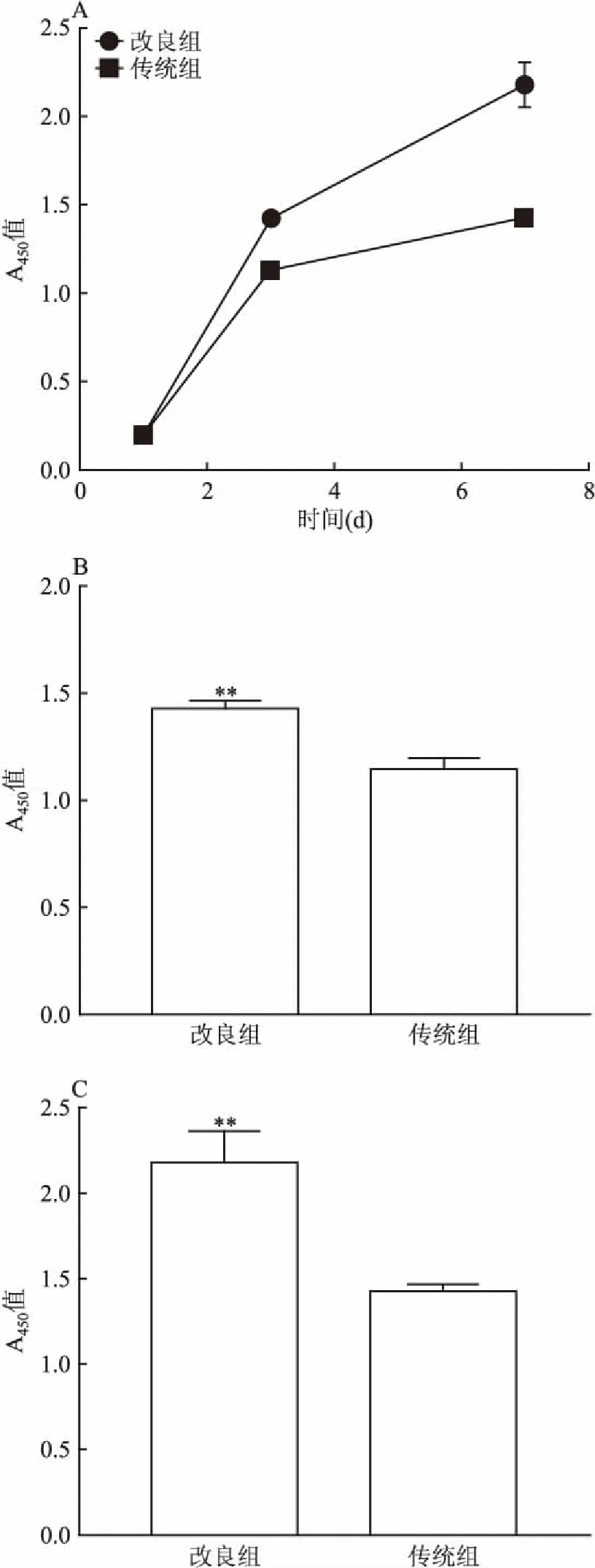
图4 HODACs生长曲线
A:细胞总生长曲线;B、C:第3天、第7天2组细胞OD值;与传统组比较:**P<0.01
在反复试验中总结发现,在人卵巢癌原代细胞培养中还需要注意几点:① 取材:尽量在癌灶丰富的地方取且一定要注意无菌;② 消化时间:合理控制胰酶消化时间,不宜过长或过短;③ 消化酶的体积:必须严格根据剪碎后的组织块体积来确定酶的量;④ 首次换液不宜过早,一般在24 h以后;换液频率不宜过高,每2~3 d 一次较为适宜。⑤ 细胞混悬液与消化组织块混合铺板:由于细胞量大所以细胞之间更容易相互接触,这样在培养初期可以极大的减少细胞凋亡,很好的保持细胞的固有特性[6]。⑥ 增强细胞黏附和生长能力:高浓度胎牛血清培养。
综上,由传统组与改良组原代细胞培养的结果对比,得出改良组的提取方法可以在短时间内获得高纯度、高增殖能力的HOSACs,从而为卵巢癌的深入研究奠定了良好的实验基础。
