蓝斑介导右美的镇痛镇静作用的神经机制研究
2020-07-13胡丹丹王烈成
施 伍,贾 欣,梁 悦,胡丹丹,王烈成,张 玲
右美托咪定(dexmedetomidine, DEX)是一种高选择性α2肾上腺素受体激动剂,广泛应用于临床的辅助麻醉和重症监护[1-2]。DEX具有明显的镇静和镇痛作用[3- 4],然而其镇静和镇痛的中枢机制尚未完全阐明。脑干蓝斑(locus coeruleus,LC)是脑内去甲肾上腺素能神经元聚集的主要核团,由LC发出的纤维向上可以到达皮层广泛区域参与觉醒和睡眠,由LC向下发出的纤维到达脊髓构成内源性的疼痛下行抑制调控环路[5-6]。大量的研究[7-9]表明DEX在脑内的作用的主要靶点是LC且DEX和吗啡具有协同作用[10]。现利用在体电生理技术在自由活动的小鼠上记录系统性给予不同剂量DEX对LC神经元放电的影响,并结合行为学和药理学实验,研究DEX的镇痛和镇静作用的关系和中枢机制。
1 材料与方法
1.1 材料与试剂DEX购自江苏恒瑞医药有限公司;纳洛酮购自上海爱必信公司;育亨宾购自美国Sigma公司。c-Fos一抗购自美国abcam公司;p-ERK一抗购自美国CST公司;二抗购自美国Invitrogen公司。实验动物选用成年健康的SPF级雄性C57BL/6小鼠,体质量20~25 g,共52只,由上海市实验动物资源中心(西普尔-必凯公司)提供,按照实验动物管理条例进行饲养,动物实验方案经上海同济大学动物伦理委员会批准。
1.2 方法
1.2.1机械缩足阈值的测定 提前将小鼠放入高架金属网底板的铁笼中适应30 min。测试时,用Von Frey纤维丝垂直刺小鼠后爪脚底,各纤维丝之间需间隔5 s,小鼠在受刺激时若出现快速抬足、抖足或舔足中的任意一种现象,此次刺激反应即被视为阳性反应,用up-down方法统计分析小鼠机械缩足阈值。
1.2.2热甩尾潜伏期的测定 热甩尾实验中,用软毛巾将小鼠的身体轻轻包住,只露出尾巴,注意头部尤其眼部遮光可以使小鼠尽量安静,将小鼠尾端3~4 cm的尾巴浸入48、50、52 ℃的水浴锅中,为防止小鼠尾巴烫伤,每次测试间隔应大于10 s,以尾回缩出水面的潜伏期,即热甩尾潜伏期为测定痛域的指标。
1.2.3鞘内注射 使用微量注射器在小鼠L4-5椎间隙进针,当出现轻微甩尾反射则视为成功,30 s内注射完10 μl药物,并剔除有运动障碍的动物。
1.2.4镇静评定 将单个小鼠置于干净的饲养笼中,让其自由活动,待测小鼠经过30 min的适应后,采用Chuck的镇静评定量表对其行为进行评分。
1.2.5电极制作 电极由16根单独绝缘的镍铬合金线(内径35 μm,阻抗300~900 KΩ; Stablohm 675,California Fine Wire)组成。16根微线阵列以4×4×4×4图案排列(线之间约200 μm间距)。焊接到18针连接器(Mil-Max)上,焊接处用AB胶封固,裸露的镍铬合金线用聚乙二醇2000保护。
1.2.6电极埋植 将用异氟烷诱导麻醉的小鼠固定于定位仪上,手术期间持续气体麻醉(诱导3%,维持1.5%),涂抹金霉素眼膏保护小鼠眼睛,剪开头皮暴露颅骨,将小鼠颅骨调整至符合定位标准的位置。用定位电极在颅骨标记埋植位点,用颅骨钻在该位点开窗。将自制的微丝电极阵列从开窗部位插入LC上方(前后距:5.20 mm,旁开距:0.92 mm,深度:3.58 mm),埋植前将电极阵列头端沾取少许Neuro-DiI染料(Biotium,美国),以便后期确定埋植位置。将参考电极缠绕到两个颅钉上后拧紧。将3M Vetbang组织胶(美国3M公司)涂抹于颅骨和颅钉表面,之后迅速用牙科水泥将裸露的电极和颅骨封盖。待牙科水泥坚硬后将小鼠取下,放到电热毯上保温以加快术后恢复。
1.2.7在体电生理记录 神经元信号记录应在安静房间中的屏蔽箱中进行,并在小鼠电极埋植恢复7 d后开始,为了减少电极脱落的风险,记录前将小鼠用异氟烷轻度麻醉后,迅速将埋植在小鼠头上的电极与记录系统相连接,将小鼠放在记录箱中自由活动30 min以适应环境,使用多通道数据采集系统同步采集小鼠腹腔注射DEX之后鞘内注射纳洛酮或育亨宾后的实时LC神经元电信号,采样频率为500 Hz,记录40 min。
1.2.8在体电生理数据分析 为了筛选出高质量的单细胞聚集波,用Offline Sorter软件去掉明显的杂波,经筛选的数据用NeuroExplorer(Nex Technologies,美国)软件分析,可得出LC神经元的放电频率的变化图表。
1.2.9免疫组织化学 切好的脑片漂洗2次,液室温封闭1 h后,弃封闭液,加入一抗(1 ∶2 000)4 ℃孵育过夜,再弃一抗漂洗3次后加二抗(1 ∶1 000),室温孵育2 h后弃二抗,漂洗3次后将脑片贴在载玻片上,封片拍摄。

2 结果
2.1 腹腔注射DEX对小鼠机械性触诱发痛的镇痛和镇静作用为了明确DEX是否影响小鼠机械痛,给予小鼠腹腔注射不同剂量的DEX (0~20 μg/kg) ,每组5只,20 min后使用Von Frey纤维丝测量小鼠机械痛。结果显示,DEX增加小鼠的机械痛阈,并且镇痛作用具有剂量依赖性 (图1 A)。值得注意的是,腹腔注射DEX在10 μg/kg或以下剂量时,小鼠的痛阈值没有明显改变,只有当DEX浓度升高到12 μg/kg及以上,小鼠机械痛阈值明显升高。
为了明确DEX的镇痛作用是否由镇静效应引起,课题组除了测量不同剂量DEX对小鼠的痛阈值的影响以外,同时还对小鼠的镇静行为进行评分。根据小鼠的行为从清醒到睡眠依次以0~5分进行统计(具体评分标准见材料与方法)。结果显示,腹腔注射DEX 10~16 μg/kg时,小鼠并没有明显的镇静作用,而腹腔注射DEX升高到18 μg/kg及以上时,出现逐渐增强的镇静作用 (图1 B)。以上结果提示,DEX在小鼠表现出镇痛和镇静双重作用,低剂量时主要表现为镇痛,高剂量时则出现镇静作用,并且DEX的镇痛和镇静作用均具有剂量依赖性。
2.2 DEX对LC神经元放电的影响在小鼠LC埋植记录电极(图2G),使用多通道在体电生理技术记录LC神经元放电(图2E),在小鼠腹腔注射DEX 20 min后记录DEX对LC神经元放电的影响,并与给药前进行比较。实验显示低剂量的DEX(6 μg/kg)可引起45.5%(10/22)的LC神经元放电频率增加(图2C、D),18.2%(4/22)的神经元放电频率降低,36.3%(8/22)放电频率不变,记录细胞总数22作为分母 (图2F);而高低剂量DEX(20 μg/kg)则引起大部分(90%,34/38)LC神经元放电抑制 (图2A、B),5%(2/38)的LC神经元放电增加,5%(2/38)不变,记录细胞总数38作为分母(图2 F)。该结果提示,不同剂量的DEX对LC神经元的活动产生不同的作用。
2.3 较高剂量的DEX(20 μg/kg)降低LC去甲肾上腺素能神经元活性为了确定腹腔注射DEX所致的镇静镇痛作用是否有LC去甲肾上腺素能神经元的参与,给予小鼠腹腔注射6、20 μg/kg DEX,运用免疫组织化学的方法对LC神经元c-Fos和p-ERK表达做定性定量分析,并对LC去甲肾上腺素能神经元进行染色。结果显示,腹腔注射DEX(6 μg/kg)会引起LC去甲肾上腺素能神经元活动增加(图3 A)。腹腔注射DEX(20 μg/kg)会引起LC去甲肾上腺素能神经元活动下降(图3 B)。统计各断面被激活的去甲肾上腺素能神经元与所有去甲肾上腺素能神经元的比值发现,在距离Bregma点-5.34 mm和-5.40 mm 2个断面,与腹腔注射DEX 6 μg/kg 相比,20 μg/kg LC去甲肾上腺素能神经元活性显著下降(图3C、D)。
2.4 DEX对小鼠的镇痛作用由脊髓α2受体介导为了研究DEX的镇痛机制,给予小鼠腹腔注射DEX(14 μg/kg)20 min后于鞘内注射α2受体拮抗剂育亨宾(0.03 μg溶于10 μl PBS)。热甩尾实验显示,DEX(14 μg/kg)明显增加小鼠在48、50、52 ℃热水中的甩尾潜伏期并且DEX抑制小鼠热痛敏的作用可被育亨宾阻断 (图4A)。 Von Frey实验结果也显示育亨宾阻断DEX对机械痛的镇痛作用 (图4B)。而高剂量的DEX(20 μg/kg)的镇痛及镇静作用并不受α2受体拮抗剂育亨宾(0.03 μg 溶于10 μl PBS)的影响(图4C、D)。以上结果提示低剂量DEX抑制机械痛敏和热痛敏的作用均由脊髓α2受体介导,而高剂量DEX的镇静作用不受脊髓α2受体影响。

图1 DEX对小鼠镇痛和镇静作用

图2 DEX对LC神经元放电频率的影响
A、B:腹腔注射DEX(20 μg/kg)前(A)和后(B)的LC放电光栅图;C、D:腹腔注射DEX(6 μg/kg)前(C)和后(D)的LC放电光栅图;E:单个神经元放电模式图;F:腹腔注射DEX 20、6 μg/kg后LC放电频率变化的细胞数的比例和分布图;G:电极埋植位点示意图×5
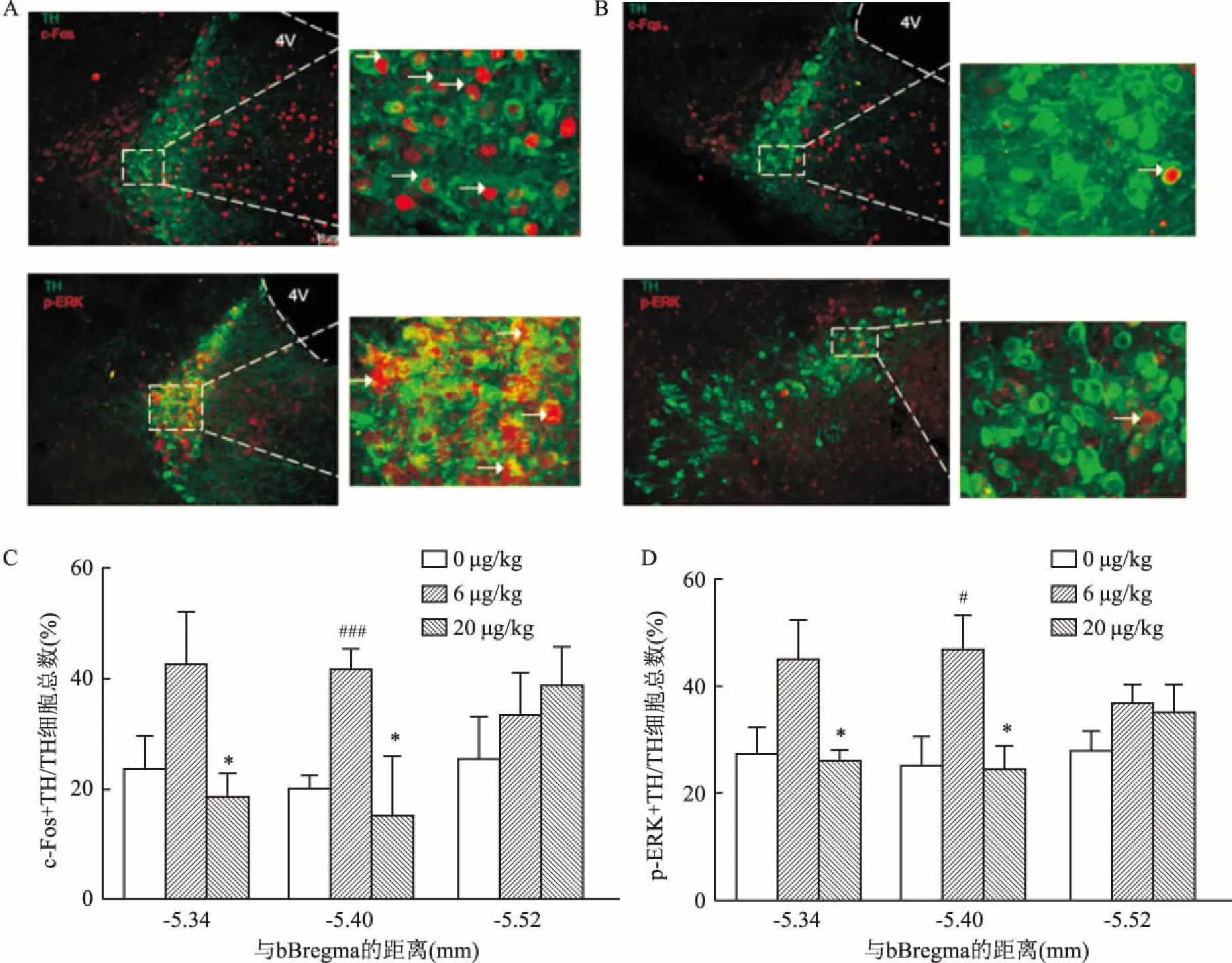
图3 DEX对LC神经元c-Fos和p-ERK表达的影响
A:腹腔注射 DEX(6 μg/kg)对LC神经元c-Fos和p-ERK表达的情况示意图 ×20;B:腹腔注射DEX(20 μg/kg)对LC神经元c-Fos和p-ERK表达的情况示意图(箭头指TH神经元和c-Fos或p-ERK共标的细胞)×20;C:腹腔注射不同浓度DEX对LC神经元c-Fos表达的情况比较;D:腹腔注射不同浓度 DEX对LC神经元p-ERK表达的情况比较;与6 μg/kg 组比较:*P<0.05;与0 μg/kg组比较:###P<0.001,#P<0.05

图4 低剂量的DEX对小鼠机械痛和热痛的镇痛作用均由脊髓α2受体介导
A:腹腔注射DEX后鞘内注射育亨宾在不同温度下对热甩尾潜伏期的影响;B:腹腔注射14 μg/kg DEX后鞘内注射育亨宾对机械痛阈的影响;C:腹腔注射20 μg/kg DEX后鞘内注射育亨宾对机械痛域的影响;D:腹腔注射20 μg/kg DEX后鞘内注射育亨宾对镇静评分的影响;与正常组比较:***P<0.001,*P<0.05;与DEX+溶剂组比较:###P<0.001,##P<0.01,#P<0.05
2.5 纳洛酮不能逆转DEX的镇痛作用为研究DEX镇痛效果是否与吗啡受体相关,小鼠腹腔注射DEX(14 μg/kg)20 min后鞘内注射纳洛酮(0.03 ng 溶于10 μl PBS)并不影响小鼠的热痛行为(图5A);鞘内注射0.3 ng和30 ng纳洛酮也不影响小鼠的机械痛行为(图5B)。实验结果表明DEX对热痛和机械痛的镇痛作用并不经脊髓的吗啡受体介导。

图5 低剂量DEX的镇痛作用不依赖吗啡受体
A:腹腔注射DEX后鞘内注射纳洛酮对热甩尾潜伏期的影响;B:腹腔注射14 μg/kg DEX后鞘内注射纳洛酮对机械痛阈的影响
3 讨论
大量的研究[11]证明以不同的途径给予DEX均可以产生镇痛效应,但因为DEX也有明显的镇静作用,因此为了研究系统给予DEX对小鼠镇痛和镇静的作用及其机制,课题组首先给小鼠腹腔注射不同剂量的DEX,观察对小鼠机械痛阈的影响并对镇静行为进行评分。显示在低剂量时DEX只有镇痛作用而不产生镇静作用。随着剂量升高,DEX使小鼠出现明显的镇静行为,且DEX的镇痛和镇静作用均具有量效关系,这一结果提示不同剂量的DEX可能通过不同的机制产生镇痛和镇静作用。
脑干的蓝斑核是包括DEX在内的多种肾上腺素α2受体的激动剂主要作用的核团[12]。离体脑片膜片钳实验显示30 nmol/L的DEX可以直接通过LC神经元膜上的肾上腺素α2受体使神经元产生超激化[7]。Funai et al[13]使用在体脊髓膜片钳技术证明腹腔给予低剂量的DEX(<10 μg/kg)可以增强脊髓背角神经元的抑制性突触后电位;而同样剂量的DEX在LC主要产生兴奋神经元的作用。因此可以确定DEX不仅对不同部位的神经元产生不同的作用,而且不同浓度的DEX对神经元的作用也有所不同。然而DEX对清醒小鼠的LC神经元活动究竟产生怎样的作用至今却未见报道。为了避免麻醉药物的影响,进一步明确DEX镇静和镇痛作用的神经机制,课题组采用多通道在体电生理记录技术检测了不同剂量DEX对自由活动小鼠蓝斑神经元放电的影响。显示低剂量的DEX主要增加LC的神经元放电频率,而高剂量的DEX则使大部分神经元的放电产生抑制。由于LC发出下行纤维主要到达脊髓构成疼痛的下行抑制环路[12],为了确定DEX对疼痛的调控是否由LC到脊髓的下行环路介导,课题组给予脊髓鞘内注射肾上腺素α2受体阻断剂育亨宾,结果显示育亨宾可以阻断DEX对热痛和机械痛的镇痛作用,这一研究结果表明了DEX激活了LC到脊髓的下行痛抑制环路并且脊髓α2受体介导了DEX的镇痛作用。由于脊髓的α2受体可表达在LC到脊髓的下行纤维以及脊髓的神经元中[14],DEX的镇痛作用主要由突触前还是突触后的α2受体介导仍需要进一步的研究。然而,鞘内给与α2受体拮抗剂并不影响高剂量DEX引发的镇痛和镇静作用,推测高剂量DEX可能通过抑制LC神经元的活动从而抑制了LC上行的与觉醒相关的神经环路产生镇静作用。对于不同浓度的DEX为什么会对LC神经元兴奋性和由LC构成的神经环路产生不同的作用,其机制还需要进一步地深入研究。
大量的来自临床的研究显示,DEX和吗啡具有协同作用,DEX与吗啡同时使用可以降低吗啡使用量,具有减少吗啡成瘾的作用[10]。为了研究DEX的镇痛作用是否为吗啡受体依赖,课题组给予小鼠鞘内注射纳洛酮,显示DEX对热痛和机械痛的镇痛作用均不受纳络酮影响,提示DEX的镇痛作用并不依赖吗啡受体。
