胶质瘤干细胞分泌的外泌体对缺氧/复氧损伤的血管内皮细胞的影响
2020-07-13胡珊珊谢时帅1牛万祥1董永飞1程传东1牛朝诗1
徐 峰,胡珊珊,谢时帅1,,牛万祥1,,董永飞1,,程传东1,,牛朝诗1,
神经胶质瘤生长迅速、侵袭能力强,这可能与恶性肿瘤中存在缺氧/复氧微环境有关[1]。恶性胶质瘤一经确诊,以手术切除为主,放化疗为辅,总体治疗效果不佳。近年来,Germano et al[2]研究发现胶质瘤干细胞(glioma stem cells,GSCs)大量存在于神经胶质瘤中,它能在胶质瘤中发挥重要作用(如恶性增殖、侵袭和肿瘤血管生成等)。GSCs大多数存在于干细胞巢中,在胶质瘤的缺氧微环境中发挥保护作用。Bao et al[3]通过研究发现GSCs能分泌血管内皮生长因子(vascular epidermal growth factor,VEGF)促进肿瘤周围的血管内皮细胞(human brain mircrovascular endothelial cells,HBMECs)大量增生,抑制其凋亡。研究[4]表明,肿瘤细胞分泌的外泌体囊泡可以在细胞与细胞之间转运如生长因子之类,从而发挥物质交换及信息传递等作用。该研究旨在探讨在体外实验中,GSCs来源的外泌体是否对缺氧/复氧损伤的血管内皮细胞有保护作用。
1 材料与方法
1.1 材料HBMECs购自美国ScienCell公司;人来源U87胶质瘤细胞株购自中科院上海细胞库。无外泌体血清购自美国SBI公司;一抗(von Willebrand factor,Vwf)购自武汉博士德公司;FITC标记的二抗(羊抗小鼠)和FITC标记的驴抗兔购自美国Jackson公司;Neun抗体购自美国Millipore公司;DMEM、1640细胞培养液、DMEM/F-12细胞培养液、B27添加剂 、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和表皮细胞生长因子(epidermal growth factor,EGF)均购自美国Gibco公司;BCA试剂盒购自上海雅酶生物科技有限公司;辣根酶标记山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司;化学发光显影液购自美国MILLIPORE公司;GFAP单克隆抗体购自美国Novus Biologicals公司;CDl33单克隆抗体及CD63小鼠单克隆抗体购自英国Abcam公司;Neun抗体购自美国Millipore公司。细胞计数试剂盒(cell counting kit-8,CCK-8)购自合肥BIOMIKY公司;激光扫描共聚焦显微镜购自德国Zeiss公司;荧光显微镜购自德国Leica公司;流式细胞仪和超高速离心机购自美国Beckman公司。
1.2 方法
1.2.1GSCs的分离、培养、鉴定
1.2.1.1 GSCs的分离及培养 将U87胶质瘤细胞株在DMEM完全培养液进行常规培养,随后收集U87进行消化、离心,将重悬后的细胞迅速转移至干细胞培养液(DMEM/F-12细胞培养液、2% B27、20 μg/L EGF、20 μg/L bFGF)中常规培养,待细胞生长72 h后,收集细胞上清液,为后续实验准备。
1.2.1.2 GSCs的鉴定 ① GSCs的干细胞标志物鉴定:收集培养的肿瘤球细胞,转移到准备好的防脱载玻片上,在培养箱中放置4 h待细胞贴壁,添加适量多聚甲醛固定细胞,充分清洗后,分别加入1 ∶400 Nestin IgG抗体(一抗)和CD133 IgG抗体(一抗),4 ℃孵育过夜,清洗后加入对应的FITC标记二抗(1 ∶400),37 ℃条件下孵育1 h,加入DAPI染细胞核1 h(严格避光处理),最后在荧光显微镜下拍取照片。② GSCs的诱导分化实验:将肿瘤球细胞消化、离心后转移至有多聚左旋赖氨酸涂层的盖玻片上进行细胞诱导分化实验,添加DMEM完全培养液进行常规培养,5 d后,同上述操作方法进行GFAP染色处理,14 d后进行Neun荧光染色,分别在激光共聚焦显微镜下观察并拍取照片。
1.2.2GSCs-Exo的提取、鉴定及摄取
1.2.2.1 GSCs-Exo的提取 将收集细胞上清液培养液(200 ml),参照QIAGEN试剂盒说明书提取GSCs-Exo。BCA蛋白试剂盒检测GSCs-Exo样品中蛋白质的水平并定量,-80 ℃条件下保存。
1.2.2.2 GSCs-Exo鉴定 ① 20 μl提取的GSCs-Exo样品固定在Formvar-carbon载样铜网上,在室温条件下,静置5 min后用滤纸从铜网边缘吸去多余液体。随后,在铜网上添加10 μl的3 %磷钨酸溶液,室温环境下放置5 min晾干,最后,置于透射电镜的样品室中,观察GSCs-Exo样品的电镜下的形态,并拍摄照片。② 利用Western blot鉴定外泌体标志蛋白:将提取的GSCs-Exo样品用RIPA裂解液处理后,加入5×SDS上样缓冲液充分混匀,100 ℃中放置10 min,取30 μl样品采用SDS-PAGE电泳后,后转移到PVDF膜上后,在含脱脂牛奶(5%)的TBST液中室温封闭2 h,清洗后加入CD63小鼠单克隆抗体(1 ∶400),4 ℃孵育过夜,TBST清洗3次(每次10 min)后二抗(1 ∶400)孵育2 h,再用TBST清洗3次后,ECL曝光拍照。
1.2.2.3 摄取 将生长状况良好的U87细胞消化、离心、重悬后,用于本实验研究(1×105/孔),于干细胞培养液中常规培养,随后采用最终浓度为2 μl/ml的染色剂CM-Dil处理4代的肿瘤球细胞, 72 h后将肿瘤细胞球移至常规干细胞培养液继续培养3 d,留取上清培养液200 ml,同上述方法提取外泌体,在准备好盖玻片的6孔板中接种HBMECs,细胞贴壁之后,添加CM-Dil处理过的60 μg/ml GSCs-Exo样品常规培养,72 h后用多聚甲醛固定,清洗后加入兔抗人vWF(一抗,1 ∶400),参照上述实验方法,加入对应FITC标记的驴抗兔(二抗,1 ∶1 000),激光共聚焦显微镜下采集照片。
1.2.3HBMECs的缺氧/复氧损伤模型的建立 参照Gao et al[5]建立实验模型,待HBMECs生长达70%~80%后,换去原有的完全培养液,后添加无血清-无糖培养液(细胞缺氧液),置于缺氧小室中且不断通入混合气体(95% N2+5% CO2),待小室内氧气排尽后,将小室置于培养箱培养5 h,加入含10%的无外泌体血清的1640完全培养液正常培养1 h进行复氧。
1.2.4实验分组 HBMECs进行随机分组处理:① 对照组(CON):内皮细胞正常培养;② 缺氧/复氧组(H/R):内皮细胞进行缺氧5 h/复氧1 h处理;③ GSCs-exo+H/R组:含GSCs-exo终浓度为60 μg/ml加入无血清1640培养基孵育内皮细胞10 h后进行H/R处理。
1.2.5HBMECs活力的检测 将HBMECs接种于96孔培养板内,按每孔5×103个。根据实验分组后每孔加入10 % CCK-8混合液(总容量为100 μl),培养箱中常规孵育2 h后,酶标仪上450 nm波长处测定3组细胞吸光度。
1.2.6HBMECs迁移的检测 参照实验分组,将Transwell室放置24孔板中,下室加入无外泌体血清的细胞培养液750 μl,上室加入200 μl无血清培养的HBMECs,细胞计数为2×105个,培养过夜后将3组细胞用多聚甲醛固定,用结晶紫染色后显微镜下观察拍照。
1.2.7Annexin-V-FITC/PI双染法检测细胞凋亡 将HBMECs以1×106个/孔接种在6孔板中,参照实验分组,H/R结束后,收集细胞。在500 μl的Annex-in-V Binding Buffer中重悬HBMECs,再每组等量加入5 μl An-nexin-V-FITC和5 μl PI后上机检测。

2 结果
2.1 GSCs的鉴定GSCs的鉴定结果如下所示:① 将本实验培养的肿瘤球细胞进行神经巢蛋白(Nestin)和CD133免疫荧光染色,镜下可见其细胞质被染色成功,表明培养的肿瘤细胞球中特异性表达Nestin和CD133(图1)。② 进一步诱导分化实验中,5 d后镜下可见细胞球分化成胶质细胞样进行GFAP荧光染色处理,2周后可见其分化成神经元细胞样时,进行Neun荧光染色,如图2所示,证实GFAP和Neun两者表达均为阳性。

图1 GSCs特异性表达Nestin和CD133 免疫细胞化学染色 ×40
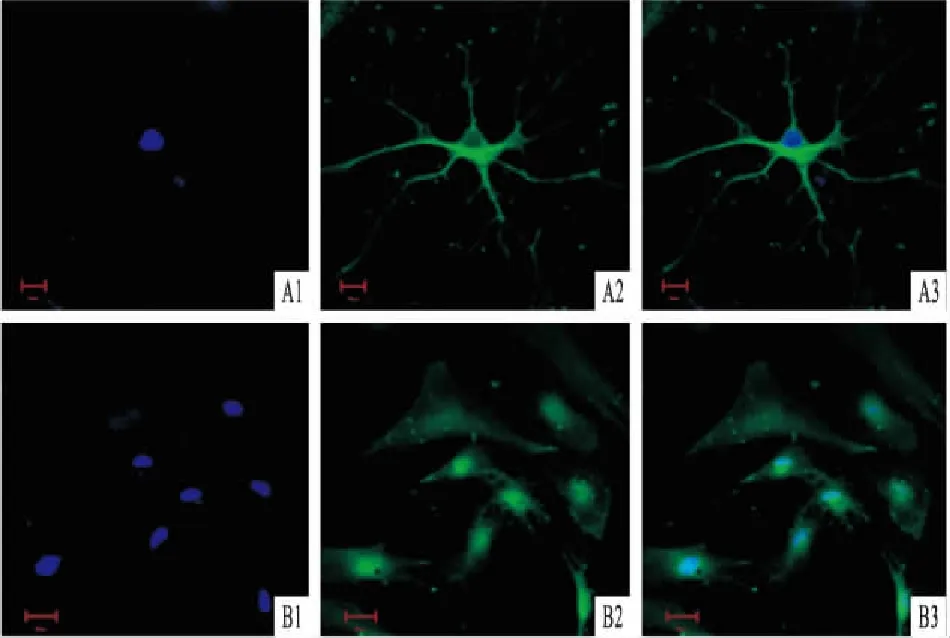
图2 诱导分化后证实 GSCs表达GFAP和Neun(bar=20μm)
2.2 GSCs-exo的鉴定和摄取在透射电镜(图3)下可见,GSCs-Exo样品形态呈圆形的膜性囊泡结构,直径在30 nm左右。Western blot证实GSCs-Exo蛋白样品内明显表达CD63(图4)。共聚焦显微镜下(图5)可见细胞内有红色颗粒样结构,即摄取的GSCs-Exo。

图3 GSCs-Exo形态圆形或椭圆形的膜性囊泡结构
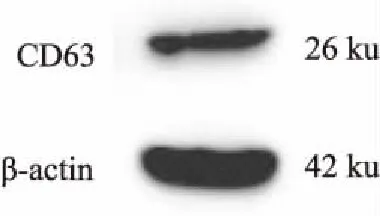
图4 Western blot检测GSCs-Exo特异性标志物CD63的表达情况
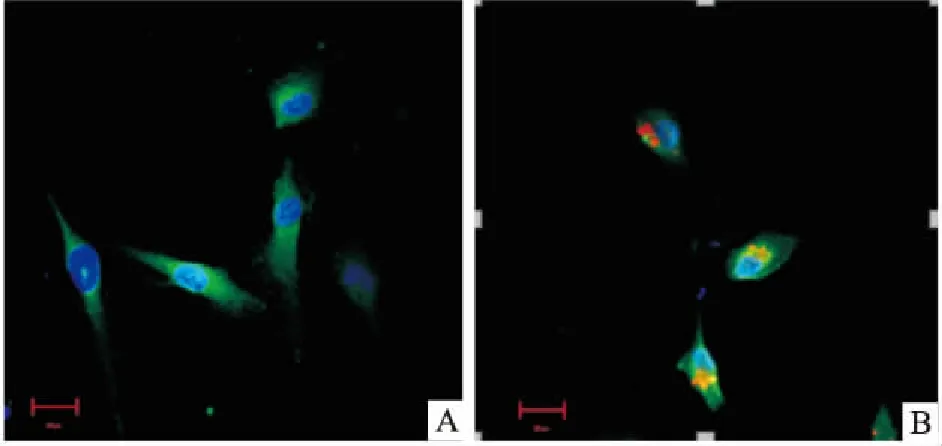
图5 HBMECs摄取GSCs-Exo(bar=20 μm)
A:含10%无外泌体血清的1640培养液培养的HBMECs;B:HBMECs内可见红色颗粒样结构,即摄取的GSCs-Exo
2.3 GSCs-Exo对HBMECs活性的影响血管内皮细胞活力分别为:与CON组(1.01±0.12)比较,H/R组(0.61±0.10)内皮细胞活力明显降低,与H/R组比较,GSCs-Exo+H/R组(0.79±0.12)细胞活力明显提升,组间比较差异有统计学意义(F=87.35,P<0.05),证实GSCs-Exo可以明显增加HBMECs的活力。
2.4 GSCs-Exo对HBMECs迁移的影响如图6,各组细胞的迁移数:CON组:(225±22.07)个/视野,GSCs-Exo+H/R组:(179±12.34)个/视野,H/R组:(101±6.56)个/视野。3组之间比较差异有统计学意义(F=51.782,P<0.05)。
2.5 GSCs-exo对HBMECs凋亡的影响结果表明,CON组凋亡细胞较少[FITC+PI-:(4.2±1.6)%],H/R组则出现大量凋亡细胞[FITC+PI-: (25.0±4.0)%],与H/R组相比,GSCs-exo+H/R组凋亡细胞明显减少[FITC+PI-:(14.2±2.0)%],组间比较差异有统计学意义(F=71.85,P<0.05)(图7)。
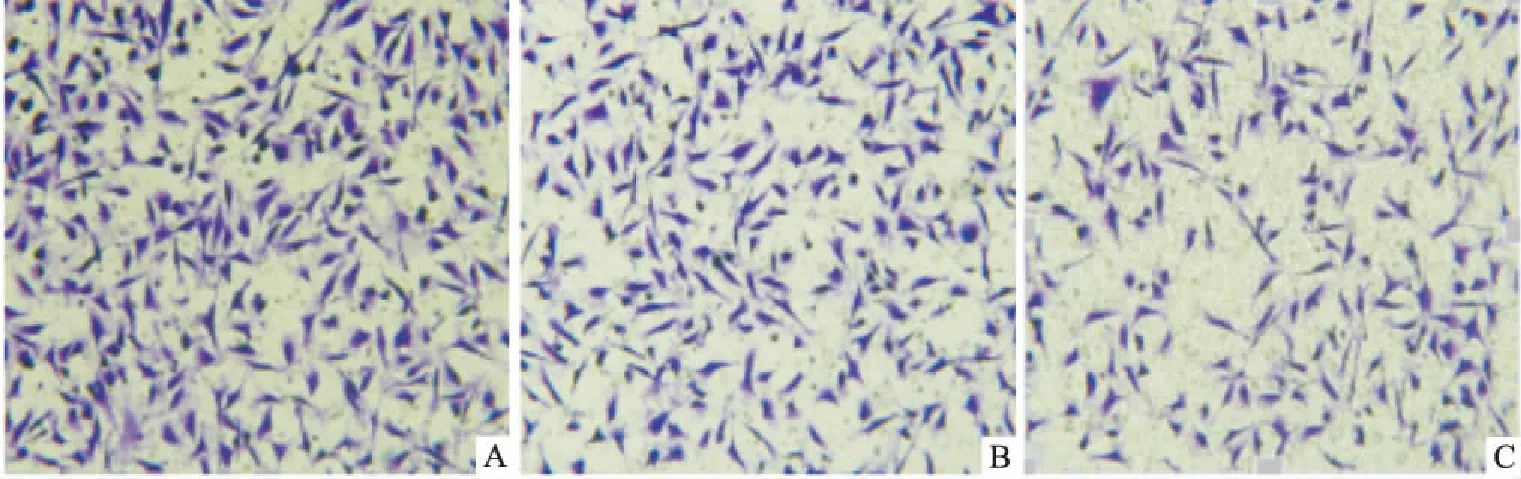
图6 GSCs-Exo对HBMECs迁移的影响 ×200
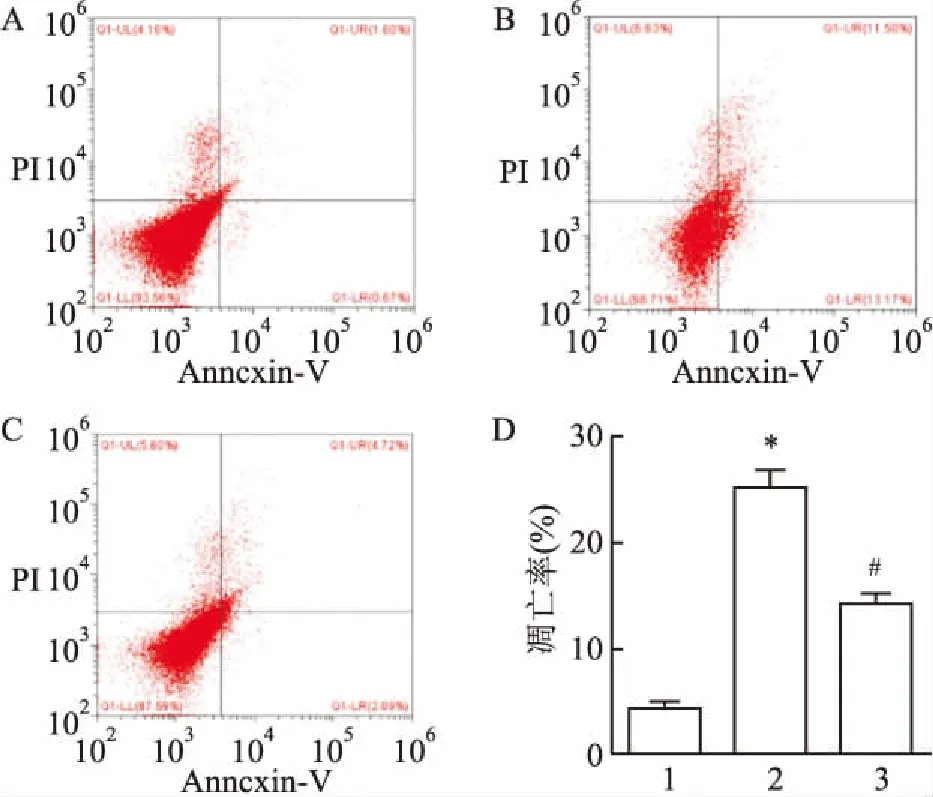
图7 GSC-Exo对HBMECs凋亡的影响
A:CON组;B:H/R组;C:GSCs-Exo+H/R组;D:各组细胞凋亡率;与CON组比较:*P<0.05;与H/R组比较:#P<0.05;1:CON组;2:H/R组;3:GSCs-Exo+H/R组
3 讨论
胶质瘤是一种较为常见的脑恶性肿瘤,由于长期处于高代谢状态,从而引起其自身耗氧量明显增多,最终导致肿瘤缺氧微环境的形成。Dvorak et al[6]研究发现,恶性程度较高的肿瘤为了应对其自身的缺氧微环境,存在肿瘤血管增生的过程完成复氧,证实了肿瘤中存在缺氧/复氧微环境。
He et al[7]发现,胶质瘤中确实存在胶质瘤干细胞巢,且与其本身的病理级别密切相关,其病理级别越高,干细胞巢的分布则更加广泛。研究[8]表明,胶质瘤干细胞巢由GSCs、各种胶质瘤细胞、大量微血管等组成,微血管内皮细胞是其干细胞巢的重要成分。Calabrese et al[9]进一步证实了胶质瘤干细胞巢的位置与血管紧密相关,常常分布于缺氧血管的周围,这表明GSCs与血管内皮细胞之间有着密切联系。
外泌体是人体内多种细胞(包括神经细胞、肿瘤细胞等)分泌的一种胞外囊泡,其内含有microRNAs、mRNAs、蛋白(CD9、CD63等)、脂质、细胞因子等[10]。研究[11]证实,外泌体与脑肿瘤、帕金森等中枢神经系统疾病有一定的关系。Kahlert et al[12]研究证实,肿瘤细胞分泌的外泌体可以介导肿瘤细胞与其微环境之间的相互作用,从而影响其自身的发生、发展、恶性增殖及血管生成等。
Najbauer et al[13]研究发现CD133和Nestin是GSCs的特异性标志物,且CD133表达阳性的肿瘤球细胞诱导分化的细胞GFAP染色呈阳性反应,本实验培养的GSCs同时表达CD133和Nestin,且诱导分化后特异性表达GFAP,证实成功培养及鉴定了GSCs,同时提取GSC-exo,并对其作出鉴定。在体外模拟HBMECs缺氧/复氧条件,发现与CON组相比,H/R组HBMECs活力显著降低,凋亡细胞数增加明显,表明缺氧环境会对血管内皮细胞造成很大的损害,另一方面,本实验研究结果表明,与H/R组比较,GSCs-Exo+H/R组中的GSCs-exo样品被HBMECs成功摄入,HBMECs的活力明显提升,迁移能力显著增加,凋亡细胞数随之也显著降低,在体外实验中,成功证实了GSCs-Exo可以保护缺氧/复氧损伤的血管内皮细胞,促进细胞迁移,抑制细胞凋亡。同时,进一步证实了GSCs-Exo能够介导GSCs与其肿瘤微环境中血管内皮细胞之间的相互作用。Hundsberger et al[14]研究表明神经胶质瘤的一个重要特征就是大量微血管增生,大量微血管生成可以很好地满足胶质瘤的生长所需,提供诸如氧气、蛋白质及其他营养产物。Kobina et al[15]发现GW4869是一种鞘磷酶抑制剂,能抑制细胞来源的外泌体分泌,且在肿瘤的增殖、迁移、肿瘤血管生成及抗放疗等方面有一定的抑制作用。结合本课题组目前所做的研究,为进一步靶向胶质瘤微环境治疗提供新的途径。
综上所述,在缺氧/复氧微环境中,胶质干细胞与血管内皮细胞可以通过GSCs-Exo传递生物学信息从而发挥作用,因此,可以以外泌体为靶向开辟胶质瘤治疗新的道路,具体的作用机制有待进一步探究。
