E2F1 siRNA通过抑制血红素诱导的神经元凋亡发挥保护作用
2020-07-13李贤玉袁美春石柳柳张志锋
赵 丹,李贤玉,袁美春,吴 艳,石柳柳,张志锋
脑出血(intracerebral hemorrhage,ICH)是指非外伤性脑实质内血管破裂引起的出血,占全部脑卒中的20%~30%,具有高发病率、高死亡率、高致残率的特点。然而,至今无有效治疗措施[1-4]。脑血管破裂后,血液破入脑实质,红细胞中血红蛋白释放的血红素对细胞产生毒性作用,加重ICH后脑损伤[5]。E2F转录因子1(E2F transcription factor 1, E2F1)是调控细胞周期进程及细胞凋亡的核心参与者[6-7]。研究[8]提示E2F1促进缺血性脑损伤后神经元死亡、加重脑损伤。而E2F1在ICH中的作用尚不清楚。该实验用血红素处理大鼠原代皮层神经元,模拟ICH中血红素对神经元的毒性作用,探索E2F1在血红素诱导的神经元损伤中的作用及机制,以期为临床治疗ICH提供干预靶标及实验基础。
1 材料与方法
1.1 材料与试剂12只SD妊娠大鼠(体质量300~350 g)由湖北医药学院动物实验中心。兔抗大鼠E2F1单克隆抗体(ab179445)购自英国Abcam公司;小鼠抗大鼠NeuN单克隆抗体购自美国Millipore公司;Alexa Fluor®488标记的驴抗鼠抗体及Alexa Fluor®546标记的驴抗兔抗体购自美国Santa Cruz公司;HRP标记的山羊抗兔IgG购自武汉科瑞生物技术有限公司。 血红素购自美国Sigma-Aldrich公司;MTT细胞毒性检测试剂盒购自上海碧云天生物技术公司;LDH细胞毒性检测试剂盒购自美国Promega公司;Neurobasal及B27购自美国GIBCO公司;E2F1 siRNA及Control siRNA购自美国Santa Cruz公司;Lipofectamine 2000购自美国Invitrogen公司。TUNEL细胞凋亡检测试剂盒购自上海碧云天生物技术公司;caspase活性检测试剂盒、SDS-PAGE凝胶配制试剂盒、PVDF膜和化学发光试剂购自美国Millipore公司;DMI3000B型荧光显微镜购自德国Leica公司。
1.2 皮层神经元分离培养及鉴定大鼠妊娠至17 d,4%异氟烷麻醉,颈脱臼处死。70%乙醇喷雾腹部,取出胚胎,放入冰冷的分离液中。胚胎快速断头,除去脑膜及血管,将皮质置于冰冷的接种培养基(成份:Neurobasal,2% B27补充剂,0.5%FBS,0.5 mmol/L GlutaMAX-I 100X,25 mmol/L谷氨酸)。显微镊夹碎皮层组织,约为1 mm3大小,尼龙滤网漏斗过滤后,将皮质神经元悬浮在培养基中,并铺在多聚赖氨酸包被的培养皿上或6孔板上。第2天用不含FBS的培养基半换液,之后每隔3 d用不含FBS的维持培养基全部换液(Neurobasal,2% B27补充剂和0.5 mmol/L L-谷氨酰胺)。 7 d后,进行神经元标志蛋白NeuN荧光染色,NeuN阳性率达95%的细胞用于后续实验。
1.3 血红素处理及细胞损伤检测提前1 d将血红素用DMSO溶解,配制浓度为10 mmol/L 的储存液,实验当天稀释成1 mmol/L的工作液。 原代皮层神经元以2.5×105ml的密度接种于96孔板培养至12 d,向培养液中加入不同浓度的血红素,依据参考文献[1],使终浓度分别为12.5、25、50、100、200 μmol/L,放入细胞培养箱继续培养,12 h后进行MTT及LDH实验。分别于490 nm和570 nm处读取吸光度(optical density,OD)值。细胞活性计算公式:细胞生存率=(处理组值-调零孔值)/(对照孔值-调零孔值)×100%。治疗组及阴性对照组则分别在神经元中加入E2F1siRNA及Control siRNA 预处理24 h,再加入血红素处理,12 h后进行MTT及LDH实验。
1.4 凋亡检测制备TUNEL反应混合液,50 μl TdT酶+450 μl FITC荧光素标记液,混匀后即为TUNEL反应混合液,处理组滴加50 μl TUNEL反应混合液于样本上(阳性对照组先加入100 μl DNaseⅠ在15~25 ℃孵育10 min,吸水纸擦干玻片后加50 μl TUNEL反应混合液,阴性对照组仅加50 μl荧光素标记溶液),37 ℃避光孵育1 h,PBS洗涤3次,每次5 min,DAPI复染核。吸水纸擦干切片上液体,用含抗荧光淬灭剂的封片液封片,荧光显微镜下观察采集图像,凋亡细胞呈绿色荧光。
1.5 caspase活性检测血红素处理神经元12 h后进行caspase活性检测,操作步骤按照试剂盒说明。裂解细胞后,离心收集上清液,将样品与底物37 ℃孵育2 h,测定A570值,根据对硝基苯胺标准曲线和样品A值,计算出caspase酶活性。
1.6 免疫荧光双染神经元培养至12 d,取出含有细胞爬片的24孔板,吸出培养液,4% PFA 固定10 min,0.3% Triton X-100 室温破膜8 min;无菌PBS洗2 次,每次10 min;加入5% BSA封闭液室温封闭1 h;加入1%BSA稀释的E2F1抗体(1 ∶200),4 ℃冰箱过夜;次日室温复温5 min,吸出E2F1抗体孵育液,无菌PBS洗2次,每次10 min;加入Alexa Fluor®488标记的驴抗鼠抗体(稀释比例为1 ∶10 000),室温下避光孵育2 h 或37 ℃温箱避光孵育1 h; 5/万tween-20洗2次,每次10 min;0.3% Triton X-100室温破膜8 min; 5% BSA封闭液室温封闭30 min;加入1% BSA稀释的NeuN抗体(1 ∶200),37 ℃温箱避光孵育3 h,无菌PBS 洗2次,每次10 min;加入Alexa Fluor®546标记的驴抗兔抗体(1 ∶10 000),室温下避光孵育2 h或37 ℃温箱避光孵育1 h;吸出二抗,加入5/万tween-20 洗2 次,每次10 min;封片,共聚焦显微镜下拍照,处理分析照片。
1.7 Western blot检测收集培养至12 d的原代皮层神经元细胞,用RIPA裂解液提取总蛋白,蛋白变性后,采用SDS-PAGE及ECL显色检测蛋白水平。
1.8 细胞siRNA转染神经元培养至12 d时,弃掉培养液,加入无双抗的DMEM(含10%血清)培养液;将适量的Lipofectamine 2000和E2F1siRNA分别加到DMEM培养液中,室温下静置5 min; 将Lipofectamine 2000和siRNA合并混匀,静置20 min,使Lipofectamine 2000和siRNA 能够充分结合;将Lipofectamine 2000和siRNA 混合液以8字回旋法加入到培养孔中,轻轻摇晃培养板,放入37 ℃培养箱;转染12 h后,细胞培养液换成新的含10% 血清的DMEM培养液继续培养;24 h提取蛋白进行Western blot检测,鉴别转染效果,将转染效果最好的E2F1siRNA用于后续实验。针对靶基因E2F1设计的siRNA候选序列为:siRNA-1: 5′-GCUAUGAGACCUCACUGAATT-3′;siRNA-2: 5′-GGACCUUCGUAGCAUUGCATT-3′; siRNA-3: 5′-CUCCCUUAAGAGCAAACAATT-3′。

2 结果
2.1 大鼠原代皮层神经元培养鉴定镜下可见原代皮层神经元种植密度合适,神经元形态良好,至第7天见明显突起(图1A)。NeuN免疫荧光染色阳性率达95%(图1B)。
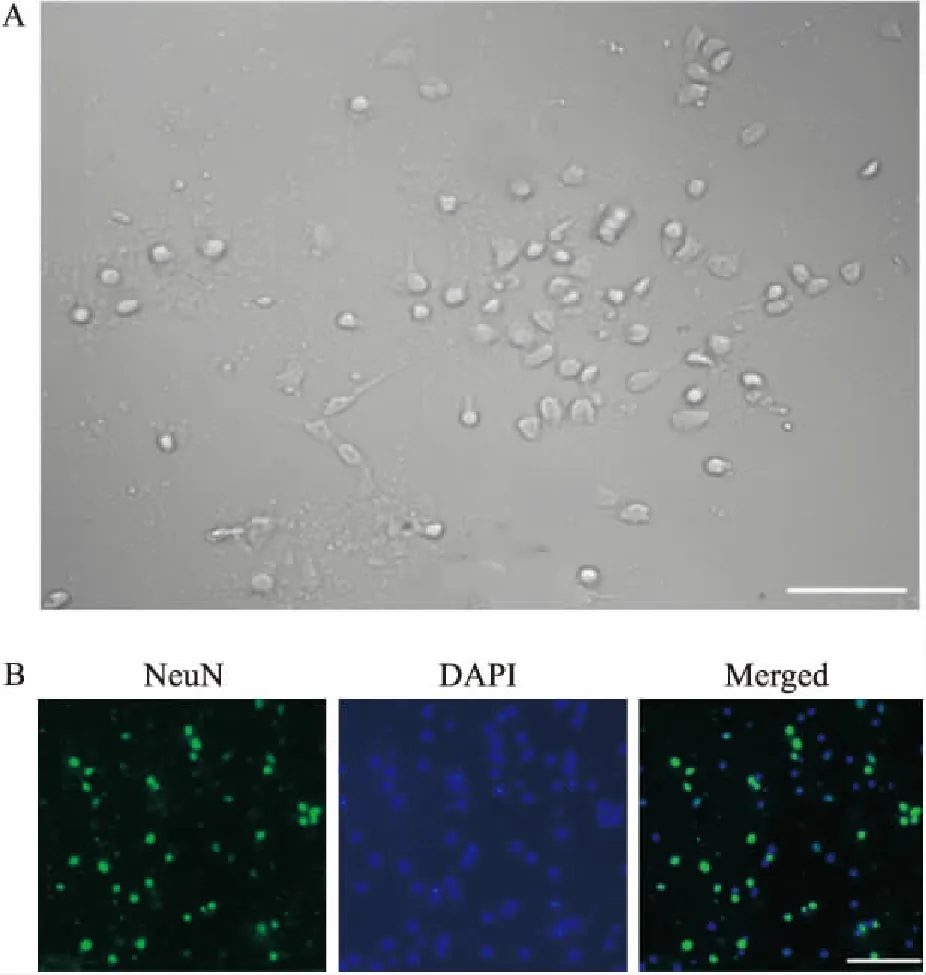
图1 大鼠原代皮层神经元培养及鉴定 ×200
2.2 血红素诱导神经元损伤为了排除溶剂DMSO的影响,不同的血红素浓度组均设置了溶剂组。结果显示,神经元暴露于血红素6 h后,与溶剂组相比,损伤组LDH释放率升高,细胞存活率降低(图2),提示血红素诱导大鼠皮层神经元损伤。根据实验结果,后续实验选择100 μmol/L作为最佳损伤浓度。
2.3 血红素诱导神经元E2F1表达上调为了判断E2F1是否参与血红素诱导的神经元损伤,首先检测了E2F1蛋白表达。免疫荧光双染显示E2F1定位于神经元细胞核(图3A)。Western blot检测结果显示血红素处理后神经元E2F1表达上调(F=22.9,P<0.05)(图3B)。
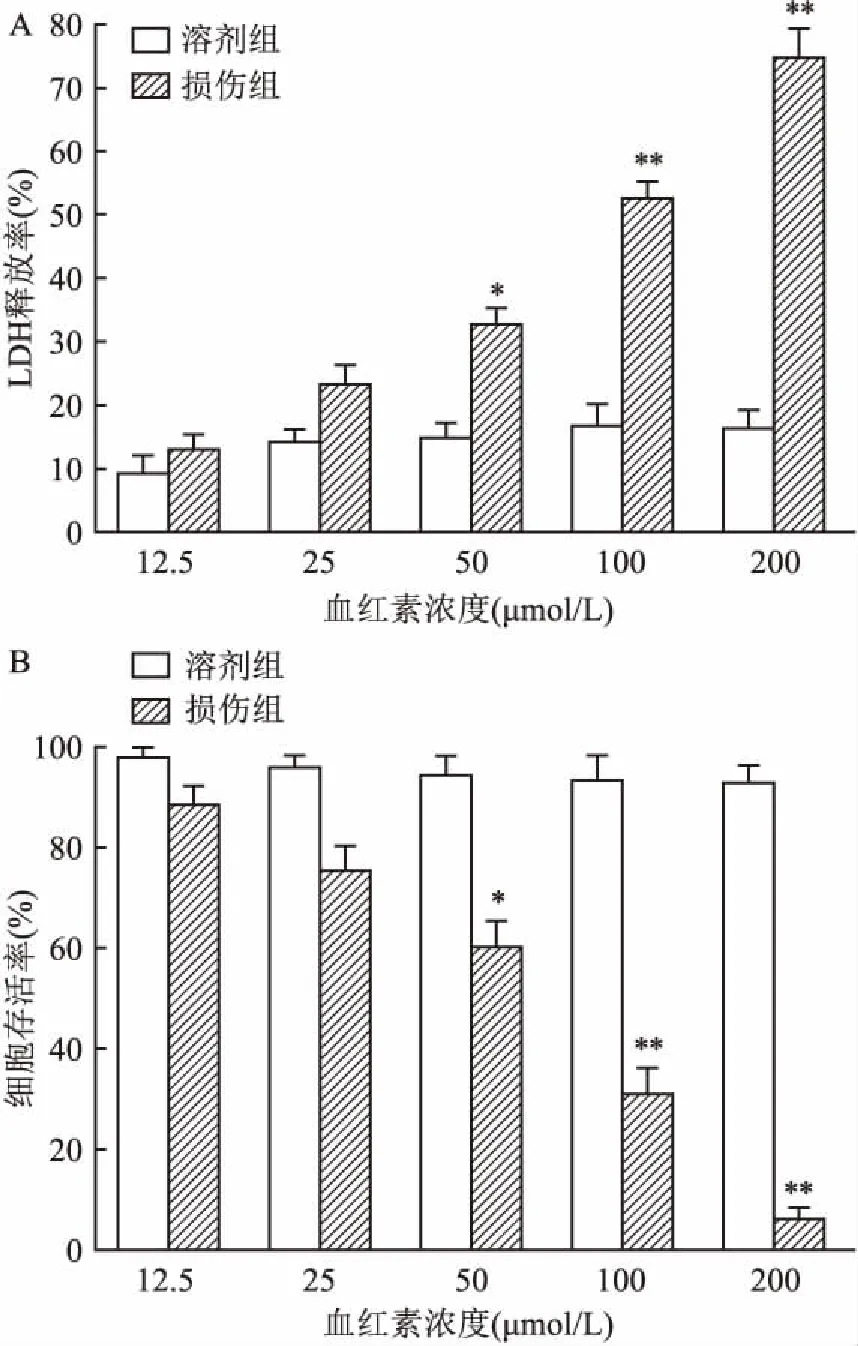
图2 血红素诱导提高皮层神经元LDH释放率和降低细胞生存率变化
2.4 E2F1siRNA减轻血红素诱导的神经元损伤为了探寻E2F1在此损伤过程的作用,将E2F1 siRNA转入神经元中,降低E2F1蛋白表达(图4A)。结果显示,与阴性对照组相比,治疗组LDH释放率降低(F=343.4,P<0.05),细胞生存率升高(F=127.7,P<0.05)(图4B),结果提示E2F1 siRNA减轻了血红素诱导的神经元损伤。
2.5 E2F1siRNA抑制血红素诱导的神经元凋亡为了探寻E2F1siRNA减轻血红素诱导的神经元损伤机制,进行TUNEL检测及caspase活性检测。TUNEL检测结果显示,血红素诱导神经元凋亡增加(损伤组vs溶剂组,F=67.2,P<0.05),而E2F1 siRNA处理后血红素诱导的神经元凋亡减少(治疗组vs阴性对照组,F=67.2,P<0.05)(图5A)。caspase活性检测结果显示血红素处理组caspase-3(t=15.7,P<0.05)、caspase-8(t=9.7,P<0.05)、caspase-9(t=7.8,P<0.05)活性较溶剂组均升高(损伤组vs溶剂组),而E2F1siRNA处理后caspase-3(t=8.6,P<0.05)、caspase-8(t=7.3,P<0.05)、caspase-9(t=5.7,P<0.05)活性降低(治疗组vs阴性对照组)(图5B)。结果提示,E2F1siRNA可能通过抑制血红素诱导的神经元凋亡而发挥保护作用。
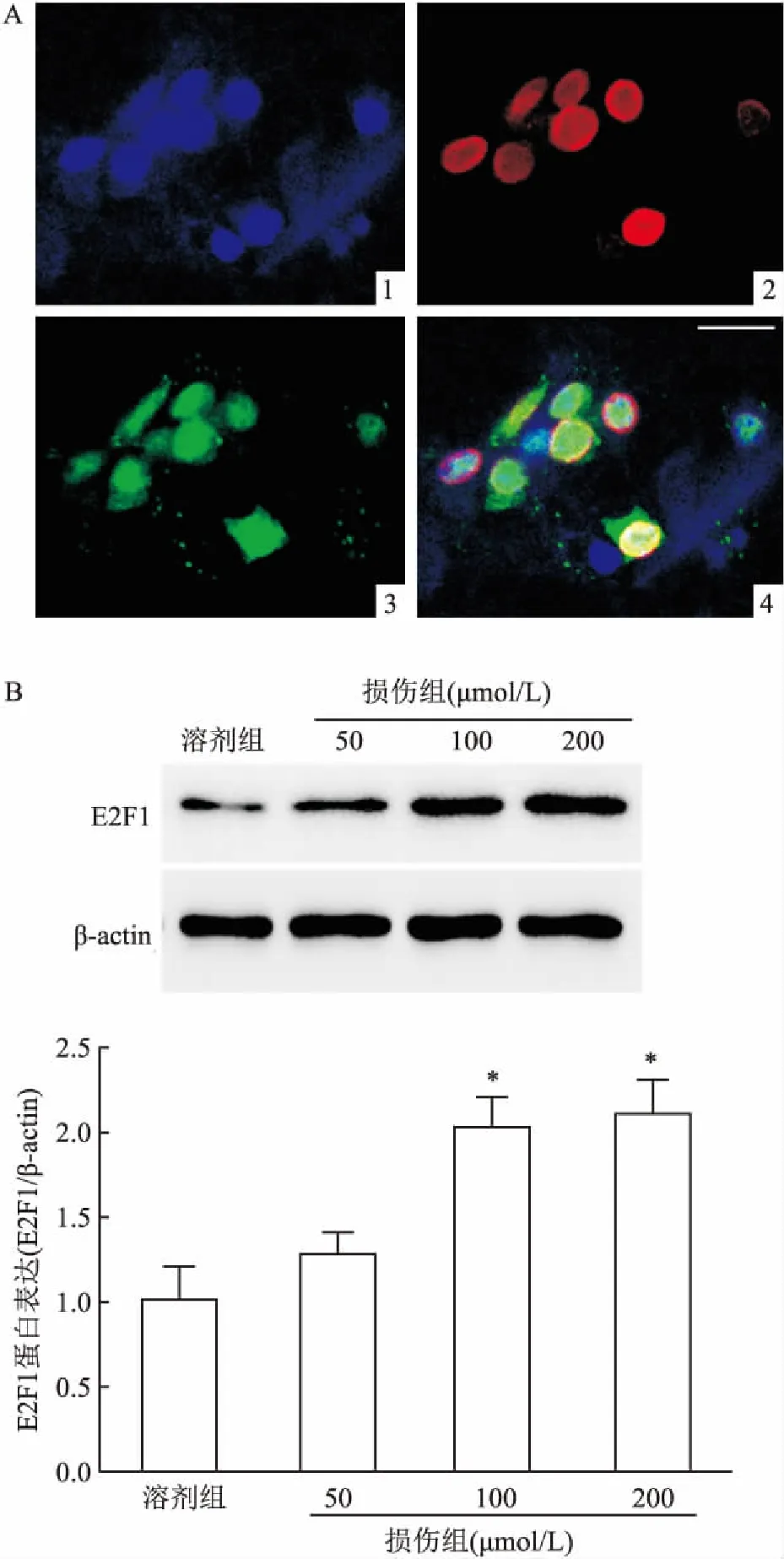
图3 血红素处理后神经元E2F1表达上调
A:免疫荧光双染检测E2F1在神经元中定位 ×400;1: DAPI;2: E2F1;3: NeuN;4:Merged;B:Western blot检测血红素处理后E2F1蛋白表达;与溶剂组比较:*P<0.05
3 讨论
ICH后继发性脑损伤是导致患者高死亡率和高致残率的重要原因。ICH后,红细胞裂解产生游离血红素,导致一系列氧化损伤和炎症反应,是造成ICH后继发性脑损伤的重要因素之一[1]。国际脑出血外科手术试验研究对1 033 例ICH患者进行统计分析结果显示,与内科保守治疗相比,发病后72 h内实行外科血肿清除术的患者其预后无明显改善[9]。ICH损伤机制复杂,目前除支持疗法外,缺乏行之有效的治疗方法,因此未来的研究应侧重于多种可能的干预靶标。

图4 E2F1siRNA降低皮层神经元LDH释放率和提高细胞生存率
A:E2F1siRNA转入神经元后,Western blot检测E2F1蛋白表达;B:LDH释放率及细胞生存率检测细胞损伤程度;1:溶剂组;2:损伤组;3:阴性对照组;4:治疗组;与阴性对照组比较:#P<0.05;与溶剂组比较:*P<0.05
据研究报道[1]ICH后红细胞释放的氧化形式的血红素、氧化还原活性铁、细胞 NADPH 和谷胱甘肽的消耗对细胞和组织带来直接的细胞毒性作用,进而引发一系列损伤反应,对神经元及神经胶质细胞造成损伤。研究[10-11]报道,血红素通过特定的信号传导通路诱导ROS的产生,或者通过诱导自由基的生成而引发进一步的脂质过氧化,或者通过其内的铁原子直接参与脂质过氧化,从而增加细胞对氧化损伤的敏感性。血红素亦可以通过激活TLR4 通路,促使小胶质细胞分泌IL-1β、TNF-α、IL-6等炎症因子,从而引起神经炎症,对神经系统造成损伤[12]。
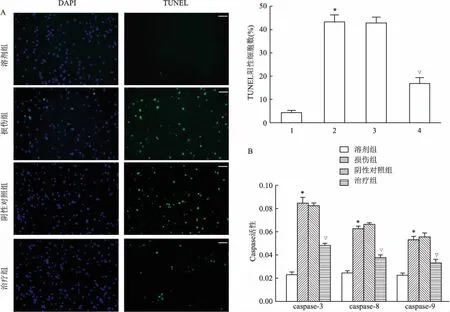
图5 E2F1 siRNA抑制血红素诱导的神经元凋亡
A:TUNEL法检测细胞凋亡数量 ×100;B:caspase活性检测;1:溶剂组;2:损伤组;3:阴性对照组;4:治疗组;与溶剂组比较:*P<0.05;与阴性对照组组比较:▽P<0.05
E2F1作为细胞命运的主要调节因子,其复杂作用被广泛研究,结果表明E2F1是神经系统疾病中重要的调节因子,在诱导细胞凋亡中的作用越来越受到重视[6-8]。本研究首先检测E2F1在大鼠皮层神经元的表达,结果表明E2F1与神经元标志物NeuN具有高度重叠性,说明E2F1表达于神经元细胞核中,提示E2F1极有可能参与神经元的功能调节。而对大鼠原代皮层神经元进行血红素处理后,神经元中E2F1表达升高,与最近的缺血性脑中风研究结果相一致[13]。细胞毒性实验结果显示,血红素处理组与对照组相比,LDH释放率增加、细胞生存率降低。同时,细胞凋亡实验结果显示,血红素诱导皮层神经元凋亡,caspase-3、caspase-8及caspase-9活性较对照组均升高。以上结果提示血红素诱导神经元凋亡及细胞毒性,对神经元造成损伤。为了检测E2F1在血红素诱导的神经元凋亡及损伤中的作用,进一步用E2F1 siRNA敲低神经元E2F1表达,结果显示E2F1 siRNA削弱了血红素诱导的LDH释放率增加及细胞生存率降低,同时减少了血红素诱导的神经元凋亡。结果提示,E2F1 siRNA减轻血红素诱导的神经元凋亡及神经元损伤。综上所述,E2F1参与血红素诱导的神经元凋亡及神经元毒性损伤。本研究为揭示E2F1在ICH后脑损伤中的作用及发现治疗ICH的新靶点提供了实验依据。
