日本斑点热立克次体安徽120株ompB基因及其编码蛋白的生物信息学和B细胞抗原表位分析
2020-07-13刘伯玉罗婉蓉余冬阳
刘伯玉,罗婉蓉*,陈 振,余冬阳,高 越, 朱 禹,洪 颖,2,杨 莉,柳 燕
斑点热(spotted fever, SF)是由斑点热群立克次体(spotted fever group rickettsiae, SFGR)引起的一组以急性发热和皮疹为主要临床症状的疾病的总称,主要包括:落矶山斑点热、日本斑点热、北亚热、昆士兰热等,是一种自然疫源性疾病,分布范围广且人群普遍易感[1-2]。近年来,随着人们社会活动的扩大以及旅游业的蓬勃发展,SF在美洲、欧洲和亚洲等新发病例逐年增加。我国至今已在十几个省、市、自治区证实有斑点热立克次体感染,并在蜱、鼠等中检测到斑点热立克次体DNA[3-5]。
日本斑点热归属于斑点热群,其病原体为日本斑点热立克次体,一种以蜱为主要传播媒介的感染性疾病。1984年首次在日本一名患者血中分离得到[6]。目前,该疾病已在多个国家发现,包括中国、日本、韩国、菲律宾和泰国等[7-8]。2013 年,课题组在安徽省大别山区1例发热患者血液标本中分离到1株日本斑点热立克次体近缘株安徽120株,简称安徽120分离株;这是首次在我国发现并成功分离的人感染日本斑点热立克次体[9]。
立克次体表面蛋白是存在于菌体表面的一大类蛋白,目前已知有20多种,包括OmpA(sca0)、OmpB(sca5)、GeneD (sca4)、β-peptide、Adr2、Sca1、Sca12、Sca13等多种蛋白[10];不同种的立克次体表面蛋白种类也有差异,同种立克次体表面蛋白在核苷酸和氨基酸序列也可存在差异,从而决定了其致病性、免疫性也存在不同。研究[11]表明OmpB能通过其效应结构域促进立克次体吸附到宿主细胞表面,并与其表面受体(Ku-70)特异性结合,介导细菌进入宿主细胞;同时OmpB蛋白还可刺激宿主产生特异、保护性抗体,在恢复期通过体液免疫杀灭游离的病原体,也可对再次入侵的病原体起到杀灭作用[12]。因此,ompB基因及其编码蛋白的研究对于深入理解立克次体的致病机制、临床诊断试剂和亚单位疫苗研发等均有重要意义。
考虑到安徽120株的地区特异性,在遗传进化上可能不同于国外分离菌株。为更好地了解安徽120分离株的生物学特点,该研究拟采用生物信息学方法,综合多种分析策略对其外膜蛋白基因ompB的结构、编码蛋白以及B细胞抗原表位进行探讨,为研究日本斑点热立克次体的致病机制与研发临床诊断试剂和亚单位疫苗等提供理论支持,为日本斑点热疾病的防制提供依据。
1 材料与方法
1.1 安徽120分离株ompB基因的克隆病原体的分离和鉴定ompB基因序列的PCR扩增、克隆和测序,参照课题组先前发表的文章[9,13]。
1.2ompB基因序列的NCBI递交所得的测序结果进行初步注释后,将基因序列提交NCBI。并与NCBI数据库上公布的日本斑点热立克次体其他分离株的ompB序列做同源比对。
1.3ompB基因的生物信息学分析及B细胞表位的预测参考已发表文献[14]的方法,分析安徽120分离株的ompB基因序列及其编码蛋白质。过程如下:采用Bioedit V7.0和NCBI的BLAST程序分析ompB基因序列特征和组成。采用NCBI的ORF Finder在线工具、Bioedit和ExPASy的ProtParam tool在线工具软件来预测ompB编码蛋白质的理化性质,如分子量、等电点、氨基酸组成、稳定性和摩尔消光系数等;采用ExPASy服务器的ProtScale程序分析ompB编码蛋白的疏水性;采用SignalP 5.0对ompB编码蛋白进行信号肽预测;采用TMHMM在线工具预测ompB编码蛋白跨膜区;采用SMART服务器对ompB编码蛋白功能结构域分析;采用GOR4服务器和SSPro 4.0服务器对ompB编码蛋白二级结构进行预测;采用SWISS-MODEL同源模建ompB编码蛋白的三级结构;参考文献[15-16]采用Lasergene软件的Protean模块并同时使用在线工具ABCpred Prediction Server预测ompB编码蛋白的B细胞线性表位。
1.4 统计学处理采用SPSS 20.0对数据进行统计分析。构成比的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 安徽120分离株ompB序列特征通过T-A克隆得到的ompB碱基序列后,利用Bioedit软件对ompB基因序列的组分进行了分析,发现ompB基因核酸序列总长度为5 280碱基对;分子质量为1 601.6 ku(单链状态)和3 198.3 ku(双链状态);GC含量是37.20%,AT的含量是62.80%。A、C、G和T核苷酸的摩尔分数见图1。同时,将所得的测序序列进行注释后,提交到NCBI,并与NCBI数据库上公布的日本斑点热立克次体其他分离株的ompB序列做同源比对,安徽120分离株的ompB基因(GenBank:KY364904.1)在3 297~3 311处与NCBI上的日本斑点热立克次体(Sequence ID:AP017602.1)序列比较,两序列的同源性为99%。安徽120株存在连续15碱基的缺失,除此之外,该分离株还有4个碱基突变,分别位于:T3204G、C 3170T、A414C和A292G。

图1 日本斑点热安徽120分离株ompB基因序列各核苷酸摩尔分数分布
2.2ompB编码蛋白氨基酸组成利用NCBI网站所提供的ORF Finder在线工具和Bioedit软件,结合NCBI网站的蛋白质数据库,预测了ompB基因编码的氨基酸数目为 1 651 个,蛋白质分子量为167.69 ku。所含的氨基酸含量较多的氨基酸是甘氨酸(Gly)(212个,12.84%),其次为Ala和Asn(均为196个,11.87%)。其余氨基酸组成分别为: 半胱氨酸(Cys)(2个,0.12%),Asp(75个,4.54%),Glu(23个,1.39%),Phe(70个,4.24%), His(11个,0.67%),Ile(119个,7.21%),Lys(57个,3.45%),Leu(108个,6.54%),Met(15个,0.91%),Pro (30个,1.82%),Gln (62个,3.76%),Arg (22个,1.33%),Ser (91个,5.51%),Thr (195个,11.81%),Val (133个,8.06%),色氨酸(Trp) (2个,0.12%),Tyr (32个,1.94%),见图2。
2.3ompB编码蛋白理化性质分析利用Geneva大学的ExPASy服务器(https://web.expasy.org/protparam/)中的ProtParam tool对ompB编码蛋白的理化参数进行了预测。该蛋白的原子组成为C7312H11658N2056O2424S17,总原子数目为23 467个。理论等电点pI为5.15,在组成ompB编码蛋白的20种氨基酸中,Gly所占的比例最高,达到12.84%,而Cys和Trp)的比例最低,均为0.12%。这些预测结果与Bioedit软件分析结果相一致。此外,课题组还得到ompB编码蛋白的消光系数为58 805(假设所有成对的半胱氨酸残基形成胱氨酸)或58 680(假设所有的半胱氨酸残基被还原),且蛋白不稳定指数为7.15,脂肪指数为88.86,总平均亲水性(grand average of hydropathicity,GRAVY)为0.06,根据Guruprased方法表明ompB编码蛋白较为稳定(蛋白质的不稳定系数>40,表明蛋白质在溶液中性质不稳定),且有疏水性(GRAVY值在2与-2之间,正值说明蛋白为疏水蛋白,反之为亲水蛋白)。
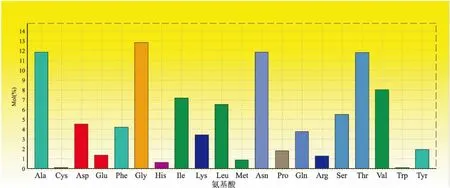
图2 日本斑点热安徽120分离株ompB编码蛋白各氨基酸摩尔分数分布
2.4ompB编码蛋白疏水性分析组成ompB编码蛋白质的20种氨基酸各自带有不同极性的侧链基团,其疏水的相互作用分析是进行蛋白质高级结构预测、功能域划分等必要过程。本文采用ExPASy服务器的ProtScale程序(https://web.expasy.org/protscale/)分析ompB编码蛋白氨基酸序列的疏水性。从结果中可得,多肽链第508位的Gly(G)具有最高的分值2.556,第 1 427 位的Tyr(Y)和 1 428 位的Lys(K)具有最低的分值-3.011。总体来看,疏水性氨基酸均匀分布在整个肽链中,且多于亲水性氨基酸,因此整个多肽链表现为疏水性,无明显的亲水区域,可认为ompB编码蛋白是疏水性蛋白,见图3。
2.5ompB编码蛋白信号肽分析使用SignalP 5.0 server(http://www.cbs.dtu.dk/services/SignalP/)的结合了深度神经网络、条件随机分类和迁移学习方法,能对信号肽进行更准确的预测。ompB编码蛋白经分析后,可以看出Signal peptide (Sec/SPI) Likelihood为0.567 7,存在信号肽序列,见图4。

图3 ProtScale程序分析ompB编码蛋白的疏水性结果
2.6ompB编码蛋白跨膜区分析ompB编码蛋白为跨膜蛋白,是一类结构独特的蛋白质,发挥着重要的生物学功能。使用TMHMM在线工具(http://www.cbs.dtu.dk/services/TMHMM/)对ompB编码蛋白跨膜结构域进行确证,从图5可以看出,蛋白在第12位到第34位氨基酸为跨膜区域。
2.7ompB编码蛋白功能结构域分析使用SMART服务器(http://smart.embl.de/smart/set_mode.cgi?NORMAL=1)分析ompB编码蛋白的结构功能域。ompB编码蛋白在第704位和第926位氨基酸之间存在一个Pfam区域,与细菌黏附宿主的功能相关。在第1 367位和第1 641位氨基酸之间有一自转运体区,与细菌的蛋白质转运有关。

图4 SignalP 5.0 预测ompB编码蛋白信号肽结果
2.8ompB编码蛋白二级结构分析采用GOR4服务器(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)和SSPro 4.0服务器对ompB编码蛋白二级结构进行预测,差异无统计学意义(P>0.05),均提示ompB编码蛋白二级结构中以无规卷曲为主,其次为β-折叠和α-螺旋,分别占到53.73%、30.83%和15.45%。无规则卷曲和β-折叠是ompB编码蛋白最大的结构元件,而α-螺旋则散布于整个蛋白质中。

图5 TMHMM在线工具分析 ompB编码蛋白的跨膜区结果
2.9ompB编码蛋白三级结构分析通过SWISS-MODEL (https://swissmodel.expasy.org)同源模建ompB编码蛋白的三级结构,其序列中1 308~1 651氨基酸部分在蛋白表面形成桶状结构,可能具有丝氨酸蛋白酶的作用,见图6。
2.10ompB编码蛋白B细胞表位分析采用Lasergene软件的Protean模块并同时使用在线工具ABCpred Prediction Server(http://crdd.osdd.net/raghava/abcpred/)来预测ompB编码蛋白的B细胞线性表位。结果表明,ompB编码蛋白整个分子具有较强的抗原性,分子内抗原表位较丰富(图7)。按照ABCpred Prediction Server预测B细胞抗原表位得分顺序(分数越高,抗原表位可能性越大),ompB编码蛋白共有159个可能的抗原表位。其中预测分值最高的前5位分别是:PGVGQNVTTFVNATNT(第1 269~1 284位,Score:0.94),TVSEDTTLGFINNAAN(第103~168位,Score:0.93),AINIGDGQGFMFNTNA(第223~248位,Score:0.92),VGNIGDSDTPVASVRF(第1 075~1 090位,Score:0.92)和TRTTNAAGQGKIIFNP(第665~680位,Score:0.91)。
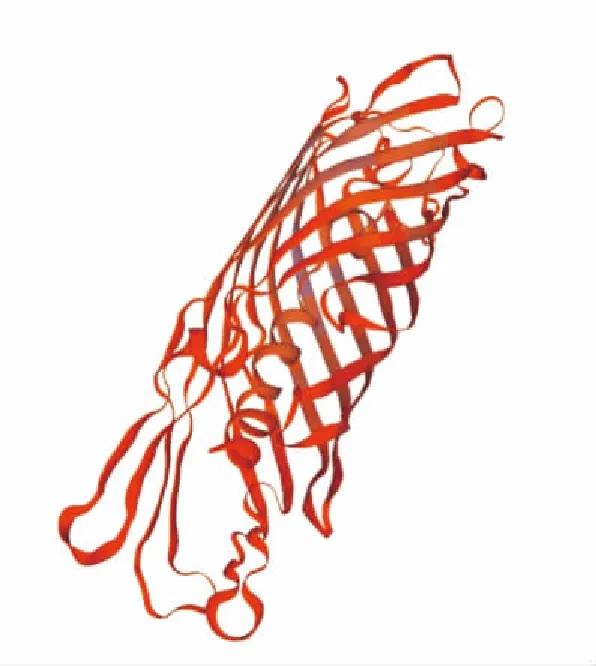
图6 通过SWISS-MODEL同源模建的ompB编码蛋白三级结构图(1 308~1 651氨基酸)
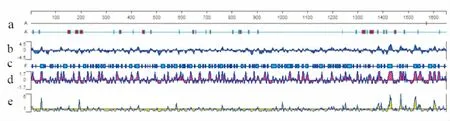
图7 ompB编码蛋白二级结构和抗原表位预测(Protean模块)
a:α-Helix prediction (Gamier-Robson and Chou-Fasman);b: Hydrophilicity prediction (Kyte-Doolittle);c: Flexible regions prediction (Karplus-Schulz); d: Surface probability prediction (Emini);e: Antigenic prediction(Jameson-Wolf)
3 讨论
本文所使用的ompB基因序列来自2003年本课题组在安徽省大别山区的患者急性期血液样本中分离到的一株日本斑点热立克次体近缘株,通过对其ompA、ompB、geneD、16SrRNA、17kD基因进行PCR测序分析表明,该菌为一株新的日本斑点热立克次体,相关研究[9]成果已在国际权威杂志发表。本文通过NCBI的BLAST程序对ompB基因进行了详细分析,发现安徽120分离株的ompB基因在3 297~3 311处与NCBI上的日本斑点热立克次体(Sequence ID:AP017602.1)序列比较,存在连续15碱基的缺失,除此之外,该分离株还有4个碱基突变,表明安徽120株不同于国外已经报道的日本斑点热立克次,有重要的研究价值,也提醒了国内临床医生在诊断不明原因发热疾病时,需留意日本斑点热立克次体的感染可能。
本研究运用了Bioedit、ORF finder、ProtParam tool、ProScale、SignalP、TMHMM等对ompB编码蛋白的氨基酸组成、蛋白质的理化性质、疏水性、信号肽、蛋白跨膜区、功能结构域、二级结构、三级结构等进行了分析。综合来看,ompB编码基因的氨基酸数目为1 651个,蛋白质分子量为167.69 ku,共用20种氨基酸组成,其中含量较多的氨基酸是Gly,其次为Ala和Asn。该蛋白的原子组成为C7312H11658N2056O2424S17,总原子数目为23 467个。理论等电点pI为5.15,消光系数为58 805或58 680,蛋白不稳定指数为7.15,脂肪指数为88.86,总平均亲水性(GRAVY)为0.06,为疏水性蛋白;Signal peptide (Sec/SPI) Likelihood为0.567 7,存在信号肽序列;蛋白在第704位和第926位氨基酸之间存在一个Pfam区域,与细菌黏附宿主的功能相关;在第 1 367 位和第 1 641 位氨基酸之间有一自转运体区,与细菌的蛋白质转运有关;蛋白二级结构中以无规卷曲为主,其次为β-折叠和α-螺旋,分别占到53.73%、30.83%和15.45%。无规则卷曲和β-折叠是ompB编码蛋白最大的结构元件,而α-螺旋则散布于整个蛋白质中;同源模建蛋白的三级结构中,第1 308~1 651氨基酸部分在蛋白表面形成桶状结构,可能具有丝氨酸蛋白酶的作用。
此外,本研究采用了Protean模块和ABCpred Prediction Server预测了ompB编码蛋白的B细胞线性表位。从该蛋白的二级结构、亲水性、表面可及性、柔韧性及抗原指数5个方面进行预测分析。从结果可以看出,ompB编码蛋白具有较强的抗原性,分子内抗原表位较丰富,共有159个可能的抗原表位,预测分数最高(0.94)的为1 269~1 284位序列,其次为103~168位的序列(Score:0.93);这些结果表明ompB编码蛋白B表面抗原的多肽较多,在制备亚单位疫苗时,应当选择蛋白的柔韧性区域,因为该区域易发生折叠和扭曲的几率高,形成表位的可能性较大,易与抗体进行结合[15];当然除了结合生物信息学分析结果外,选择的抗原表位肽段制备的疫苗效果如何,需要临床试验来证实。
