过表达miR-34a脂肪干细胞外泌体调控增生性瘢痕成纤维细胞增殖及凋亡的研究
2020-07-13肖向阳郑德义王宝云李自力
肖向阳,郑德义,王宝云,李自力
长期愈合的软组织伤口容易形成瘢痕,这不利于伤口愈合质量[1]。因此,缩短软组织创伤愈合时间,减少瘢痕形成,是临床急需解决的问题。脂肪干细胞(adipose-derived stem cells,ADSCs)能分泌多种可溶性因子,如生长因子、细胞因子、胞外体等[2]。外泌体是一个40~100 nm大小的细胞外小泡,形成于胞质并释放到细胞外环境[3]。研究[4]表明ADSCs或其外泌体能够促进真皮成纤维细胞在伤口愈合过程中的迁移,并且在促进皮肤或黏膜软组织创伤修复中有积极作用。miRNAs在细胞增殖凋亡等各种细胞反应中具有重要要作用,研究[5]表明miR-34a在ADSCs作用中过表达能影响细胞周期及增殖,但在ADSCs外泌体干预人增生性瘢痕成纤维细胞(hypertrophic scar fibroblasts,HSF)增殖凋亡情况中的作用尚不可知。因此该研究以HSF为研究对象,将其与过表达miR-34a的ADSCs外泌体共培养后,探讨miR-34a在ADSCs外泌体影响HSF增殖、凋亡过程中的具体作用机制,以期为临床研发新的治疗瘢痕疙瘩的治疗方案提供实验证据。
1 材料与方法
1.1 材料人脂肪组织来源于贵州省人民医院整形外科的一名27岁进行吸脂术的健康女性,术前签署知情同意书;HSF购自上海素冉生物科技有限公司;miR-34a过表达及其阳性对照慢病毒(2×108PFU/ml)购自上海汉恒生物科技有限公司;DMEM培养基购自北京索莱宝科技有限公司;胎牛血清购自美国HyClone公司;胰蛋白酶和胶原酶购自美国Gibco公司;TRIzol试剂购自美国Invitrogen公司;MTT试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、ECL化学发光试剂盒以及蛋白酶抑制剂均购自上海碧云天生物技术有限公司;qRT-PCR 试剂盒和逆转录试剂盒购自大连宝生物工程有限公司;兔抗人cleaved-Caspase-3、Bcl-2、Bax、Ⅰ型胶原蛋白(COL Ⅰ)、Ⅲ型胶原蛋白(COL Ⅲ)、p-Smad2、p-Smad3、TGF-β1和GAPDH抗体、兔抗人CD90、CD31、CD45、CD81、CD63、小鼠抗人CD105及辣根过氧化物酶标记山羊抗兔IgG 均购自英国Abcam公司;ExoQuick-TC外泌体沉淀液购自美国System Biosciences公司。
1.2 方法
1.2.1ADSCs的分离及鉴定 用磷酸盐缓冲盐水(phosphate buffer saline,PBS)洗涤脂肪组织后,将脂肪组织切成约25~50 μm的片状,用0.1%胶原酶在37 ℃下消化1 h,通过100 μm滤网过滤消化物,去除组织碎片获得单细胞悬液。1 000 r/min 离心5 min分离含有ADSCs的细胞悬液,共离心6次。将ADSCs按5×107个/ml的浓度接种于培养瓶中。于37 ℃、5% CO2恒温培养箱中培养72 h后,去除未贴壁细胞。每2 d换1次培养液,当细胞融合率达到80%后继续传代培养。取第3代细胞上流式细胞仪检测ADSCs表面分子标志物CD31、CD45、CD90、CD105的表达水平,并采用成骨诱导剂诱导分离出的ADSCs 成骨分化21 d,再使用茜素红和碱性磷酸酶染色观察ADSCs成骨分化能力。
1.2.2细胞感染 取对数生长期ADSCs,以1×105个/孔的密度接种于6孔板中,待细胞生长至70%融合度时,按照病毒感染比率值(MOI)50 ∶1分别加入miR-34a过表达慢病毒及其阴性对照慢病毒感染ADSCs,另取选用不做任何处理的ADSCs细胞作为对照,分别记为ADSCs/miR-34a组、ADSCs/miR-NC组和ADSCs组。培养6 h后,更换新鲜培养液,72 h后采用1 mg/L嘌呤霉素筛选稳定表达株。
1.2.3外泌体提取及鉴定 将ADSCs在无血清培养基中培养24 h,加入胰蛋白酶消化后收集培养基,3 000 r/min离心30 min去除细胞碎片,通过0.22 μm微孔过滤器。得到细胞上清液,再用微孔离心过滤装置100 000 r/min离心2 h浓缩,然后用ExoQuick-TC外泌体沉淀溶液孵育过夜。PBS将得到的外泌体重悬后,BCA测定其浓度后置于-80 ℃备用。透射电子显微镜观察收集到的外泌体形态,通过Western blot法检测外泌体标志物蛋白CD63和CD81的表达。根据不同分组ADSCs细胞提取的外泌体分为3组,分别为ADSCs外泌体(ExoADSCs)、ADSCs/miR-NC外泌体(ExoADSCs/miR-NC)和ADSCs/miR-34a外泌体(ExoADSCs/miR-34a)。
1.2.4外泌体与HSF细胞共培养 取对数生长期HSF细胞,以5×107个/孔的密度接种于6孔板中,血清饥饿培养24 h后,分为HSF+PBS组、HSF+ExoADSCs组、HSF+ ExoADSCs/miR-NC组和HSF+ExoADSCs/miR-34a组,分别加入含有不同外泌体及等量PBS溶液的新鲜无血清培养基继续培养48 h,收集细胞进行后续检测。
1.2.5qRT-PCR检测miR-34a的表达水平 采用TRIzol法提取各组ADSCs细胞及其外泌体总RNA,分光光度计测量RNA纯度。采用逆转录酶将总RNA反转录到cDNA,根据SYBR绿色荧光实时定量PCR试剂盒说明书,进行PCR检测。其中所用引物为miR-34a:forward 5′-CTCAACTGGTGTCGTGGAGTCGGC AATTCAGTTGAGAACAACCA-3′;reverse 5′-ACACTCCAGCTGGGTGGCAG TGTCTTAGCTG-3′;U6:forward 5′-CTCGCTTCGCAGCACA-3′;reverse 5′-AA CGCTTCACGAATTTGCGT-3′。PCR反应条件:94 ℃、2 min,94 ℃、15 s,60 ℃、15 s,72 ℃、30 s(40个循环)。以U6为内参,用2-ΔΔCt法计算基因的相对表达。
1.2.6Western blot检测外泌体标志蛋白的表达水平 采用不同外泌体处理HSF细胞48 h,弃培养基,收集各组细胞,采用RIPA细胞裂解液冰上裂解细胞后,4 ℃ 12 000 r/min离心10 min后取上清液,使用BCA蛋白检测试剂盒检测蛋白浓度。高温变性后取25 μg蛋白上样,用12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)分离蛋白质,并转移至聚偏二氟乙烯(PVDF)膜上,经5%脱脂牛奶室温封闭1 h后,加入一抗体兔抗人cleaved-Caspase-3(1 ∶500)、Bcl-2(1 ∶1 000)、Bax(1 ∶1 000)、COL Ⅰ(1 ∶1 000)、COL Ⅲ(1 ∶1 000)、p-Smad2(1 ∶300)、p-Smad3(1 ∶2 000)、TGF-β1(1 ∶100)、CD81(1 ∶1 000)、CD63(1 ∶1 000)和GAPDH抗体(1 ∶1 000),4 ℃孵育过夜,然后用辣根过氧化物酶结合二级抗体(1 ∶10 000)常温孵育2 h,使用ECL化学发光法对蛋白质进行化学发光,显影和定影,将得到的胶片进行拍照后用凝胶图像处理系统分析目的条带。
1.2.7MTT法检测细胞增殖 取对数生长期HSF细胞,以2×103个/孔的密度接种于96孔板中,每组设置3个复孔。待细胞生长至70 %融合度时,采用不同外泌体处理的HSF细胞48 h,弃培养基,将10 μl MTT(0.5 mg/ml)加入各孔中孵育4 h,去除上清液,加入200 μl DMSO终止反应。将细胞在37 ℃下再培养15 min,使用Bio-Rad酶标仪在c490 nm波长处检测每个孔的吸光度(optical density,OD)值。
1.2.8流式细胞术检测细胞凋亡 取对数生长期HSF细胞,以2×104个/孔的密度接种于6孔板中,待细胞生长至70%融合度时,采用不同外泌体处理HSF细胞48 h,弃培养基,用PBS清洗细胞后,胰酶消化并收集细胞,200 r/min离心5 min,弃上清液后重悬细胞,加入10 μl Annexin V-FITC和5 μl 碘化丙啶(propidium lodide,PI)混匀,室温避光孵育10 min,200 r/min离心5 min,弃上清液,加入0.5 ml PBS重悬,立刻用流式细胞仪分析细胞凋亡情况。

2 结果
2.1 ADSCs的鉴定流式细胞术结果(图1A)显示,ADSCs的表面抗原CD90、CD105呈阳性表达,而CD31、CD45呈阴性表达。将ADSCs进行成骨诱导后,茜素红染色结果可见大量橘红色钙结节(图1B),碱性磷酸酶染色结果可见胞质内出现蓝色沉淀(图1C)。说明,ADSCs分离成功。
2.2 ADSCs外泌体的鉴定经透射电子显微镜扫描显示,发现大部分呈双层膜结构的圆形或椭圆形囊泡状小体,直径为50~100 nm(图2A)。Western blot结果显示,与细胞溶解物比较,所提取物质中外泌体特异性表达标志物CD63和CD81高表达(图2B)。结果表明,所提取物质为外泌体。

图1 ADSCs的鉴定
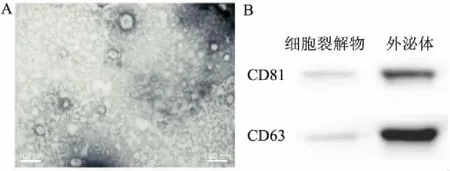
图2 ADSCs外泌体的鉴定
A:透射电镜显微镜观察ADSCs外泌体 Bar scale=100 nm,×140 000;B:Western blot法检测ADSCs的细胞裂解物和外泌体中CD81和CD63蛋白的表达水平
2.3 慢病毒感染后ADSCs及其外泌体中miR-34a表达水平比较qRT-PCR结果显示,与ADSCs和ADSCs/miR-NC组比较,ADSCs/miR-34a组的miR-34a的表达水平升高(F=198.600,P<0.05);与ExoADSCs和 ExoADSCs/miR-NC组比较,ExoADSCs/miR-34a组的miR-34a的表达水平升高(F=139.700,P<0.05)。见图3。
1.市场主导原则。按照市场规律,在线上线下互动创新发展中发挥市场配置资源的基础性作用,尊重企业的市场主体地位,并充分相信辖区企业和企业经营者的智慧,尊重企业“+电子商务”的自主经营权。

图3 ADSCs与外泌体的miR-34a的表达水平
A:慢病毒感染ADSCs后miR-34a的表达水平;B:慢病毒感染ADSCs后,其外泌体中miR-34a的表达水平;1:ADSCs;2:ADSCs/miR-NC;3:ADSCs/miR-34a;a:ExoADSCs;b:ExoADSCs/miR-NC;c:ExoADSCs/miR-34a;与ADSCs或ADSCs/miR-NC组比较:*P<0.05;与ExoADSCs或ExoADSCs/miR-NC组比较:#P<0.05
2.4 过表达miR-34a的ADSCs外泌体对HSF增殖能力的影响MTT 24、48、72 h结果显示,HSF+PBS组、HSF+ExoADSCs组、HSF+ExoADSCs/miR-NC组和HSF+ExoADSCs/miR-34a组细胞组间增殖能力差异有统计学意义(F=108.721,P<0.05;F=206.433,P<0.05;F=213.148,P<0.05);与HSF+PBS组比较,HSF+ExoADSCs组HSF细胞增殖能力降低(P<0.05);与HSF+ExoADSCs和HSF+ ExoADSCs/miR-NC组比较HSF+ExoADSCs/miR-34a组HSF细胞增殖能力降低(P<0.05)。见图4。

图4 过表达miR-34a的ADSCs外泌体对HSF细胞增殖能力的影响
与HSF+PBS组比较:*P<0.05;与HSF+ExoADSCs或HSF+ExoADSCs/miR-NC组比较:#P<0.05
2.5 过表达miR-34a的ADSCs外泌体对HSF细胞凋亡的影响如图5、6所示,与HSF+PBS组比较,HSF+ExoADSCs组 HSF细胞凋亡率升高,促凋亡蛋白cleaved-Caspase-3和Bax蛋白水平也升高,而抗凋亡蛋白Bcl-2蛋白水平降低(P<0.05);与HSF+ExoADSCs和HSF+ExoADSCs/miR-NC组比较,HSF+ExoADSCs/miR-34a组HSF细胞凋亡率升高,cleaved-Caspase-3和Bax蛋白水平也升高,而Bcl-2蛋白表达水平降低(P<0.05)。
2.6 过表达miR-34a的ADSCs外泌体对HSF纤维化及TGF-β/Smad信号通路相关蛋白表达的影响Western blot检测结果显示,与HSF+PBS组比较,HSF+ExoADSCs组HSF细胞COL Ⅰ、COL Ⅲ、p-Smad2、p-Smad3、TGF-β1蛋白表达水平降低(P<0.05);与HSF+ExoADSCs和HSF+ ExoADSCs/miR-NC组比较,HSF+ExoADSCs/miR-34a组HSF细胞COL Ⅰ、COL Ⅲ、p-Smad2、p-Smad3、TGF-β1蛋白表达水平降低(P<0.05),见图7。
3 讨论
脂肪组织广泛分布于人体内,在生理状态下对邻近的软组织起着重要的支持和保护作用。同时,脂肪组织作为一种活跃的内分泌器官,也是新陈代谢、生长发育、抗感染等生物学过程中的关键因素。自体脂肪移植用于复杂的伤口修复,在整形手术中也常用于软组织再生,脂肪间充质干细胞,在软组织创伤修复中发挥着重要作用[6]。但其作用机制尚不清楚。目前加速愈合和减少瘢痕形成的传统方法包括皮肤移植[7]、激光治疗[8]和局部应用一些生长因子[9]。然而,这些方法可能导致萎缩性瘢痕、色素异常、皮肤坏死等不良后果[10]。此外,局部注射因子很容易被体液降解,并且其剂量和浓度在伤口处经常发生较大的变化[11]。因此,有必要寻找一种稳定、有效、安全的新方法来促进软组织创面的愈合。

图5 过表达miR-34a的ADSCs外泌体对HSF细胞凋亡的影响
A:HSF+PBS;B:HSF+ExoADSCs;C:HSF+ExoADSCs/miR-NC;D:HSF+ExoADSCs/miR-34a;与HSF+PBS组比较:*P<0.05;与HSF+ExoADSCs或HSF+ExoADSCs/miR-NC组比较:#P<0.05

图6 过表达miR-34a的ADSCs外泌体对HSF细胞凋亡相关蛋白表达的影响
1:HSF+PBS;2:HSF+ExoADSCs;3:HSF+ExoADSCs/miR-NC;4:HSF+ExoADSCs/miR-34a;与HSF+PBS组比较:*P<0.05;与HSF+ExoADSCs或HSF+ExoADSCs/miR-NC组比较:#P<0.05
外泌体中miRNAs含量丰富且参与细胞大多数生理过程。miR-34a作为肿瘤抑制子,也对心肌成纤维化具有一定作用[14]。miR-34a是硬化成纤维细胞的潜在重要生物靶点,其通过调节Smad4促进TGF-β1诱导的心肌成纤维化细胞增殖、转分化和胶原分泌[14]。但在皮肤的成纤维细胞中miR-34a的作用没有相关研究报道。已有研究[15]证实抗凋亡蛋白Bcl-2是miR-34a的功能靶点,miR-34a通过与3’-UTR结合抑制Bcl-2的表达水平,进而促进肿瘤细胞凋亡。另外,miR-34a能抑制ADSCs的成骨成脂分化,并且降低了CDKs和Cyclins等多种细胞周期调控因子的表达,在细胞S期积累分裂细胞,抑制ADSCs的增殖[5]。这些研究报道从侧面证明了miR-34a对ADSCs增殖凋亡以及细胞纤维化有一定的作用。本研究结果显示,miR-34a过表达的ADSCs外泌体能有效抑制HSF的增殖,促进细胞凋亡,并且通过下调TGF-β/Smad、Ⅰ型和Ⅲ型胶原蛋白的表达抑制HSF的纤维化和胶原合成来减少瘢痕的生成。从miRNAs水平阐述了ADSCs外泌体对瘢痕成纤维细胞的作用,对临床上开发新的治疗方案提供了有力的证据。

图7 过表达miR-34a的ADSCs外泌体对HSF细胞纤维化及TGF-β/Smad信号通路相关蛋白表达的影响
1:HSF+PBS;2:HSF+ExoADSCs;3:HSF+ExoADSCs/miR-NC;4:HSF+ExoADSCs/miR-34a;与HSF+PBS组比较:*P<0.05;与HSF+ExoADSCs或HSF+ExoADSCs/miR-NC组比较:#P<0.05.
