miR-182调控HIF-2α通路对低氧诱导子痫前期滋养细胞侵袭的影响
2020-07-13谢莹莺
杨 娟,谢莹莺
子痫前期(pre-eclampsia,PE)是临床上以孕产妇高血压和尿蛋白为特征的多系统性疾病,世界上3%~5%的孕妇患有PE,是导致孕产妇及围生儿死亡的一个重要因素[1]。目前PE病因和发病机制还未有统一定论,一般认为胎盘着床时期滋养细胞凋亡、侵袭能力降低导致胎盘浅着床,是PE病发的关键环节。妊娠早期细胞胎盘发育处于低氧状态,是影响细胞侵袭的主要因素[2]。人miRNA长度一般为21~24个核苷酸,主要与靶基因3′UTR配对,抑制或降解靶基因mRNA翻译,从而参与机体生理过程[3]。miR-182位于人7号染色体,可诱导产生基因沉默复合物(RNA-induced silencing complex,RISC)并与其结合,之后与靶基因mRNA完全或不完全碱基互补配对,导致其降解或抑制翻译[4]。研究[5]表明miR-182可上调p38MAP信号通路,增强胆囊癌细胞侵袭能力。低氧诱导因子2α(hypoxia inducible factor 2α,HIF-2α),也可称为内皮PAS区域1(endothelial PAS domain protein 1,EPASI),是低氧调节通路中的重要因子。HIF-2α在调节细胞适应低氧环境,调控细胞增殖、侵袭方面已有报道[6]。miR-182和HIF-2α都与细胞侵袭有关,因此该研究拟探讨在低氧诱导PE细胞中miR-182、HIF-2α表达情况与细胞侵袭能力的关系,分析二者表达水平之间的联系。
1 材料与方法
1.1 病例资源收集青海大学附属医院2016年12月~2018年12月期间自愿行剖宫产术的PE孕妇67例,年龄23.12~35.27(27.49±2.10)岁,孕周(36.21±1.26)周,在手术中PE孕妇胎盘娩出5 min内,以脐带为中心取母体面中央区组织胎盘约1 cm33块,生理盐水冲洗干净,置于液氮中待用(注:取样时应避开出血、钙化、机化胎盘组织,并由母体面至胎儿面贯穿取材)。另选同期自愿行剖宫产术的健康孕妇84例作为对照组,年龄23.46~34.18(26.84±2.13)岁,孕周(37.05±1.18)周,取材部位和大小同PE孕妇。纳入标准:① 所有研究对象均签订知情同意书;② 本次妊娠正常,除PE外无其他并发症;③ 无心脏病、糖尿病、高血压、肝肾脏疾病;④ 孕妇均为第一次妊娠,单胎。排除标准:① 孕妇有流产史;② 胎儿畸形;③ 孕妇产期有吸烟史或服用药物。
1.2 仪器与试剂DMEM培养液、胎牛血清购自美国Sigma公司;Matrigel、Transwell板、胰蛋白酶、青链霉素双抗购自美国Sigma公司;总RNA提取试剂盒(货号:R1200)购自北京索莱宝科技有限公司;兔抗人HIF-2α、兔抗人血管内皮生长因子(vascular endothelial growth factor,VEGF)、兔抗人E-钙黏蛋白(E-cadherin)、兔抗人基质金属蛋白酶-9(matrix metalloproteinase 9,MMP-9)、兔抗人MMP-2、兔抗人内参β-actin、羊抗兔二抗购自美国Bioworld公司;miR-182 inhibitor由上海生工生物公司合成;CFX96型实时荧光定量仪购自美国BIO-RAD公司;Multiskan FC酶标仪购自美国赛默飞公司;SC-Y408A光学显微镜购自深圳市晨晟光学仪器有限公司。
1.3 细胞培养、转染与分组HTR8/SVneo人早孕期绒毛外滋养细胞株购自中科院细胞库;培养箱温度设为37 ℃、5 % CO2,相对湿度为98 %。将细胞以5×105个/孔的密度接种到6孔板上,待细胞融合率在50 %左右时弃去培养液,用LipofectamineTM2000法进行转染(试剂配制:2 μl LipofectamineTM2000与100 μl转染复合物混合均匀),25 ℃孵育10 min,用Opti-MEM将miR-182 inhibitor、miR-182阴性对照序列(miR-182无关序列)浓度调整为20 μmol/L,25 ℃孵育10 min,将miR-182 inhibitor、等体积培养基、miR-182 inhibitor阴性对照分别与LipofectamineTM2000混合均匀,25 ℃孵育20 min,加入到含有HTR8/SVneo细胞的6孔板中,培养箱培养24 h。实验分组:① 对照组;② 低氧组;③ miR-182 inhibitor组;④ miR-182 inhibitor阴性对照组。除对照组外,其余组都在低氧环境下培养(37 ℃、1% O2、94% N2和5% CO2)
1.4 RT-qPCR检测胎盘中miR-182表达水平使用RNA提取试剂盒提取胎盘中总RNA,反转录得到cDNA,采用实时荧光定量PCR仪对miR-182进行扩增。扩增体系共20.0 μl,其中cDNA(50 ng/ml) 2.0 μl,SYBR Mix10.0 μl,ddH2O 4.0 μl,上下游引物(5 μmol/L)各2.0 μl。反应条件:94 ℃预变性30 s,94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸45 s,扩增35个循环后,72 ℃终末延伸10 min。miR-182及内参U6的引物序列见表1。3个复孔,采用2-ΔΔCt法对miR-182表达水平进行定量分析。
1.5 Western blot测定胎盘中HIF-2α、VEGF表达水平和HTR8/SVneo细胞中HIF-2α、VEGF、E-cadherin、MMP-9、MMP-2表达水平用RIPA法提取各组细胞总蛋白,BCA法测定各组蛋白总含量。50 μg蛋白加入到点样孔中,用凝胶电泳分离目标蛋白,转至PVDF膜上,5 % BSA将结合位点封闭1 h。加入兔抗人HIF-2α、兔抗人VEGF、兔抗人E-cadherin、兔抗人MMP-9、兔抗人MMP-2、兔抗人内参β-actin(1 ∶1 500),孵育24 h,用PBS清洗3次,加入羊抗兔二抗(1 ∶5 000),25 ℃孵育30 min,PBS清洗3次,显色、曝光、观察。

表1 miR-182和内参U6引物序列
1.6 流式细胞仪测定HTR8/SVneo细胞凋亡率将HTR8/SVneo细胞经胰酶消化后转移至10 ml无菌离心管中,在25 ℃离心半径10 cm、1 000 r/min下离心5 min,弃上清液,用预冷的PBS洗涤,之后加入2 ml PBS重悬细胞,按照上述步骤再次离心、洗涤细胞,重悬后用预冷的PBS调整细胞密度为2×107个/ml。用Annexin V-FITC/PI试剂盒标记细胞,流式细胞仪检测细胞凋亡率(激发波长:488 nm,发射波长:525 nm)。
1.7 Transwell侵袭实验测定HTR8/SVneo细胞侵袭能力从-20 ℃冰箱中取出Matrigel,放置在4℃环境中解冻,用无血清培养液将Matrigel稀释到100 μl/ml,以400 μl/cm2的用量涂抹到transwell板的滤膜面上,在培养箱放置4 h,之后在超净台上干燥,将对数生长期的HTR8/SVneo以1×105个/ml密度接种到Transwell上室,下室加入600 μl含血清的培养液,培养至细胞贴壁后更换上下室的培养液,实验分组同1.2项并设置6个复孔,继续培养24 h后,轻轻拭去Matrigel和上室内细胞,固定10 min后,用PBS清洗3次,用结晶紫(0.1 %)染色10 min,用PBS清洗3次。使用显微镜观察拍照,选择6个视野计数,结果取平均值。
1.8 双荧光素酶实验检测miR-182与HIF-2α靶标关系
1.8.1荧光素酶报告实验突变型载体的制备 用TargetScan分析HIF-2α序列3′UTR区域3个miR-182结合区域进行扩增,之后与PGEM-T载体相连,根据测序筛选出的目标序列,用连接酶将其与荧光素酶报告载体pGL4相连,构建p-GL4-HIF-2α-3'UTR质粒,以p-GL4-HIF-2α-3'UTR质粒为模板对HIF-2α-3'UTR进行定点缺失突变(Del1,Del2,Del3),测序筛选,进一步构建p-GL4-HIF-2α-3'UTR-Del、p-GL4-HIF-2α-3'UTR-Del2、p-GL4-HIF-2α-3'UTR-Del3和p-GL4-HIF-2α-3'UTR-Del1,Del2,Del3质粒。
1.8.2荧光素酶测试报告实验 将HTR8/SVneo细胞接种到24孔板上,培养24 h后,将p-GL4-HIF-2α-3'UTR-Del、p-GL4-HIF-2α-3'UTR-Del2、p-GL4-HIF-2α-3'UTR-Del3和p-GL4-HIF-2α-3'UTR-Del1,Del2,Del3质粒与miR-182 inhibitor、miR-182空白对照共转染,设置6个复孔,培养24 h后,每组细胞各加入荧光素酶检测试剂Ⅱ 100 μl,酶标仪测定荧光强度,随后加入Stop&Glo试剂,再次用酶标仪测定荧光强度,以前后荧光强度比值表示荧光素酶的相对活性。

2 结果
2.1 胎盘组织中miR-182、HIF-2α、VEGF表达水平与对照组相比,PE患者胎盘组织中miR-182表达水平降低,HIF-2α、VEGF蛋白表达水平升高(P<0.05),见图1和表2。
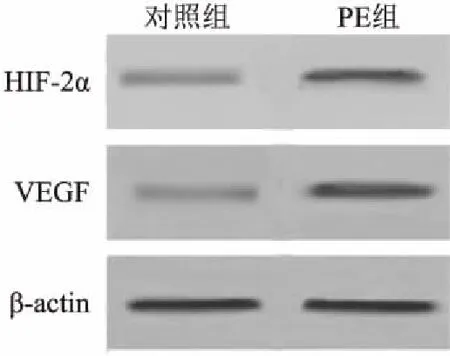
图1 胎盘组织中HIF-2α、VEGF表达水平

表2 胎盘组织中miR-182、HIF-2α、VEGF表达水平
2.2 miR-182 inhibitor转染处理后HTR8/SVneo细胞miR-182、HIF-2α、VEGF表达情况与对照组相比,低氧组miR-182表达水平降低,HIF-2α、VEGF蛋白表达水平升高(P<0.05);与低氧组、miR-182 inhibitor阴性对照组比较,miR-182 inhibitor组miR-182表达水平降低,HIF-2α、VEGF蛋白表达水平升高(P<0.05),见图2和表3。
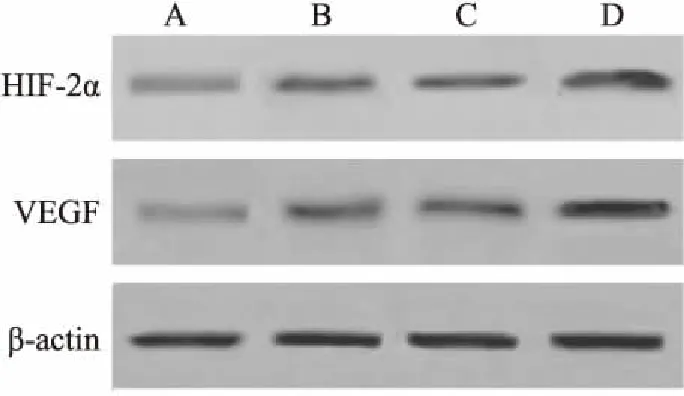
图2 HTR8/SVneo细胞HIF-2α、VEGF蛋白表达情况
A:对照组;B:低氧组;C:miR-182 inhibitor阴性对照组;D:miR-182 inhibitor组
表3 HTR8/SVneo细胞HIF-2α、VEGF蛋白表达情况
与对照组比较:*P<0.05;与低氧组比较:#P<0.05;与miR-182 inhibitor阴性对照组比较:△P<0.05
2.3 miR-182 inhibitor转染处理后HTR8/SVneo细胞凋亡率与对照组相比,低氧组HTR8/SVneo细胞凋亡率升高(P<0.05);与低氧组、miR-182 inhibitor阴性对照组比较,miR-182 inhibitor组细胞凋亡率降低(P<0.05),见图3和表4。

表4 各组HTR8/SVneo细胞凋亡率比较
与对照组比较:*P<0.05;与低氧组比较:#P<0.05;与miR-182 inhibitor阴性对照组比较:△P<0.05
2.4 HTR8/SVneo细胞侵袭能力与对照组相比,低氧组HTR8/SVneo细胞侵袭能力降低(P<0.05);与低氧组、miR-182 inhibitor阴性对照组比较,miR-182 inhibitor组细胞侵袭能力升高(P<0.05),见图4和表5。
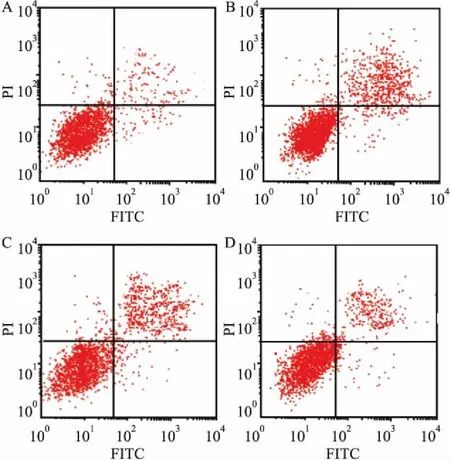
图3 各组HTR8/SVneo细胞凋亡率比较
A:对照组;B:低氧组;C:miR-182 inhibitor阴性对照组;D:miR-182 inhibitor组
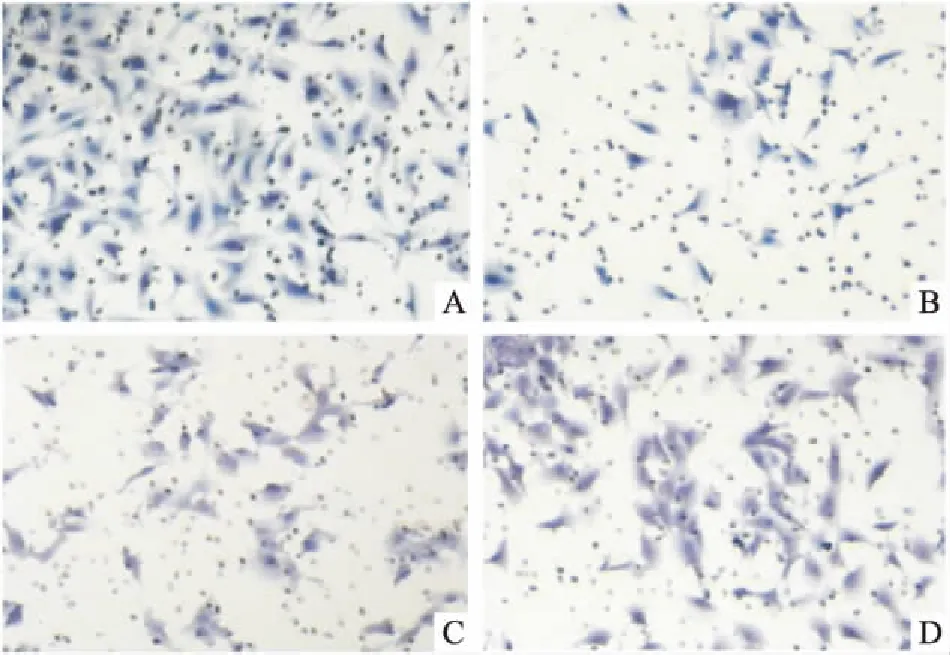
图4 各组HTR8/SVneo细胞侵袭能力
A:对照组;B:低氧组;C:miR-182 inhibitor阴性对照组;D:miR-182 inhibitor组

表5 各组HTR8/SVneo细胞侵袭能力
与对照组比较:*P<0.05;与低氧组比较:#P<0.05;与miR-182 inhibitor阴性对照组比较:△P<0.05
2.5 miR-182 inhibitor转染处理后HTR8/SVneo细胞E-cadherin、MMP-9、MMP-2表达水平与对照组相比,低氧组E-cadherin蛋白表达水平升高,MMP-9、MMP-2蛋白表达水平降低,E-cadherin蛋白表达水平升高(P<0.05)。与低氧组、miR-182 inhibitor阴性对照组比较,miR-182 inhibitor组E-cadherin蛋白表达水平降低,MMP-9、MMP-2蛋白表达水平升高(P<0.05),见图5和表6。
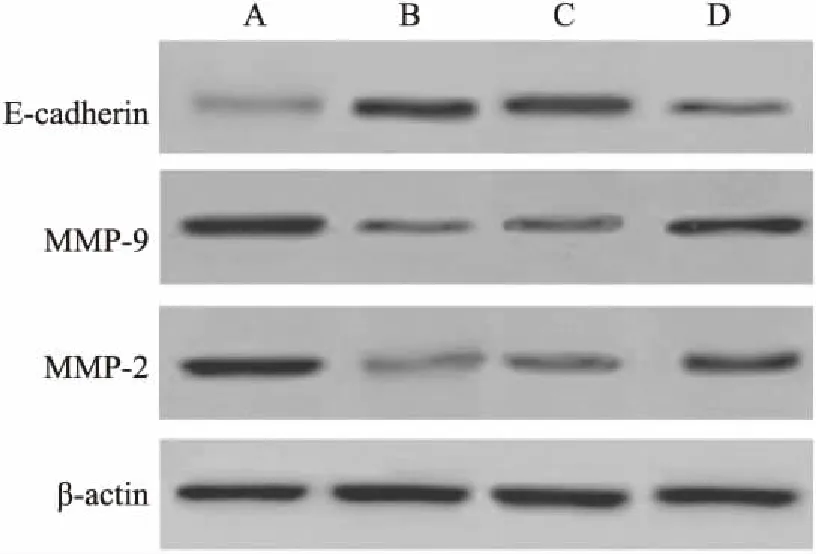
图5 HTR8/SVneo细胞E-cadherin、MMP-9、MMP-2表达水平
A:对照组;B:低氧组;C:miR-182 inhibitor阴性对照组;D:miR-182 inhibitor组

表6 HTR8/SVneo细胞E-cadherin、MMP-9、MMP-2表达水平
与对照组比较:*P<0.05;与低氧组比较:#P<0.05;与miR-182 inhibitor阴性对照组比较:△P<0.05
2.6 miR-182与HIF-2α靶标关系Targetscan分析表明,miR-182序列3'UTR区存在3个HIF-2α结合位点。荧光素酶报告实验显示,与miR-182 inhibitor阴性对照组比较,miR-182 inhibitor野生型HIF-2α组的荧光素酶相对活性降低(P<0.05)。与miR-182 inhibitor野生型HIF-2α组比较,miR-182 inhibitor突变型HIF-2α组的荧光素酶相对活性均升高(P<0.05),见表7。
3 讨论
滋养细胞保持正常的生理功能对保证孕妇形成正常胎盘和维持正常妊娠十分重要,胎盘的形成依赖于滋养细胞的分化和侵袭,该生理过程一般在低氧条件下形成,子宫免疫失调会引起滋养细胞增殖、侵袭能力下降,导致胎盘供血不足,使胎盘低氧,诱发PE,低氧环境又会影响细胞增殖、侵袭能力[7]。因此研究如何增强低氧环境下PE细胞侵袭能力对治疗PE意义重大。

表7 HTR8/SVneo细胞荧光素酶的相对活性
miR-182在调控细胞增殖、侵袭、迁移方面受到广泛关注,研究[8]表明,miR-182能够调控FOXF2基因,促进血管生成,增强三阴性乳腺癌细胞的侵袭能力,提示其可能是引起三阴性乳腺癌转移的因素之一。Wang et al[9]发现miR-182通过调控NSCLC细胞中的HIF-1α表达来促进葡萄糖的代谢和乳酸释放,从而增强NSCLC细胞的增殖能力。本研究显示miR-182在PE孕妇胎盘组织中低表达,提示其可能与PE有关。细胞实验显示,与对照组相比,低氧组HTR8/SVneo细胞凋亡率升高,侵袭力降低,提示低氧可诱导人绒毛外滋养细胞凋亡。经miR-182 inhibitor转染处理后,miR-182 inhibitor组HTR8/SVneo细胞中miR-182表达水平降低,细胞凋亡率降低,提示下调miR-182表达能缓解低氧所致人绒毛外滋养细胞损伤。基质金属蛋白酶(matrix metalloproteinase,MMPs)属于蛋白水解酶家族,能够水解细胞外基质,研究显示MMP-9和MMP-2表达含量与滋养细胞侵袭能力呈正相关,是体现侵袭能力的关键水解酶[10]。E-cadherin广泛分布在细胞上皮表面,在增强细胞间相互作用、维持细胞完整性、胚胎发育方面发挥重要作用[11]。本研究显示,与对照组相比,低氧组HTR8/SVneo细胞侵袭能力、MMP-9蛋白表达水平、MMP-2蛋白表达水平降低,E-cadherin蛋白表达水平升高;与低氧组、miR-182阴性对照组比较,miR-182 inhibitor组细胞侵袭能力、MMP-9蛋白表达水平、MMP-2蛋白表达水升高,E-cadherin蛋白表达水平降低。提示低氧诱导后细胞侵袭能力降低,下调miR-182表达能够增强细胞侵袭能力,但是具体通过调控哪种信号通路还有待进一步研究。
HIF-2α在正常环境或组织中低表达,在病理组织特别是缺血缺氧组织中高表达,发挥保护因子的作用,调控机体适应缺氧环境。王建国 等[12]研究表明,在低氧条件下,HIF-2α能够激活Notch3信号通路,从而上调Snail蛋白表达水平,下调E-cadherin蛋白表达水平,提高MCF-7细胞的侵袭和迁移能力。随后研究发现,HIF-2α能够上调VEGF,进而促进Notch表达来调控高强度聚焦超声残余肝癌新血管的生成[13]。临床研究[14]发现,HIF-2α和VEGF在PE患者胎盘组织中的高表达,提示二者可能通过某种机制参与进程。本研究表明,HIF-2α和VEGF在PE孕妇胎盘组织中高表达,提示PE孕妇胎盘处于缺氧状态,可诱导HIF-2α和VEGF表达上调。进一步分析显示,与对照组相比,低氧组HTR8/SVneo细胞HIF-2α和VEGF表达水平升高;miR-182 inhibitor转染处理后,miR-182 inhibitor组HTR8/SVneo细胞中miR-182水平降低,HIF-2α、VEGF蛋白表达水平升高,可能与促进HTR8/SVneo细胞侵袭有关。TargetScan数据库预测显示miR-182序列3'UTR区存在3个HIF-2α结合位点,双荧光素酶实验证实HIF-2α是miR-182作用靶点,提示miR-182可能通过靶向调控HIF-2α蛋白表达,激活HIF-2α/VEGF信号通路,上调MMP-9、MMP-2表达水平,下调E-cadherin表达水平,促进低氧条件下HTR8/SVneo细胞侵袭能力。
综上所述,miR-182在PE患者胎盘组织中低表达,HIF-2α蛋白高表达,miR-182可能通过激活HIF-2α/VEGF信号通路,增强低氧条件下滋养细胞侵袭能力,推测miR-182有望成为治疗PE的新靶点。但miR-182在子痫前期发生发展进程中表达情况仍需进一步研究。
