肠道菌群与类风湿关节炎寒热证型相关性研究
2020-07-10王海瑜钱唐亮康天伦孙文燕朱跃兰侯秀娟
王海瑜,钱唐亮,康天伦,孙文燕,朱跃兰,侯秀娟
肠道菌群与类风湿关节炎寒热证型相关性研究
王海瑜1,钱唐亮1,康天伦1,孙文燕1,朱跃兰2,侯秀娟2
1.北京中医药大学,北京 100029;2.北京中医药大学东方医院,北京 100078
通过16SrRNA高通量测序技术,研究胶原诱导性关节炎(CIA)寒证与热证大鼠肠道菌群差异。雌性Wistar大鼠30只,按随机数字表法分为正常组8只、寒证组和热证组各11只。正常组常规饲养,寒证组和热证组复制CIA寒热证候动物模型。从造模第2周起,每周测量1次大鼠右后足踝体表温度,造模结束后腹主动脉取血检测凝血因子,取肠道内容物,进行总DNA提取,V3-V4可变区PCR扩增,产物纯化后进行测序,测序的有效数据进行可操作分类单元(OTUs)聚类,根据OTUs进行物种注释、Alpha与Beta多样性分析,得到样品的物种信息。造模第2周时,寒证组、热证组大鼠右足温度较正常组均不同程度升高,3~4周时,与正常组和寒证组比较,热证组大鼠右足温逐渐升高,寒证组大鼠右足温度逐渐降低,第4周时,显著低于正常组和热证组;寒证组纤维蛋白原高于正常组和热证组;测序后得1 213 914条有效序列,聚类后正常组、寒证组及热证组分别获得206、335、304个特征OTUs;正常组、寒证组及热证组间菌群结构差异均有统计学意义(<0.01),正常组优势菌种有拟杆菌门、苏黎世杆菌目、苏黎世杆菌科、梭菌科、莫氏杆菌科、伯克氏菌科,寒证组优势菌种有柔膜菌门、α-变形菌门、巴斯德菌科、根瘤菌目、巴斯德菌目、皮杆菌科、肠球菌科,热证组优势菌种有变形菌门。寒证和热证CIA模型大鼠肠道菌群失调,且寒证与热证之间菌群结构存在差异。
肠道菌群;类风湿关节炎;寒证;热证;16SrRNA测序;大鼠
类风湿关节炎(rheumatoid arthritis,RA)是一种全身性、慢性、自身免疫性疾病,典型临床表现为对称性的关节肿胀、疼痛、晨僵及畸形,基本病理改变为滑膜炎。根据不同症候群可分为不同证型,其中寒证与热证具有代表性和特征性。人体肠道微生物菌群数量是人体基因数量的100倍,所以被称为人体“第二基因库”,这些基因赋予了细菌不同的功能,参与机体免疫调节过程。研究表明,菌群失调可导致RA的发生发展[1-2]。生物信息技术发展促进了肠道菌群的研究,16SrRNA测序技术是最常用的高通量测序依赖的组学技术之一,该技术着眼于对肠道微生物群落菌种组成的分析,可对复杂样品中混合菌种的分类学进行鉴定并精确定量。基于此,本实验借助16SrRNA高通量测序技术获得胶原诱导性关节炎(collagen induced arthritis,CIA)寒热证候大鼠肠道微生物信息,再经数据库比对分析得到功能注释,以期系统探讨CIA寒热证候大鼠肠道的微生物组成,为临床和科研提供参考。
1 材料与方法
1.1 动物及分组
普通级雌性Wistar大鼠30只,体质量(110±10)g,鼠龄6~8周,北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2016-0006。饲养于温度(24±2)℃、相对湿度60%~70%普通动物房。适应性喂养1周后,按随机数字表法分为正常组、寒证组、热证组。
1.2 主要试剂与仪器
牛Ⅱ型胶原(20022,美国Chondrex公司),不完全弗氏佐剂(7002,美国Sigma公司),戊巴比妥钠(北京化学试剂公司),E.Z.N.A.®soil试剂盒(Omega Bio-tek,Norcross,GA,U.S.),Illumina MiSeq平台(San Diego,USA),AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)。QuantiFluor™-ST微型荧光计(Promega,USA),PCR仪(ABI GeneAmp®9700型),高速分散器(S10宁波新芝生物科技股份有限公司),全自动血凝仪(CA-1500日本Sysmex公司),红外线温度检测仪(DT-8550深圳市凯恒捷科技有限公司),电子天平(YP2001N上海精研电子科技有限公司),动物气候箱(SHH-500ZSD重庆永生实验仪器厂)。
1.3 造模
将溶于乙酸的牛Ⅱ型胶原蛋白(浓度2 mg/mL),与等量不完全弗氏佐剂充分混合成1 mg/mL的混合物,并用高速分散器搅拌成“油包水”状,随后于每只大鼠左足皮下注射0.1 mL,尾根部分三点真皮内注射0.1 mL,同时压迫注射部位使乳化物完全吸收。7 d后再次于大鼠尾根部真皮内分三点注射0.1 mL,加强免疫1次[3]。正常组大鼠左足皮下注射0.1 mL生理盐水。CIA寒证及热证模型参考本课题组前期工作基础及文献并进行改良[3-4]。在CIA造模基础上,应用动物气候箱,寒证组设定风速6 mL/s、相对湿度95%、温度6 ℃,热证组设定风速6 mL/s、相对湿度95%、温度33 ℃。从初次免疫后给予风寒湿、风湿热刺激,造模时间持续28 d。正常组不做任何处理,寒证组在造模期间死亡1只大鼠。
1.4 行为学及表征评估
造模期间每周观察大鼠一般状况,每周评估1次关节炎指数(arthritis index,AI)。AI评分标准:0分,无关节红肿;1分,小趾关节肿胀;2分,趾关节及足跖关节肿胀;3分,踝关节以下足爪肿胀;4分,包括踝关节在内的全部足爪肿胀。最高分为16分,AI≥4分定义为模型成功。
1.5 关节体表温度测定
从造模第2周开始,每周1次,使用红外线温度检测仪测量大鼠右后足踝部关节处体表温度,取2次平均值。
1.6 样本采集
造模结束后,将大鼠麻醉、处死,腹主动脉取血,以柠檬酸钠抗凝管采全血5 mL,待测凝血指标。取结肠与直肠的内容物,置于无菌冻存管中,放入液氮速冻,-80 ℃超低温冰箱保存,用于肠道菌群信息分析。
1.7 DNA抽提和PCR扩增
根据E.Z.N.A.®soil试剂盒说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对V3-V4可变区进行PCR扩增。
1.8 Illumina Miseq测序
使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit进行纯化,Tris-HCl洗脱,电泳检测。利用QuantiFluor™-ST微型荧光计进行检测定量。根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2*300的文库,利用Illumina公司的Miseq PE300平台进行测序。
1.9 统计学方法
1.10 生物信息学分析
对测序得到的原始序列进行过滤处理,得到特征序列。使用QIIME2的DADA2方法去噪去嵌合,然后基于有效数据进行可操作分类单元(OTUs)聚类,用Shaanon指数分析物种饱和度,组间群落差异分析(LDA effect size,LEfSe)采用线性判别分析(linear discriminant analysis,LDA)法鉴定组间丰度有差异的细菌,用Shaanon指数、Chao1指数、observed species指数分析物种Alpha多样性,用主坐标分析(PCoA)图结合多元方差(Permanova)分析组间Beta多样性。
2 结果
2.1 一般状况
正常组大鼠活动灵敏,体质量逐渐增加,皮毛光泽,摄食量正常;寒证组大鼠7 d后逐渐出现大便稀,聚团喜暖,饮水量减少,舌质紫黯;热证组大鼠则饮水量偏多,小便黄,烦躁不安,舌质偏红。
2.2 各组右足体表温度比较
造模第2周,寒证组、热证组大鼠右足温度较正常组均不同程度升高(<0.01);第3~4周时,与正常组和寒证组比较,热证组大鼠右足温明显升高(<0.01);寒证组大鼠右足温度逐渐降低,第4周时显著低于正常组和热证组(<0.01)。见表1。
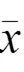
表1 造模后各组大鼠右足体表温度比较(±s,℃)
注:与正常组比较,**<0.01;与寒证组比较,△△<0.01
2.3 各组凝血指标比较
寒证组纤维蛋白原浓度显著高于正常组和热证组(<0.01)。见表2。
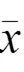
表2 各组大鼠凝血指标比较(±s)
注:与正常组比较,**<0.01;与寒证组比较,△△<0.01
2.4 测序质量评估及物种注释分析结果
测序数据经barcode拆分后,总共获得1 213 914条有效序列,有效序列范围为31 986~53 445条,平均为41 859条。由Shaanon指数和observed species指数可看出,各组大鼠肠道菌群多样性指数均大于2,实际OTUs数目均大于200,且稀释曲线趋于平缓,表明测序结果可反映当前样本所包含的多样性,继续增加测序深度已无法检测到大量的尚未发现的新OTUs。见图1、图2。

图1 各组样本shannon稀释性曲线图

图2 各组样本observed species稀释性曲线图
通过3组样本聚类得到的OTUs差异韦恩图可以看出,3组共有343个相同OTUs,正常组有206个特征OTUs,寒证组有335个特征OTUs,热证组304个特征OTUs。见图3。

图3 各组样本聚类差异韦恩图
2.5 大鼠肠道菌群组成结构分析结果
统计各组门水平与科水平丰度排名前20的物种,并绘制柱状图。门水平各组优势菌门均为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形杆菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、软壁菌门(Tenericutes)、蓝澡菌门(Cyanobacteria)、螺旋体菌门(TM7)、未明确细菌(Unspecified_Bacteria)、未经分类细菌(unclassified)等。其中厚壁菌门所占比例最大(73.64%),见图4。科水平菌落结构依次为未具体分类_梭菌(Unspecified_Clostridiales)、瘤胃菌科(Ruminococcaceae)、未具体分类_拟杆菌目(Unspecified_Bacteroidales)、乳杆菌科(Lactobacillaceae)等,见图5。
2.6 组间差异物种筛选
用LEfSe法寻找每个分组特征微生物(LDA>2为差异有统计学意义)。柱状图长度代表每组物种对差异效果影响的大小。门水平正常组优势菌种为拟杆菌门(firmicutes),寒证组优势菌种为柔膜菌门(Tenericutes),见图6。科水平正常组优势菌种有苏黎世杆菌目(Turicibacterales)、苏黎世杆菌科(Turicibacteraceae)、梭菌科(Clostridiaceae)、莫氏杆菌科(Mogibacteriaceae)、伯克氏菌科(Burkholderiaceae),寒证组优势菌种为α-变形菌门(Alphaproteobacteria)、巴斯德菌科(Pasteurellaceae)、根瘤菌目(Rhizobiales)、巴斯德菌目(Pasteurellales)、皮杆菌科(Dermabacteraceae)、肠球菌科(Enterococcaceae)。热证组优势菌种为变形菌门(Proteobacteria),见图7。

图4 基于门水平各组大鼠肠道微生物群落结构
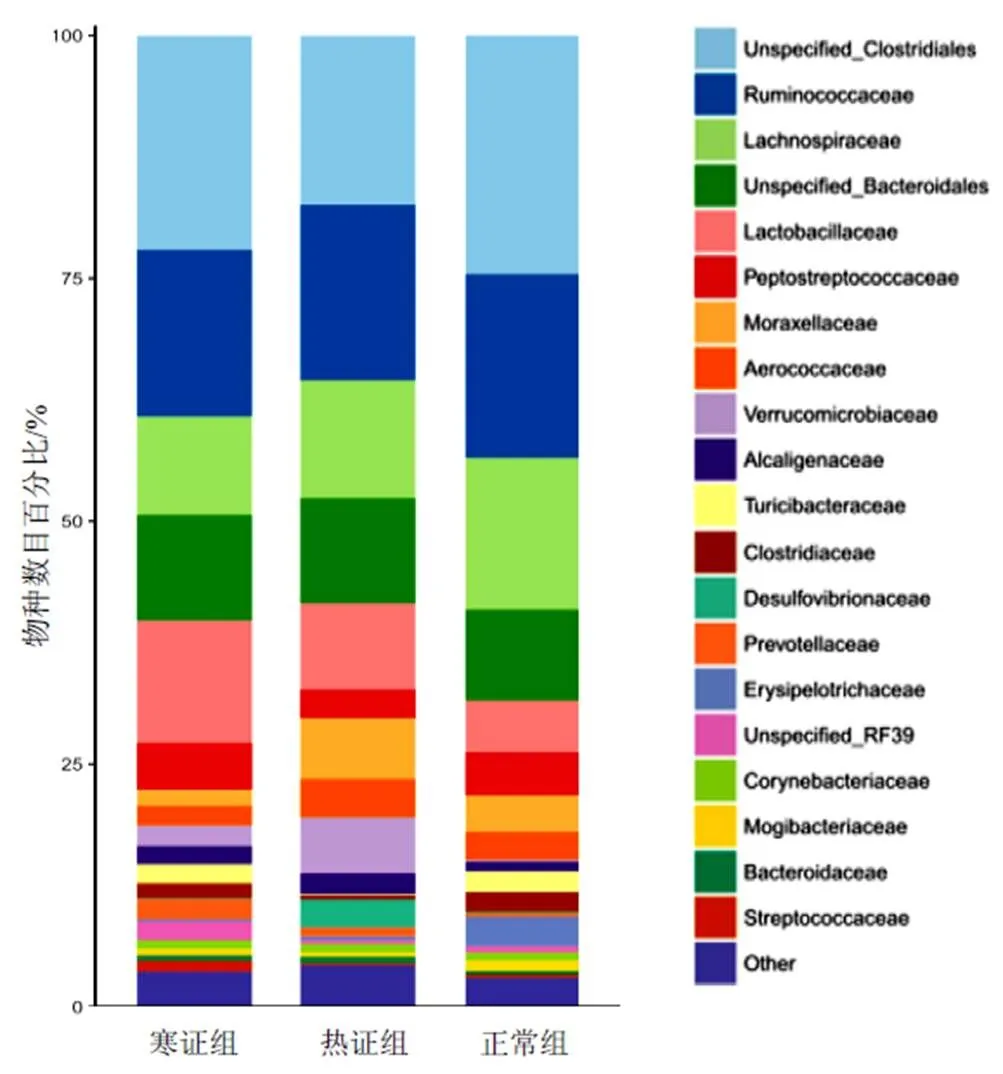
图5 基于科水平各组大鼠肠道微生物群落结构
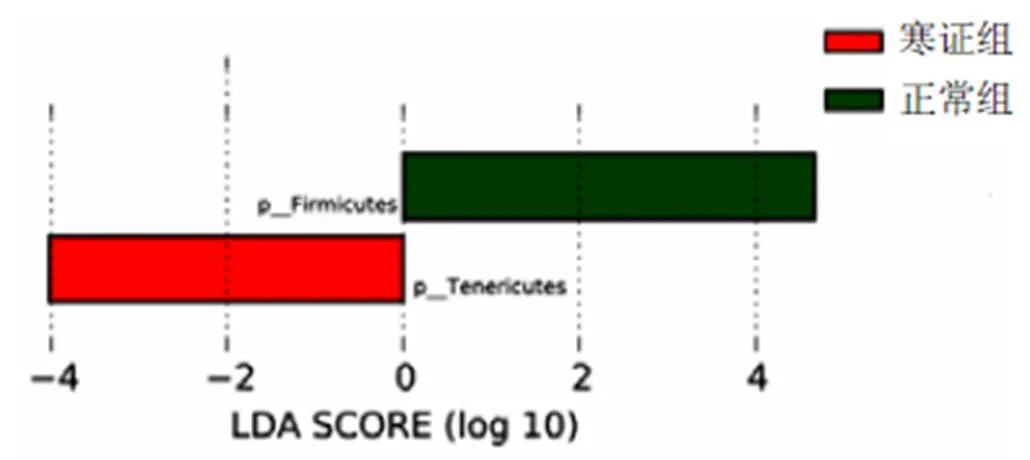
图6 LEfSe分析门水平LDA柱形图

图7 LEfSe分析科水平LDA柱形图
2.7 各组大鼠肠道菌群多样性分析
Alpha多样性主要用来分析单个样品菌群的种类数量(即丰富度)与分配上的均匀度(即多样性)。其中Chao1、observed species指数代表菌群的丰富度(species richness),其值越高表示该样本菌群丰富度越高,Shannon指数代表菌群的多样性,数值越高表示菌群多样性越高。结果显示,各组大鼠肠道菌群多样性与丰富度未见明显差异(>0.05),见表3。进一步分析3组间群落Beta多样性指数,PCoA结合Permanova显示,寒证组与热证组、寒证组与正常组、热证组与正常组之间差异均有统计学意义(<0.01),见图8。
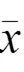
表3 各组大鼠肠道菌群Alpha多样性指数比较(±s)
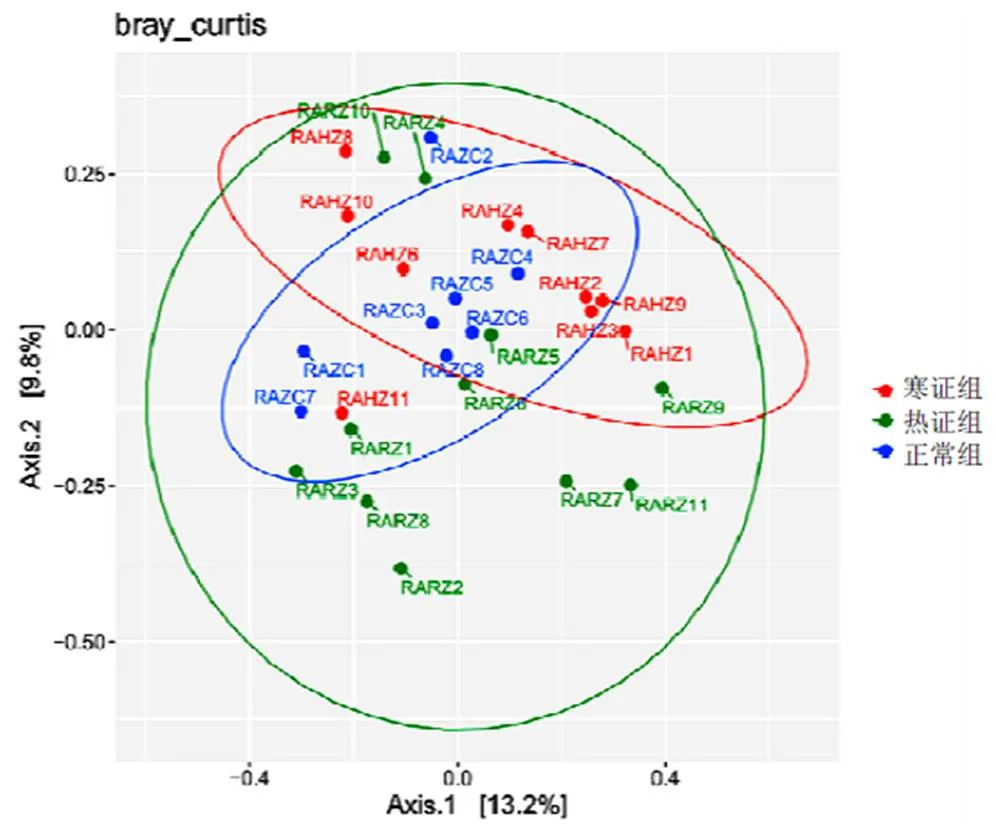
图8 各组大鼠肠道菌群PCoA分析图
3 讨论
RA证候分型尚无统一标准。寒热作为八纲辨证中的两纲,是对阴阳两纲的直接反映,贯穿RA的整个疾病过程[5]。因此,从肠道微生态角度探讨RA寒证与热证的生物学内涵具有重要的临床意义。
造模第2周时,寒证组、热证组右足温度较正常组均不同程度升高;3~4周时,与正常组和寒证组比较,热证组大鼠右足温逐渐升高;寒证组大鼠右足温度逐渐降低,4周时显著低于正常组和热证组。说明寒证组在造模初期接受风寒湿刺激时间较短,关节红肿热痛,肤温升高,在风寒湿外界因素的持续刺激下,出现由热转寒的证候变化,寒证模型趋于稳定。热证组在风湿热的刺激下,关节红肿热痛日益加重,足踝温度亦逐渐升高。凝血指标方面,纤维蛋白原参与血栓的形成,可促进血液凝固,寒证组纤维蛋白原升高提示风寒湿持续刺激下导致“寒凝血瘀”,血液黏度增加。结合造模期间寒证组出现大便稀,聚团喜暖、饮水量减少、舌质紫黯,热证组大鼠则饮水量量偏多、小便黄、烦躁不安,舌质偏红,表明本实验所复制寒、热两组大鼠模型能满足RA病证结合动物模型的要求。
本研究通过16SrRNA测序技术分析CIA寒证、热证及正常组大鼠的菌群构成,结果显示3组Alpha多样性组内菌群数量与丰度无显著差异。但通过PCoA结合Permanova分析3组间Beta多样性时,发现正常组、寒证组、热证组之间菌群存在明显差异。说明CIA寒、热证大鼠与正常大鼠之间群落结构明显不同,CIA寒、热证之间微生物群落亦存在差异。
基于门水平、科水平进一步通过LEfSe法寻找组间差异菌种,结果表明,正常组大鼠肠道菌群优势菌种为拟杆菌门、苏黎世杆菌目、苏黎世杆菌科、梭菌科、莫氏杆菌科、伯克氏菌科,其中有益菌及中性菌拟杆菌门、苏黎世杆菌目、苏黎世杆菌科、梭菌科丰度占明显优势。与正常组比较,热证组优势菌种有变形菌门,寒证组优势菌种有柔膜菌门、α-变形菌门、根瘤菌目、巴斯德菌目、巴斯德菌科、皮杆菌科、肠球菌科。其中α-变形菌门、根瘤菌目、巴斯德菌目、巴斯德菌科均可归类为变形菌门,由此可知变形菌门可能参与RA的慢性炎性过程。变形菌门中包含很多致病菌与条件致病菌,变形菌门的增加与很多疾病密切相关[6]。此外,寒证组优势菌种为柔膜菌门、肠球菌科及皮杆菌科。Peng等[7]研究发现,柔膜菌门参与了RA的病理过程,但与正常组比较,CIA大鼠柔膜菌门丰度减低,与本研究显示寒证组柔膜菌门丰度增加存在差异,可能与风寒湿持续刺激改变肠道菌群结构有关。肠球菌属厚壁菌门,广泛分布于人和动物消化道,肠球菌具有双重作用,正常情况对人体有益,一旦增殖失控,就会引发多种疾病,或影响免疫系统。谭迪[8]将从RA患者肠道中分离出的特征性细菌给予CIA大鼠灌胃,3个月后发现屎肠球菌灌胃大鼠关节发生变形,甚至出现行走障碍,由此认为屎肠球菌可进一步诱导RA发生。皮杆菌科与RA的关系迄今未见报道。皮杆菌科属放线菌门,RA患者肠道菌群多样性降低,但放线菌门却增加,有学者发现放线菌门中Collinsella、Eggerthella及Faecalibacterium可作为区分RA患者与对照组的肠道菌群,同时Collinsella可改变肠道通透性和IL-17A的产生,与疾病的严重程度密切相关[9]。因此,皮杆菌科作为放线菌门的菌种之一,可能在RA发生发展过程中扮演重要角色。大量临床研究表明,普氏菌可能为RA的优势菌种[10-12]。但本研究未发现普氏菌参与CIA寒热证候大鼠的慢性病理过程,可能因肠道菌群的改变在不同种属间存在差异有关。
综上,CIA寒证组、热证组大鼠较正常组肠道菌群存在明显失调现象,且寒证组与热证组之间菌群结构亦存在差异,寒证组变形菌门的菌种更加丰富,且较热证组增加柔膜菌门、皮杆菌科和肠球菌科。将RA中医证候与肠道菌群贯通起来研究,有助于深化对中医证候内涵的理解。但肠道菌群如何影响免疫系统,进而引起局部或全身免疫反应,还需进一步研究证实。此外,中医药治疗RA有其独特优势,药物有效成分进入肠道后对失调菌群的调节可能是其发挥作用的重要环节,基于肠道菌群探讨中医药防治RA作用机制将是我们下一步的研究重点。
[1] ZHANG X, ZHANG D, JIA H, et al. The oral and gut microbiomes are perturbed in rheumatoid arthritis and partly normalized after treatment[J]. Nature Medicine,2015,21(8):895-905.
[2] 陈梦妮,于泓,余丽梅.肠道菌群失调对类风湿关节炎发生发展的影响及机制研究[J].现代医学,2019,47(2):195-198.
[3] 马俊福,侯秀娟,刘小平,等.类风湿关节炎寒证动物模型的建立与评价[J].中华中医药杂志,2016,31(5):1967-1970.
[4] 孙艳群.乌头汤抗类风湿性关节炎作用及机制探索[D].北京:中国中医科学院,2012.
[5] 陈光耀,李杰,周丽,等.类风湿关节炎寒热症候患者临床特征分析[J].中日友好医院学报,2019,33(4):212-214,222.
[6] RIZZATTI G, LOPETUSO L R, GIBIINO G, et al. Proteobacteria: a common factor in human diseases[J]. Biomed Res Int,2017,2017:1-7.
[7] PENG J, LU X R, XIE K L, et al. Dynamic alterations in the gut microbiota of collagen-induced arthritis rats following the prolonged administration of total glucosides of paeony[J]. Front Cell Infect Microbiol,2019,9:204.
[8] 谭迪.类风湿关节炎患者肠道菌群分析及致病菌筛选[D].大连:大连医科大学,2018.
[9] CHEN J, WRIGHT K, DAVIS J M, et al. An expansion of rare lineage intestinal microbes characterizes rheumatoid arthritis[J]. Genome Med,2016,8(1):1-14.
[10] SCHER J U, ANDREW S, LONGMAN R S, et al. Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis[J]. eLife,2013,2:e01202.
[11] MAEDA Y, KURAKAWA T, UMEMOTO E, et al. Dysbiosis contributes to arthritis development via activation of autoreactive T cells in the intestine[J]. Arthritis Rheumatol,2016,68(11):2646-2661.
[12] PIANTA A, ARVIKAR S, STRLE K, et al. Evidence of the immune relevance of prevotella copri, a gut microbe, in patients with rheumatoid arthritis[J]. Arthritis Rheumatol,2017,69(5):964- 975.
Study on Correlation Between Intestinal Flora and Rheumatoid Arthritis with Cold-heat Syndromes
WANG Haiyu1, QIAN Tangliang1, KANG Tianlun1, SUN Wenyan1, ZHU Yuelan2, HOU Xiujuan2
To study the difference of intestinal flora between collagen-induced arthritis (CIA) cold-heat syndromes rats by 16SrRNA high-throughput sequencing technology.Totally30 female Wistar rats were divided into normal group (=8), cold syndrome group (=11) and heat syndrome group (=11) according to random number table method. The normal group was routinely raised. The cold and heat syndrome groups were duplicated with CIA cold and heat syndrome. From the second week of modeling, the body surface temperature of the right ankle of rats was measured once a week. After the end of modeling, the abdominal aorta was taken to detect the coagulation factor. The intestinal contents were taken; the total DNA was extracted; the V3-V4 variable region was amplified by PCR; the products were purified and tested; the sequenced valid data were classified into operational taxonomic units (OTUs); species annotation, Alpha and Beta diversity analysis were performed according to OTUs to obtain the species information of the samples.At the second week of modeling, the temperature of right ankle in cold syndrome group and heat syndrome group was higher than that in normal group. At 3–4weeks, compared with normal group and cold syndrome group, the temperature of right ankle in heat syndrome group increased gradually. The temperature of right ankle in cold syndrome group decreased gradually, and at the 4th week, it was significantly lower than that in normal group and heat syndrome group. Fib in cold syndrome group was higher than that in normal group and heat syndrome group. After sequencing, a total of 1 213 914 effective sequences were obtained. After clustering, 206 characteristic OTUs were obtained in the normal group, 335 were obtained in the cold syndrome group, and 304 were obtained in the heat syndrome group. There was statistical significance in flora structure among normal group, cold syndrome group and heat syndrome group (<0.01). The dominant strains in the normal group were firmicutes, Turicibacterales, Turicibacteraceae, Clostridiaceae, Mogibacteriaceae, and Burkholderiaceae; The dominant strains of cold syndrome group included Tenericutes, Alphaproteobacteria, Pasteurellaceae, Rhizobiales, Pasteurellales, Dermabacteraceae, and Enterococcaceae; The dominant strains in heat syndrome was Proteobacteria.The intestinal flora of the CIA cold syndrome and the heat syndrome is dysregulated, and there are differences in bacterial structure between the cold and heat syndrome.
intestinal flora; rheumatoid arthritis; cold syndrome; heat syndrome; 16SrRNA sequencing; rats

R285.5
A
1005-5304(2020)06-0044-06
10.3969/j.issn.1005-5304.201910175
国家自然科学基金(81774275);北京中医药大学东方医院1166人才培养计划(040204001001002006)
侯秀娟,E-mail:houxiujuan2008@163.com
(2019-10-14)
(2019-11-19;编辑:华强)
