携hVEGF165表达载体阳离子脂质微泡的制备
2020-07-08伍巧玲丁云川冉海涛王志刚王庆慧
伍巧玲,丁云川,冉海涛,王志刚,陈 剑,王庆慧,张 键
(1.昆明医科大学;2.昆明市延安医院 超声医学科,云南 昆明 650051;3.重庆医科大学超声影像学研究所 重庆 400010)
目前基因治疗用于临床实验研究越来越多,而输送基因入体内的方法较多,但都存在一定的缺陷,如在输送途中基因被降解,基因不稳定,输送载体可能会引起免疫反应等。将超声造影技术与基因治疗结合起来,能显著提升基因的转染效率[1],充分发挥治疗疾病的作用。超声造影剂可作为一种安全有效的基因载体,靶向精准治疗,延长了造影剂在病区滞留时间,特异性增强了显影效果,在诊断疾病的同时,又能击破造影剂精准释放基因,促使基因进入细胞内转染,有着广阔的临床应用前景。
阳离子脂质微泡造影剂通过电荷孵育法与带负电荷的基因相连输入体内,实时观察造影剂的显影途径,使用低强度聚焦超声技术靶向辐照击破微泡,释放基因,并促使其转染,较高的提高了基因转染效率[2-4]。
资料与方法
一、药品和试剂 二棕榈酰磷脂酰胆碱、氨基甲酰基胆固醇,二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000,全氟丙烷气体,PBS缓冲液,甘油。
二、仪器 Malvern激光粒径、电位测量仪;银汞胶囊调合器;投射式电子显微镜;光学显微镜、倒置荧光显微镜;紫外线分光光度计;电子天平;微量加样枪;血球计数板。
三、实验方法 1.阳离子脂质微泡的制备:将一定比例的二棕榈酰磷脂酰胆碱、氨基甲酰基胆固醇、二硬脂酰基磷脂酰乙醇胺- 聚乙二醇2000、甘油、PBS、三氯甲烷、全氟丙烷等经旋转蒸发、机械振荡,制备出阳离子脂质微泡。
2.测定阳离子脂质微泡的理化特性:光镜和电镜下分别观察微泡形态、浓度及分布;使用血球计数板测定其浓度;使用Malvern激光粒径、电位测量仪测定其粒径大小、Zeta电位。
3.测定阳离子脂质微泡与hVEGF165表达载体的结合率:将一定同浓度的微泡与不同量的hVEGF165表达载体通过电荷孵育法结合,待微泡出现分层后,上层为微泡与基因结合层,下层为未与微泡结合的游离基因液体,取下层清亮液体,用紫外线分光光度计测量游离的基因浓度,将基因总量减去剩余游离的基因量,除以基因总量,所得微泡结合基因的结合率。
分别将微泡使用Dio 染色成绿色荧光,hVEGF165表达载体使用Gel染色成红色荧光。使用电荷孵育法,将微泡与hVEGF165表达载体结合,在倒置荧光显微镜下观察两者的结合情况。
结果
一、制备的阳离子脂质微泡 肉眼观察:微泡呈现乳白色的混悬液,见图1。400倍光学显微镜观察:微泡呈圆球形,大小形态相对均一,分散情况良好,无明显聚集现象,见图2。透射电子显微镜放大不同倍数观察:较清晰显示外层包裹的磷脂材料薄膜以及内部的全氟丙烷,表面尚光滑,见图3。
二、微泡粒径、电荷及浓度 微泡制备后1h,1d,7d,2W和4W,分别用马尔文纳米粒度Zeta 分析仪检测平均粒径和表面电位,用血球计数板计数浓度,见表1,图4、5。
三、微泡与基因结合率 将染色后的微泡与质粒连接后,置于倒置荧光显微镜下观察,绿色激发光激发后,可见微泡呈现绿色荧光,红色激发光激发后,在微泡表面呈红色荧光包绕,表明染有红色荧光的质粒与染有绿色荧光的微泡连接成功,见图6、7。
四、紫外线分光光度计检测结果 将不同基因量与一定的同浓度微泡通过电荷孵育法连接,微泡随着基因量的增加,基因连接率增加,在基因为40μg 时,结合率为(35.34±0.71)%,结合率达到最高,之后随着基因量的增加,结合率出现降低,见表2。
讨论
脂质体曾经一直是携带基因治疗载体的研究热点,由于脂质体的成分与细胞的脂质成分相同,所以有较高的生物相容性,利于细胞的内吞,所携带的基因容易进入细胞内转染。基因带负电荷,则阳离子脂质体基因载体随之被研究,其表面所携带的正电荷与带负电荷的基因,通过电荷孵育法而吸附到一起,从而有一定的携带基因能力[5,6]。阳离子脂质微泡造影剂是脂质体的一种特殊类型,联合超声造影剂的优点,在超声技术条件下,观察造影剂的显影途径,造影剂聚集在靶器官区域时,使用低强度聚焦超声技术靶向辐照击破阳离子微泡,释放基因,利用超声波辐照所产生的空化效应及声孔效应,使得基因进入细胞内或细胞核而发生转染,较高的提高了基因转染效率[4]。
本实验使用机械振荡法制备出以阳离子胆固醇为核心的阳离子脂质微泡,平均粒径:(1.31±0.23)μm,表面电荷:(28.00±1.84)mV,浓度:(3.17±0.16)×108,微泡的粒径大小合适,浓度及Zeta电位相对较稳定。电子显微镜投射及光镜下观察两种脂质微泡形态稳定,大小均一,分布均匀。使用电荷孵育法与携带表达hVEGF165的质粒相结合,通过倒置荧光显微镜观察微泡与基因结合情况,使用紫外线分光光度计计算基因与微泡的结合率。倒置荧光显微镜从定性角度检测微泡是否与基因连接成功,而紫外线分光光度计从定量角度测量的微泡基因携带率,阳离子脂质微泡最大结合率约(35.34±0.71)%,与普通脂质微泡相比,阳离子微泡具有较高的携带基因的能力,以上结果与之前文献报道相似[7,8]。张清凤等[9]使用脂质材料通过薄膜水化法,制作出了阳离子脂质微泡,最高的载基因率为39.7%。传统普通脂质微泡携带基因量低,转染率不高,但由于基因转染过程中无毒和无毒副作用,联合超声技术,可实现靶向区域转染基因的特点,曾受到广大学着的关注,提高其基因携带能力也一直是研究热点。随着阳离子脂质微泡的产生,普通脂质微泡携带基因能力低的问题得到了解决,多篇文献报道,阳离子脂质微泡造影剂携带基因的转染率有了大幅度的提高,是普通微泡造影剂的20倍[10],阳离子脂质微泡造影剂携带基因体内转染有较突出的优势。
表1 微泡平均粒径、表面电荷及平均浓度(±s)
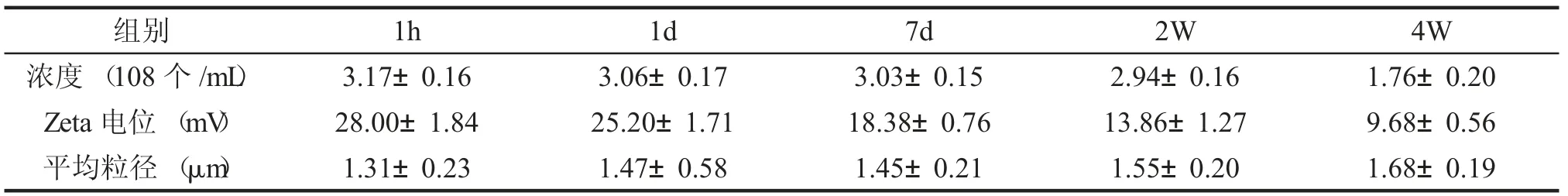
表1 微泡平均粒径、表面电荷及平均浓度(±s)
注:h为小时,d为天,W为周,不同时间检测各值间的比较。
组别浓度(108 个/mL)7d 3.03±0.15 Zeta 电位(mV)28.00±1.84 25.20±1.71 18.38±0.76平均粒径(μm)1.31±0.23 1.47±0.58 1.45±0.21 1h 3.17±0.16 1d 3.06±0.17 2W 2.94±0.16 13.86±1.27 1.55±0.20 4W 1.76±0.20 9.68±0.56 1.68±0.19
表2 微泡与不同基因浓度时基因结合率%比较(±s)

表2 微泡与不同基因浓度时基因结合率%比较(±s)
注:微泡制作后,2h内完成测量各数据。
基因量(μ)20 40 60结合率(%)17.12±.30 35.34±.71 28.42±1.07 80 29.00±1.70

图1 微泡实物图

图2 微泡光镜图

图3 微泡电镜图

图4 微泡平均粒径

图5 表面电位

图6 绿色荧光示微泡

图7 红色荧光示质粒附着微泡
本实验存在不足之处,所制备出的微泡未能制作成干粉状态,只能以液体形式存在,长期保存可能会影响微泡粒径大小、浓度及Zeta电位。另外所制备的携hVEGF165表达载体阳离子脂质微泡未能进行动物实验,其转染率需进一步验证。
