制备RGDS/rt-PA双负载靶向微泡并初步评价其靶向性溶栓效果
2018-08-21王晓妤穆玉明麦培培黄伟良关丽娜
王晓妤,穆玉明,麦培培,史 琪,狄 敏,黄伟良,关丽娜
(新疆医科大学第一附属医院心脏超声诊断科,新疆 乌鲁木齐 830011)
超声联合靶向微泡和药物溶栓治疗是目前的研究热点,其中将靶向配体或溶栓药物与微泡进行单负载结合的研究[1-3]较多,而将靶向配体和药物同时与微泡结合,从而制备具有血栓靶向且携带药物的双负载靶向超声微泡者较少。本研究拟应用生物素—亲和素系统(biotin-avidin system, BAS)桥接法将血栓靶向配体[精氨酸-甘氨酸-天冬氨酸-丝氨酸片段(Arg-Gly-Asp-Ser segments, RGDS)]及重组织纤溶酶原激活物(rt-PA)与超声微泡进行连接,制备RGDS/rt-PA双负载靶向微泡,分析其物理特性、药物负载量、声学显像特征及其对富血小板血栓(platelet-rich thrombus, PRT)的靶向性和溶栓作用。
1 材料与方法
1.1 制备微泡造影剂
1.1.1 制备RGDS、rt-PA单负载微泡 对rt-PA(BOC Sciences)和RGDS(上海子起生物科技有限公司特约合成)进行生物素化(Thermo)及荧光标记,以异硫氰酸荧光素(FITC)标记rt-PA,产物呈黄绿色荧光;以5-羧基四甲基罗丹明(5-TAMRA)标记RGDS,产物呈橙红色荧光。将RGDS及rt-PA分为5个剂量单位(1.25、0.25、0.125、0.062 5、0.031 25 mg),分别与200 μl Targestar-SA超声微泡(Targesom)混匀,避光常温孵育0.5 h后,采用浮选法重复洗涤2次[4]。然后对配制好的标本进行理化性质等检测压片,置于荧光正置显微镜(Olympus BX53)下观察标记情况,以流式细胞仪(BD)检测表达荧光微泡占总微泡的比例,分析微泡与配体的结合率,获得单负载微泡的最佳结合剂量。
1.1.2 制备RGDS/rt-PA双负载靶向微泡 将RGDS及rt-PA以单负载最佳结合剂量连接在微泡上,制成双负载微泡,配体加入顺序分为3种:①先加RGDS,再加rt-PA;②先加rt-PA,再加RGDS;③将RGDS及rt-PA混匀后加入。洗涤后分别置于荧光显微镜下观察,并计算加入顺序不同配体与微泡的双负载结合率。
1.2 检测微泡的物理特性 分别取裸微泡、单负载及双负载微泡的少量混悬液静置后观察外观。采用Multisizer 4e颗粒分析仪(Beckman Coulter)测定粒径及浓度,并以精密pH计测定pH值。采用光学显微镜观察不同微泡的形态、结构、大小及分布情况。将RGDS/rt-PA双负载靶向微泡(50 μl)滴于载玻片上,涂抹均匀,自然风干后进行喷金处理,以扫描电镜(加速电压10 kV、工作距离9.5 mm;JEOL JSM-6390LV)观察图像,并以荧光显微镜(激发波长490、529 nm)观察双负载靶向微泡中RGDS及rt-PA荧光标记情况。
1.3 测定药物负载量 将RGDS/rt-PA双负载靶向微泡200 μl置于3 ml磷酸盐缓冲液(PBS)中漂洗,采用低温离心机(Thermo)以1 500 r/min,离心3 min,取20 μl上层微泡,经超声裂解去除微泡(辐照条件:超声频率1.5 MHz、发射功率2 W、辐照时间15 s)作为待测样品,应用BAC蛋白浓度测定试剂盒(Biosharp)测定样品中rt-PA的含量[5]。
1.4 制备PRT血栓 抽取10名健康献血者(1周内无用药史)的静脉血,每名8~10 ml,以低温离心机在180 G重力作用下离心10 min。取3.5 ml上清液及0.5 ml富含血小板的边界层,混匀后注入EP管中。依次加入腺苷二磷酸(ADP,80 μmol/L)、氯化钙(CaCl2,80 mmol/L)、凝血酶(0.5 IU/ml)后,置于37.8℃恒温箱中孵育40 min[6]。本研究经我院伦理委员会批准,所有献血者均知情同意。
1.5 声学显像特征及溶栓能力 以注入PBS及PRT血栓的医用硅胶管为血管血栓模型。采用Philips iE33超声诊断仪,S5-1探头,频率2 MHz,机械指数1.0,以间歇辐照模式(辐照5 s,间歇10 s)作用 30 min。注入200 μl RGDS/rt-PA双负载靶向微泡,观察其超声成像效果;超声辐照30 min后以PBS液冲管处理,继续观察溶栓后血栓的声像图特征。以扫描电镜观察血栓标本结构变化,并制作冰冻切片,以荧光显微镜(激发波长490、529 nm)观察血栓内部RGDS与rt-PA的荧光标记情况。
表1 不同微泡间物理特性比较(±s)
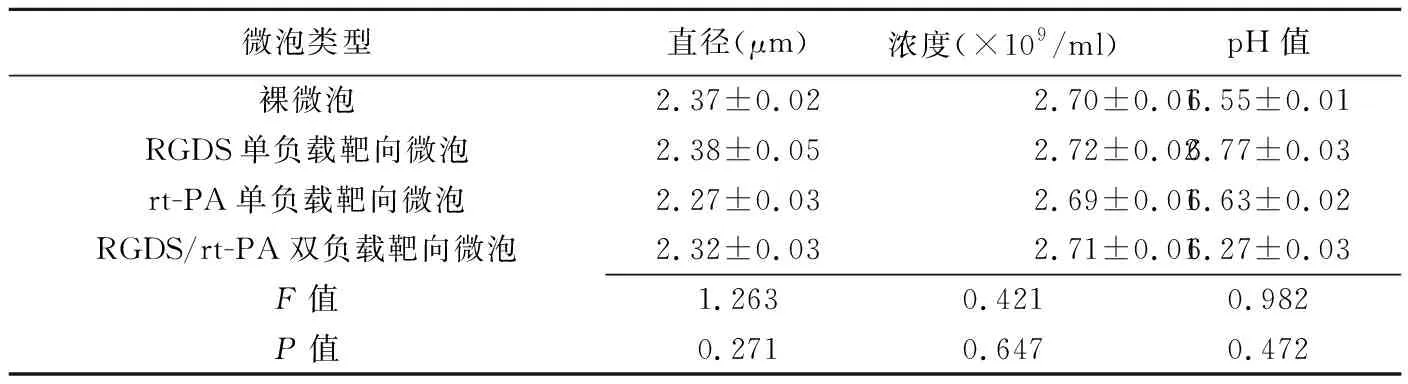
表1 不同微泡间物理特性比较(±s)
微泡类型直径(μm)浓度(×109/ml)pH值裸微泡2.37±0.022.70±0.016.55±0.01RGDS单负载靶向微泡2.38±0.052.72±0.026.77±0.03rt-PA单负载靶向微泡2.27±0.032.69±0.016.63±0.02RGDS/rt-PA双负载靶向微泡2.32±0.032.71±0.016.27±0.03F值1.2630.4210.982P值0.2710.6470.472
表2 不同剂量梯度的配体与微泡的单负载结合率比较(±s)

表2 不同剂量梯度的配体与微泡的单负载结合率比较(±s)
剂量(mg)RGDS(%)rt-PA(%)F值P值0.031 2584.33±0.6876.06±1.8254.1410.0020.062 592.33±1.47*82.36±1.82*70.2560.0010.12587.30±1.37*#76.06±1.42*#72.6140.0010.2586.86±3.53*#△74.32±1.61*#△20.1120.0111.2585.13±3.02*#△▲71.48±2.01*#△▲42.3960.003F值5.53214.478--P值0.0130.001-- 注:*:与同一配体0.031 25 mg相比,P<0.04;#:与同一配体0.062 5 mg相比,P<0.02;△:与同一配体0.125 mg相比,P<0.03;▲:与同一配体0.25 mg相比,P<0.04
1.6 统计学分析 采用SPSS 21.0统计分析软件。计量资料以±s表示。采用单因素方差分析比较裸微泡、单负载及双负载微泡的物理特性、不同剂量梯度下同一配体与微泡的单负载结合率、同一剂量梯度下不同配体与微泡的单负载结合率、加入顺序不同的配体与微泡的双负载结合率,两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结果
2.1 物理特性 不同微泡外观均为乳白色微浑液体,静置后分层,上层为白色微泡,下层为澄清透明液体。光学显微镜下裸微泡、单负载靶向微泡及双负载靶向微泡的形态无明显区别(图1A),均为光整、细小的圆形结构,环形外壳包绕中央半透亮区,大小均匀,无聚集现象。扫描电镜下RGDS/rt-PA双负载靶向微泡呈球形结构,略有聚集现象(图1B)。不同微泡的直径、
浓度及pH值差异均无统计学意义(P均>0.05,表1)。RGDS/rt-PA双负载靶向微泡表面可激发出rt-PA及RGDS的指环状荧光标记,荧光染色均匀(图1C、1D)。RGDS/rt-PA双负载靶向微泡(激发波长570 nm处)吸光度平均值为0.188,RGDS/rt-PA微泡中rt-PA相对蛋白浓度为498.52 μg/ml。
2.2 结合率 不同剂量梯度下rt-PA、RGDS与微泡的单负载结合率差异均有统计学意义(P均<0.05),且同一配体不同剂量间两两比较差异均有统计学意义(P均<0.05)。同一剂量梯度下rt-PA与微泡单负载的结合率均低于RGDS(P均<0.05)。RGDS及rt-PA均为0.062 5 mg时,分别与200 μl Targestar-SA超声微泡的结合率最高(表2)。
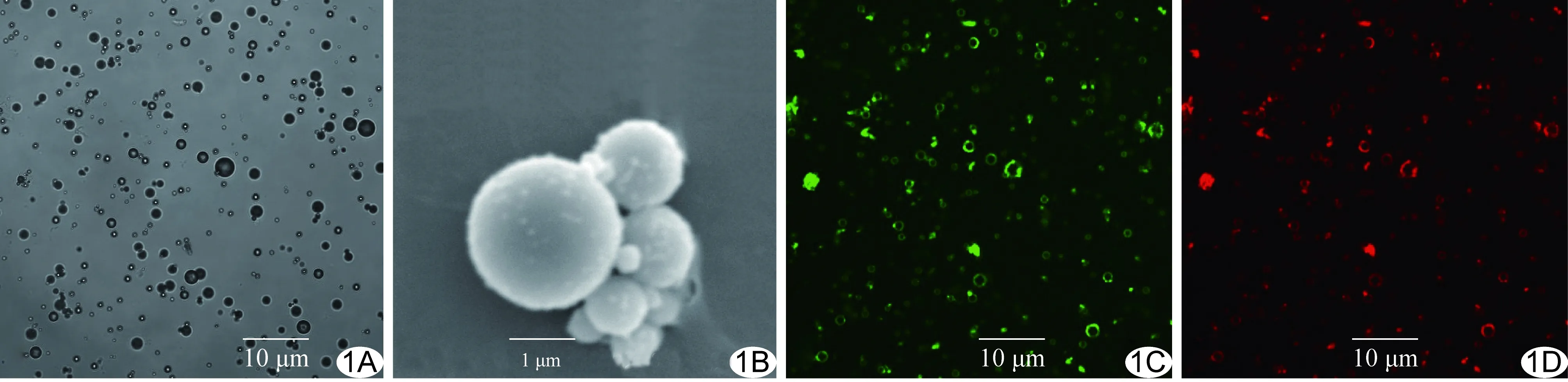
图1 RGDS/rt-PA双负载靶向微泡 A.光学显微镜下微泡呈细小圆形结构,环形外壳包绕中央半透亮区,大小均匀,无聚集现象; B.扫描电镜下微泡呈球形结构,略有聚集现象; C、D.同一视野荧光显微镜下微泡携rt-PA呈绿色指环状荧光(C)、携RGDS呈橙红色指环状荧光(D)
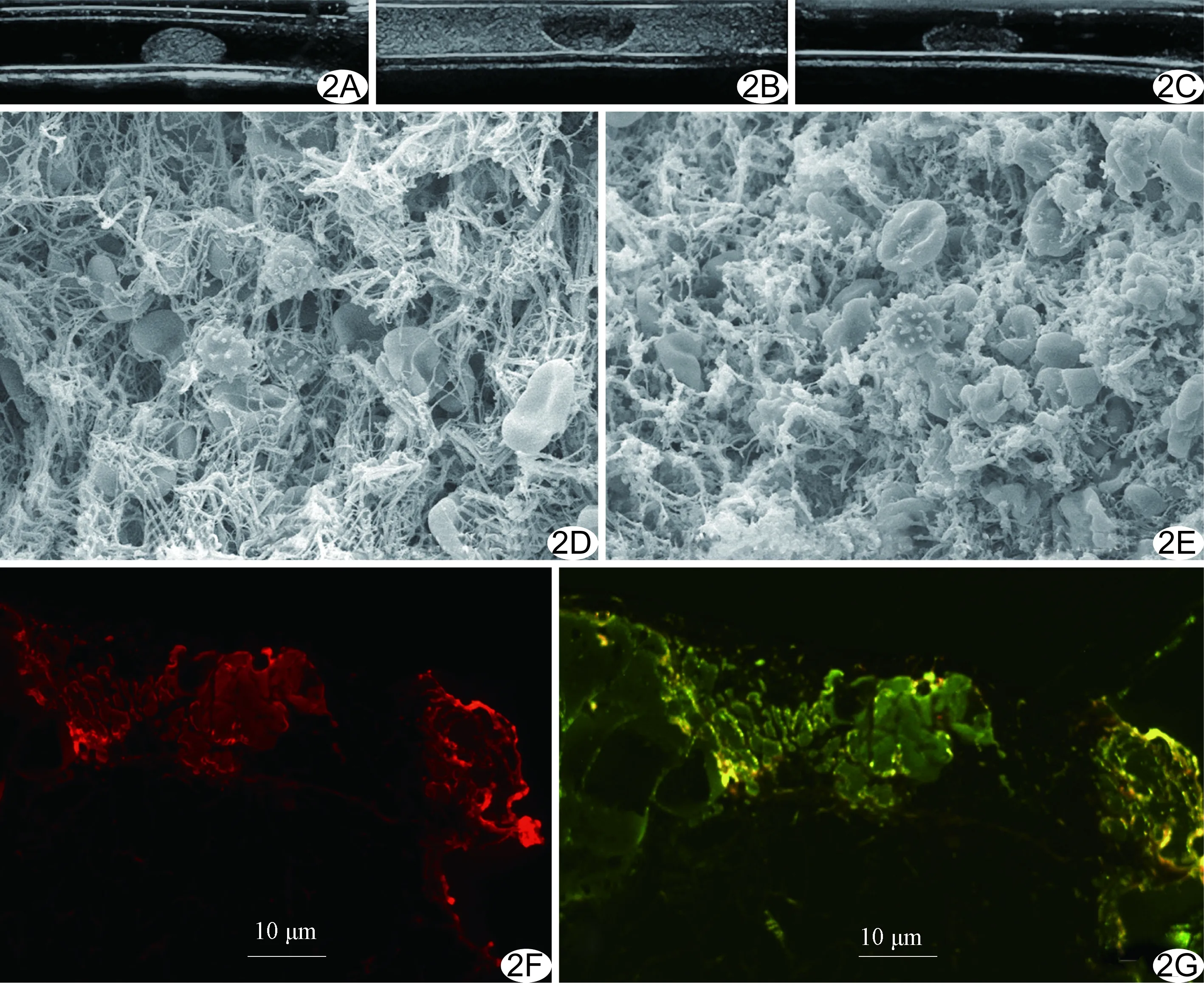
图2 体外血栓模型 A~C.体外血栓模型RGDS/rt-PA双负载靶向泡注入前(A)、注入后(B)、PBS洗涤冲管后(C)声像图; D、E.扫描电镜示溶栓前(×3 000,D)、后(×3 000,E)的血栓模型结构图; F、G.荧光显微镜下血栓模型内部可见标记RGDS的橙红色荧光(F)及标记rt-PA的绿色荧光(G)
以单负载最佳结合剂量(0.062 5 mg)将rt-PA及RGDS与微泡结合,加入顺序不同的配体与微泡双负载结合率差异均有统计学意义(F=16.090,P=0.004),其中RGDS与rt-PA混匀后加入的结合率最高(表3)。
2.3 声学显像特征 超声示血栓模型呈均匀中高回声,将RGDS/rt-PA双负载靶向微泡注入管腔后,可见均匀分布的点状高回声,血栓边界回声明显增强。经PBS液冲管后,血栓表面仍呈高回声,但较前明显减低,内部点状高回声分布体积也较前缩小(图2A~2C)。
2.4 溶栓能力 扫描电镜下血栓模型呈大量致密的纤维蛋白网状结构,其内可见活化的血小板及红细胞(图2D);经RGDS/rt-PA双负载靶向微泡联合超声辐照后,纤维蛋白网状结构明显破坏、纤维束断裂成细沙状,并可见变形融合的血细胞(图2E)。荧光显微镜下血栓模型表面与内部均可见RGDS标记的橙红色荧光及rt-PA标记的绿色荧光(图2F、2G)。
表3 加入顺序不同的配体与微泡双负载结合率的比较(±s)

表3 加入顺序不同的配体与微泡双负载结合率的比较(±s)
配体加入顺序双负载结合率(%)先加RGDS后加rt-PA67.21±1.90*#先加rt-PA后加RGDS61.50±0.85*rt-PA与RGDS混匀加入68.26±1.75F值16.090P值0.004
注:*:与rt-PA与RGDS混匀加入相比,P<0.01;#:与先加rt-PA后加RGDS相比,P<0.01
3 讨论
BAS桥接法在制备靶向微泡造影剂中备受关注[7]。本课题组应用BAS桥接法将RGDS及rt-PA与微泡进行连接,成功制备了RGDS/rt-PA双负载靶向微泡[8]。本研究中,RGDS/rt-PA双负载靶向超声微泡的物理特性与裸微泡的差异无统计学意义,荧光显微镜下可见微泡携rt-PA呈绿色指环状荧光、携RGDS呈橙红色指环状荧光,提示配体与微泡结合稳定,符合理想的靶向超声造影剂要求[9]。
本研究中,RGDS及rt-PA与微泡单负载的结合率均较高,同一剂量梯度下rt-PA与微泡单负载的结合率均低于RGDS(P均<0.05),可能是由于rt-PA在溶解过程中需加入吐温80等助溶物质,后者可在生物素化过程中被同时标记[10],占据部分结合位点,导致rt-PA与微泡的结合率降低。
本研究在明确单负载最佳结合率的基础上,以不同顺序加入配体构建双负载微泡,结果显示将两种配体混匀同时加入微泡后的结合效率最高,与既往[11-12]研究结果不同,分析原因,可能是由于先加入的配体会优先与微泡结合,占据较多结合位点,导致后加入的配体与微泡的结合率降低。但本研究未观察不同配比配体对微泡结合率的影响,亦未涉及配体间的微量调整及与微泡结合时的微量控制。
本研究中,RGDS及rt-PA剂量均为0.062 5 mg时,与微泡单负载的结合率最高,分别为(92.33±1.47)%和(82.36±1.82)%,而RGDS和rt-PA与微泡双负载结合时的结合率明显降低[(68.26±1.75)%],与本课题组前期研究[13]结果一致,原因可能在于RGDS与rt-PA与微泡表面的链霉亲和素结合时会竞争结合位点,产生一定竞争性抑制作用。
RGDS/rt-PA双负载靶向微泡可通过RGDS引导rt-PA聚集在血栓周围,实现靶向性溶栓;同时,由于rt-PA靶向性浓聚于血栓周边,可在提高溶栓效率的前提下有效减少由于全身血药浓度过高导致的药物不良反应[12]。本研究将RGDS/rt-PA双负载靶向微泡注入血栓模型后,超声可见均匀分布的点状高回声,血栓边界回声明显增强,提示微泡高度浓聚于血栓模型周围;经冲洗处理后血栓模型表面仍可见微泡显影,但回声较前明显减低,内部点状高回声分布体积也较前缩小,扫描电镜及荧光显微镜结果提示携带相应荧光物质的RGDS/rt-PA双负载靶向微泡可与血栓紧密结合,并起到溶栓作用[14]。
