FAM134B介导的自噬在无镁外液致痫海马神经元内质网应激及凋亡中的作用
2020-07-07谢南昌李钰娟李英娇杜丽媛孟祥荷连亚军
谢南昌, 李钰娟, 李英娇, 王 翠, 杜丽媛, 孟祥荷, 连亚军
癫痫是常见的神经系统疾病,其中约三分之一为难治性癫痫,因此明确癫痫的发病机制及寻找新的治疗靶点尤为重要[1]。近年研究表明癫痫发作导致的脑缺氧缺血、钙离子紊乱等都会干扰内质网功能的动态平衡,引发大量未折叠或者错误折叠蛋白质在内质网中积累,引起内质网应激[2,3]。适度的内质网应激可以使应激保护因子葡萄糖调蛋白78(glucose regulating protein 78,GRP78)因子上调,促进内质网功能恢复。而持续的内质网应激会使C/-EBP同源蛋白(C/EBP homologous protein,CHOP) 等上调,引发细胞凋亡[4,5]。在内质网应激及凋亡过程中,自噬可通过清除错误折叠蛋白质及受损细胞器抑制内质网应激,维持细胞稳态,减少细胞凋亡[6]。FAM134B(family with sequence similarity 134,member B)是FAM134网状蛋白家族中的成员,该蛋白由497个氨基酸残基组成,包含1个内质网蛋白同源结构域(reticulon-homology domain,RHD)和微管相关蛋白轻链3(microtubule associated protein light chain 3,LC3)结合域[7]。FAM134B作为自噬受体,可诱导内质网片段化并清除受损内质网,维持内质网动态平衡[8]。最新研究发现,在人与小鼠体外培养细胞中,FAM134B在内质网应激诱导的细胞凋亡方面发挥重要调节作用[9],但FAM134B介导的自噬在无镁外液致痫海马神经元内质网应激及凋亡中的作用机制尚不明确。本研究中,我们利用体外海马神经元癫痫模型,通过慢病毒载体Lenti-FAM134B及Lenti-FAM134B-shRNA干预FAM134B表达,并进一步采用选择性自噬抑制剂3-MA来明确FAM134B介导的自噬在无镁外液致痫海马神经元内质网应激及凋亡中的作用。
1 材料与方法
1.1 动物与实验试剂 新生24 h以内健康SD大鼠,SPF级。试剂:无镁外液(2.5 mmol/L KCl、145 mmol/L NaCl、10 mmol葡萄糖、0.002 mmol/L甘氨酸、2 mmol/L CaCl2和10 mmol/L HEPES,pH 7.4);正常细胞外液(无镁外液各成分+1 mmol/L MgCl);PBS液;RIPA裂解缓冲液;TUNEL试剂盒(购自德国Roche公司);NSE抗体(购自武汉博士德生物公司);LDH释放法检测试剂盒(购自南京建成生物工程研究所);β-actin、CHOP、LC3B抗体(购自美国CST公司);GRP78抗体(购自美国Abcam公司);过表达FAM134B慢病毒载体Lenti-FAM134B、慢病毒空载体Lenti-pGV、低表达FAM134B慢病毒载体Lenti-FAM134B-shRNA(购自上海吉凯基因公司)。
1.2 原代海马神经元的培养 无菌条件分离新生24 h内SD大鼠海马组织,剔除表面血管,并剪成组织块转移至离心管中,加入0.125%的胰酶消化后加入PBS液终止并离心,弃上清,洗涤后加入种植培养液制成细胞悬液。以4×105个/孔的密度将神经元细胞接种于预先以L-多聚赖氨酸包被的6孔细胞培养板中,置于37 ℃、5% CO2培养箱中。培养4 h后将种植培养液更换为维持培养液。每2 d半量更换维持培养液。通过免疫组化染色检测神经元纯度,纯度>90%时进行下一步实验。
1.3 大鼠海马神经元癫痫模型的建立与实验分组
1.3.1 造模 大鼠海马神经元弃掉维持培养液后,使用无镁外液冲洗3次,加入无镁外液培养3 h诱导海马神经元癫痫模型。
1.3.2 实验分组 将原代海马神经元随机分为:(1)对照组(CON组):神经元用正常细胞外液处理3 h;(2)无镁诱导组(AE组):神经元用无镁外液处理3 h后;(3)Lenti-pGV组(阴性对照组):神经元由Lenti-pGV转染成功后,继续用维持培养液培养,用无镁外液处理3 h;(4)Lenti-FAM134B组(过表达FAM134B组):神经元由Lenti-FAM134B转染成功后,继续用维持培养液培养,用无镁外液处理3 h后;(5)Lenti-FAM134B-shRNA组(低表达FAM134B组):神经元由Lenti-FAM134B-shRNA转染成功后,继续用维持培养液培养,用无镁外液处理3 h;(6)3-MA组:神经元由Lenti-FAM134B转染成功后,用自噬抑制剂 3-MA处理24 h,用无镁外液处理3 h后。各组在正常细胞外液或无镁外液处理3 h后,继续用维持培养液培养24 h后进行下一步实验(见表1)。

表1 各组神经元细胞处理流程
1.4 NSE染色检测神经元纯度 将神经元细胞接种到有细胞爬片的24孔板中培养,第7天时使用NSE染色行神经元纯度鉴定。吸去各孔培养液,加入4%的多聚甲醛固定30 min后,用0.2%的TritonX-100破膜5 min,加入10%的山羊血清孵育1 h。加入NSE一抗,4 ℃孵育过夜。吸弃一抗,PBS漂洗,加入二抗,避光孵育1 h。PBS漂洗,在载玻片上滴加10 μl含DAPI的抗荧光衰减封片剂,取出细胞爬片,盖在载玻片上。随机选择10个视野荧光显微镜下观察,计算NSE阳性细胞阳性率并取均值,即神经元纯度。
1.5 LDH释放法评估细胞活力 取各组神经元细胞培养液离心后取上清液,按照LDH试剂盒说明书操作加入试剂及待测样本,37 ℃温浴15 min后,加入LDH反应液后,37 ℃温浴15 min后,加入NaOH溶液后利用酶标仪于450 nm处测量各孔吸光度,并计算LDH释放率。
1.6 TUNEL法检测细胞凋亡 吸出培养液,加入4%的多聚甲醛固定30 min后,用0.2%的TritonX-100破膜5 min,神经元加入TUNEL反应混合液在37 ℃反应1 h,与DAPI在37 ℃反应5 min。在荧光显微镜下观察凋亡细胞,并计算阳性细胞数。
1.7 Western blotting检测不同蛋白的表达 加入RIPA裂解缓冲液裂解海马神经元提取蛋白;12% SDS-PAGE凝胶电泳,电泳结束后将胶上的蛋白质条带转移到PVDF膜上,5%脱脂奶粉封闭2 h。一抗β-actin (1∶1000)、CHOP(1∶500)、GRP78 (1∶500)、LC3B (1∶1000)孵育,在4 ℃过夜;加入二抗在室温下孵育1 h。采用Image J软件分析蛋白条带。
1.8 慢病毒载体转染神经元细胞 将海马神经元以2×105个细胞/ml的密度置于6孔板上。培养5 d后,分别使用Lenti-FAM134B、Lenti-pGV和Lenti-FAM134B-shRNA转染神经元细胞,感染复数为15。培养12 h后,弃去含慢病毒载体的培养液,加入正常培养液;培养72 h后,使用荧光显微镜下观察感染效率,并进行下一步干预及检测。

2 结 果
2.1 神经元纯度检测 采用NSE免疫荧光染色后,荧光显微镜下可观察到神经元胞质和树突着红色荧光,胞核着蓝色荧光。随机选取10个视野荧光显微镜下观察并计数,取其均数计算得神经元纯度为95%以上(见图1)。
2.2 FAM134B对无镁外液海马神经元凋亡的影响 采用LDH释放法评估神经元活力,LDH释放率越高,神经元损伤程度越重,神经元活力越低。与CON组相比,AE组细胞LDH释放率明显升高(P<0.05);与AE组比较,过表达FAM134B组LDH释放率明显降低,低表达AM134B组LDH释放率明显升高(P<0.05);AE组与阴性对照组比较,两组间无统计学意义(P>0.05)(见图2)。采用TUNEL法检测细胞凋亡。AE组神经元凋亡明显增加;与AE组相比,过表达FAM134B组神经元凋亡明显减少,低表达FAM134B组神经元凋亡增加(P<0.05);AE组与阴性对照组比较,两组间无统计学意义(P>0.05)(见图3)。
2.3 FAM134B对无镁外液致痫神经元自噬相关蛋白的作用 与CON组相比,AE组中LC3-Ⅱ/LC3-Ⅰ比值增加(P<0.05);与AE组相比,过表达FAM134B组LC3-Ⅱ/LC3-Ⅰ比值明显增加,低表达FAM134B组LC3-Ⅱ/LC3-Ⅰ比值减少(P<0.05)。AE组与阴性对照组比较,两组间无统计学意义(P>0.05)(见图4)。
2.4 FAM134B对无镁外液致痫神经元内质网应激的作用 AE组GRP78和CHOP的表达明显高于CON组(P<0.05);与AE组相比,过表达FAM134B组GRP78和CHOP的表达明显降低,低表达FAM134B组GRP78和CHOP的表达明显升高(P<0.05);AE组与阴性对照组比较,两组间无统计学意义(P>0.05)(见图5)。
2.5 选择性自噬抑制剂3-MA对内质网应激及凋亡的影响 采用选择性自噬抑制剂3-MA阻断自噬,验证FAM134B是否通过诱导自噬对内质网应激及凋亡产生作用。与CON组相比,AE组中GRP78和CHOP的表达明显升高,LDH释放率升高(P<0.05);与AE组相比,过表达FAM134B组GRP78和CHOP表达降低,LDH释放率降低(P<0.05);与FAM134B组相比,3-MA组GRP78和CHOP的表达升高,LDH释放率明显升高(见图6)。
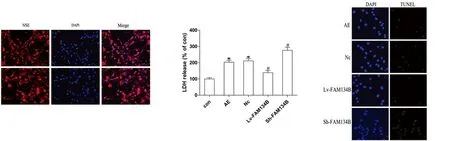
图1 神经元纯度检测;图2 LDH法检测海马神经元活力,与CON组相比*P<0.05;与AE组相比#P<0.05;图3 TUNEL法检测细胞凋亡
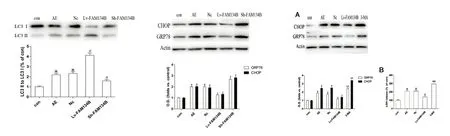
图4 各组海马神经元LC3-Ⅱ/LC3-Ⅰ的表达水平,与CON组比较*P<0.05;与AE组比较#P<0.05;图5 各组GRP78、CHOP蛋白的表达水平,与CON组相比*P<0.05;与AE组相比#P<0.05;图6 各组海马神经元GRP78、CHOP的表达水平,(B)LDH法测定各组细胞活力,与CON组比较*P<0.05;与AE组比较#P<0.05;与Lenti-FAM134B组比较**P<0.05
3 讨 论
近期研究表明,应激条件下FAM134B介导的自噬可维持内质网稳态,对细胞存活至关重要[8]。本研究发现过表达FAM134B对无镁外液致痫海马神经元内质网应激和神经元凋亡发挥保护作用,而低表达FAM134B发挥相反作用。且进一步采用选择性自噬抑制剂3-MA干预后,消除了过表达FAM134B对内质网应激及神经元凋亡的保护作用,表明FAM134B可能通过调控自噬途径对无镁外液致痫海马神经元内质网应激和神经元凋亡发挥保护作用。
研究表明,低表达FAM134B导致内质网膨胀与扩张,过表达FAM134B则加速内质网碎解并促进溶酶体降解调节自噬[10]。内质网应激时,激活的钙调素依赖性蛋白激酶2β(CAMK2B)可磷酸化FAM134B中RHD,进一步增强FAM134B寡聚化和内质网片段化[11]。同时FAM134B通过LC3结合域募集自噬相关蛋白LC3并与之相互作用,促进内质网裂解为可被自噬小体包裹的碎片,并加速与溶酶体的融合降解进而发挥调节自噬作用[8]。本研究显示,过表达FAM134B使无镁致痫海马神经元中自噬标记物LC3-Ⅱ/LC3-Ⅰ比值显著增加,同时我们还发现过表达FAM134B可使AE诱导的LDH释放率明显降低,并减少癫痫海马神经元凋亡,而低表达FAM134B发挥相反作用。这提示FAM134B可能通过调控自噬对癫痫海马神经元发挥神经保护作用。
近年研究表明,内质网应激与癫痫发病机制密切相关[12]。内质网应激主要通过激活未折叠蛋白反应(unfolded protein response,UPR)维持细胞稳态[13]。当内质网应激发生时,GRP78与蛋白激酶样内质网激酶(PERK)、肌醇需要酶l(IRE1)、激活转录因子6(ATF6)解离激活UPR清除错误折叠蛋白质,促进内质网功能恢复[14]。当UPR不能有效减轻内质网压力,细胞将启动CHOP通路等凋亡途径诱导细胞死亡[15]。CHOP作为促凋亡因子,可消耗细胞谷胱甘肽增加细胞对氧化应激的敏感性、上调促凋亡基因表达、下调抗凋亡基因bcl-2表达[16]。本研究发现,癫痫可导致GRP78和CHOP表达增加,而过表达FAM134B可降低GRP78和CHOP的表达,低表达FAM134B发挥相反作用。这表明癫痫可激活内质网应激,而过表达FAM134B可缓解癫痫海马神经元内质网应激反应。用3-MA干预可显著增加GRP78和CHOP的表达,并增加LDH释放率,提示抑制自噬可明显消除过表达FAM134B对无镁外液致痫海马神经元内质网应激及凋亡的保护作用。因此,本研究表明FAM134B可能通过调控自噬缓解无镁外液致痫海马神经元内质网应激及减少神经元凋亡。我们认为FAM134B有可能成为癫痫治疗的新靶点。
