牛支原体武威分离株丙酮酸激酶基因的原核表达及其表达产物的功能检测
2020-07-02包世俊邢小勇温峰琴武小椿
包世俊,冯 娜,邢小勇,温峰琴,武小椿
(甘肃农业大学 动物医学院,甘肃 兰州 730070)
牛支原体(Mycoplasma bovis,Mb)是引起牛的重要病原体之一,其可引起牛的肺炎、关节炎、乳房炎、角膜结膜炎等病症[1]。该病原于1961年首次在美国从乳房炎患牛中分离鉴定[2],但直到1976 年才依据其16S rRNA 序列将其命名为Mb。近年来,随着养牛业的不断发展和牛群的大范围转移,Mb感染也迅速扩散和蔓延[3],并已呈世界性分布。2008 年,我国首次出现Mb 感染所导致的犊牛坏死性肺炎疫情,其发病率高达50%~100%,病死率达10%~50%[4-5],给我国养牛业,尤其肉牛养殖业造成了重大经济损失,并严重威胁我国养牛业的健康可持续发展。
丙酮酸激酶(Pyruvate kinase,PK)又称腺嘌呤核苷三磷酸-丙酮酸-2-O-磷酸转移酶,是糖酵解和机体碳代谢途径中的一个关键酶。目前已分离鉴定的不同生物体的PK 基本均是以四聚体的形式发挥作用[6]。研究报道显示,鸡毒支原体PK 是其细胞膜表面的一种免疫原性蛋白,且其参与鸡毒支原体对宿主细胞的黏附[7]。但截至目前,对于Mb PK 相关的研究尚无报道,因此,本研究利用PCR 技术扩增了Mb 武威分离株的pyk 基因,对PK 在Mb 中的分布进行了检测,并对其多克隆抗体介导的杀灭Mb 作用和多抗抑制Mb 对宿主细胞的粘附作用进行了分析,为深入探究Mb的致病机理和免疫机制奠定了基础。
1 材料与方法
1.1 主要实验材料 Mb 武威分离株为甘肃农业大学预防兽医学传染病实验室分离保存;胎牛肺细胞(EBL)购自上海抚生生物科技有限公司;pGEM19-T载体购自宝生物工程(大连)有限公司;大肠杆菌(Escherichia coli)DH5α和Rosseta(DE3)感受态细胞均购自北京全式金生物技术有限公司;表达载体pET-28a(+)购自Novagen 公司。
1.2 主要试剂 Mb 兔抗血清为本实验室自制并保存;羊抗兔HRP-IgG 购自北京凯瑞力枫科贸有限公司;限制性内切酶BamH Ⅰ和Xho Ⅰ、2×Primer STAR Max DNA 聚合酶及T4 DNA 连接酶均购自宝生物工程(大连)有限公司;DL5000 DNA Marker 购自康为世纪生物科技有限公司;预染蛋白分子质量标准购自Thermo 公司;BCA 蛋白定量分析试剂盒购自碧云天生物技术有限公司;细菌基因组DNA 提取试剂盒、琼脂糖凝胶DNA 回收试剂盒、质粒小提试剂盒及DAB 显色试剂盒均购自TIANGEN 公司;弗氏完全佐剂、弗氏不完全佐剂购自Sigma 公司;Ni-NAT His Bind Purification Kit 购自Merck 公司;冻干补体(豚鼠源)购自中国兽医微生物菌种保藏管理中心;牛血纤维蛋白溶酶原(Native bovine plasminogen,Na⁃tive bovine PLG)购自Oxford 公司;支原体培养基基础购自青岛海博生物技术有限公司;马血清购自兰州民海生物工程有限公司。新西兰白兔购自兰州兽医研究所。
1.3 Mb 武威株的培养及基因组提取 冻存的Mb 武威株解冻后转接种于5 mL 支原体液体培养基(支原体培养基基础3.3 g,去离子水定容至100 mL,121 ℃高压灭菌冷却后加入马血清10 mL,丙酮酸钠0.2 g,青霉素80 000 IU)中,37 ℃、5%CO2培养3 d后取1.5 mL 培养物,12 000 r/min 离心10 min 后,弃 上清, PBS 洗涤3 次,参照细菌基因组DNA 提取试剂盒说明提取Mb 基因组DNA,冻存于-20 ℃备用。
1.4 pyk 基因的扩增与原核表达载体的构建 参照GenBank中Mb PG45株PK基因(pyk)序列(CP002188.1)设计2 对引物(表1),并在pyk-F 和pyk-R 分别引入BamHⅠ和XhoⅠ酶切位点。采用over-lap PCR 扩增pyk 基因:以Mb 基因组DNA 为模板,以引物pyk-F/pyk-Rn 扩增A 片段,引物pyk-Fn/pyk-R 扩增B 片段,再以A+B 为模板,用引物pyk-F/pyk-R 扩增得到pyk基因全长;反应程序为:98 ℃5 min;98 ℃45 s,54 ℃30 s,72 ℃45 s,30个循环;72 ℃10 min,PCR产物回收后克隆至pGEM19-T 载体,构建重组质粒pGEM-pyk 并经酶切鉴定,阳性克隆由金唯智公司测序鉴定。
将上述测序正确的质粒用BamHⅠ和XhoⅠ双酶切后克隆至经同样酶切的原核表达质粒pET-28a,构建的重组质粒命名为pET-pyk,并由金唯智公司测序鉴定。
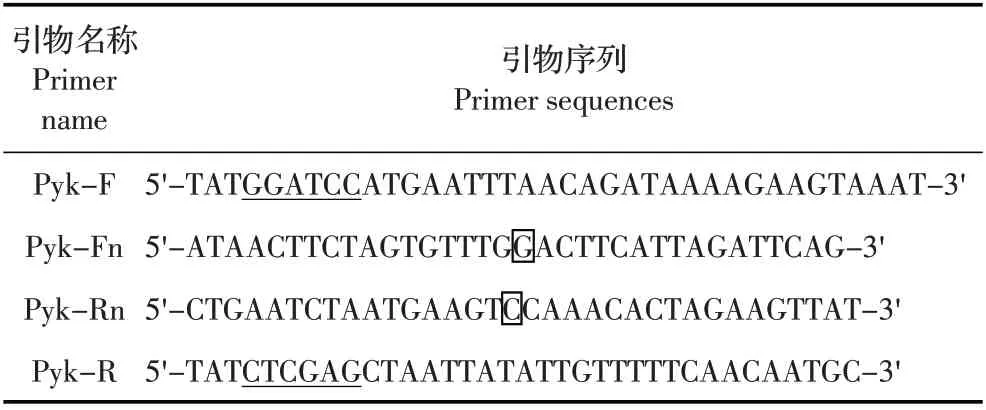
表1 pyk 基因PCR 扩增用到的引物Table 1 PCR primer used for amplifying pyk gene
1.5 重组蛋白的表达及纯化 将测序结果正确的重组质粒pET-pyk 转入大肠杆菌Rosseta(DE3)感受态细胞,37 ℃培养至OD600nm值为0.4~0.6,加入终浓度为1.0 mmol/L 的IPTG,20 ℃诱导10 h 后,离心洗涤菌体并以1×Binding buffer 悬浮菌体后超声裂解,离心后,上清用0.45 μm 滤膜过滤,滤液中加入适量的Ni-NAT His Bind Resin,4 ℃振荡孵育60 min 后将样品移入纯化柱体中,待液相的Binding buffer 全部流出柱体,用2×4 mL 的1×Wash buffer 洗除杂蛋白,最后用2 mL 1×Elution buffer 洗脱目的蛋白,分段收集样品并用SDS-PAGE 分析。纯化的原核表达产物His-PK 经BCA 定量后分装备用。
1.6 重组蛋白His-PK 兔抗血清的制备及其效价测定 将纯化后的重组蛋白His-PK 与等体积弗氏完全佐剂混匀并充分乳化,按800 μg/只的剂量皮下多点注射免疫新西兰大白兔,首免两周后第二次免疫,剂量减半(400 μg/只),并与等体积弗氏不完全佐剂混匀并乳化,经皮下多点注射免疫,此后,每间隔一周加强免疫一次,乳化方式和剂量同二免,四免后第5 d 采血分离血清,并经间接ELISA 法[8]检测重组蛋白His-PK兔抗血清的抗体效价,分装,-80 ℃保存备用。
1.7 PK 在Mb 细胞内分布的检测 取100 mL 培养至对数生长中后期的Mb 液体培养物,12 000 r/min离心10 min,菌体沉淀用PBS 洗涤3 次后按150 倍浓缩量重悬,移取50 μL 常规裂解后作为下述试验的Mb菌体蛋白对照,剩余菌悬液参考高翔等所述方法[8]提取Mb 膜蛋白。最后经丙酮沉淀的膜蛋白与胞浆蛋白重悬于等体积的PBS 中。将等体积的膜蛋白和胞浆蛋白经SDS-PAGE 电泳分离后,以His-PK 兔抗血清(1∶5 000)为一抗,羊抗兔IgG-HRP(1∶8 000)为二抗,经western blot 检测PK 在Mb 胞膜和胞浆内的分布。同时以纯化的His-PK和Mb菌体蛋白为对照。
1.8 His-PK 多抗介导的补体杀Mb 试验 参考高翔等方法[8]并略作调整,评估His-PK 多抗激活补体的杀Mb 作用。具体操作如下:取适量生长至对数生长后期的Mb 武威分离株菌液,4 ℃、12 000 r/min 离心10 min,无菌PBS 洗涤3 次,用适量的无菌PBS 重悬(6×109cfu/mL)。将180 μL Mb 菌悬液与60 μL 灭活的His-PK 兔多抗血清加入1.5mL 离心管、轻轻混匀并于37 ℃孵育30 min 后,加入60 μL 补体,混匀后37 ℃孵育1 h,用无菌PBS 做103、104、105稀释后,分别取100 μL 涂布60 mm 培养皿,每个稀释度平行做3 个重复。培养皿37 ℃,5%CO2培养5 d~7 d,计数菌落,计算杀菌率(%)[(His-PK 兔抗血清组CFU-免疫前兔血清组CFU)/补体对照组cfu×100%]。实验设Mb 兔抗血清对照组、His-PK 免疫前血清对照组和补体对照组。试验重复3 次,实验数据利用SPSS22.0 软件进行统计学分析His-PK 多抗介导的补体杀Mb 的作用。
1.9 His-PK 抗血清抑制Mb 粘附EBL 细胞的试验为验证Mb 对EBL 细胞的粘附功能,将6孔细胞培养板长至单层的EBL细胞,用无抗生素DMEM培养基洗涤3 次后加入终浓度为2.5 U/mL Native bovine PLG,37 ℃5%CO2条件下孵育2 h后经无抗生素DMEM 培养基洗涤备用。将培养至对数生长中后期的Mb 菌液12 000 r/min 离心10 min,无菌PBS 洗涤3 次后用无抗生素DMEM 重悬,并按MOI 200 的量感染Native bovine PLG 处理过的EBL 细胞,37 ℃5%CO2条件下孵育2 h,无菌PBS 充分洗涤后,加入少量预冷PBS刮取并收集细胞悬液,5 000 r/min 离心5 min,细胞沉淀中加入1 mL 0.25%的胰酶静置裂解10 min 后,取50 μL 细胞裂解产物加到450 μL 预热的支原体液体培养基中混匀后,10 倍倍比稀释(10~105),选择103~105稀释度的Mb 各取100 μL 涂布支原体固体培养基(支原体培养基基础3.3g,琼脂粉1.2 g,定容至100 mL,121 ℃高压灭菌,冷却至55 ℃后加入马血清10 mL,丙酮酸钠0.2 g,青霉素80 000 IU,混匀后倾制培养皿),每个稀释度分别设3 个重复。培养皿在37 ℃5%CO2培养5 d~7 d,计数菌落。分析Mb对EBL 细胞的粘附作用。
Mb 粘附EBL 细胞的抑制试验,按MOI 200 的量取样的Mb 菌悬液中加入His-PK 兔抗血清(1∶50),在37 ℃孵育1 h 后离心,Mb 沉淀重悬后移入Native bovine PLG 处理过的EBL 中,按上述步骤完成Mb 的粘附抑制试验。设免疫前兔血清对照组和Mb 兔抗血清对照组。计算粘附抑制率(%)[(His-PK 兔抗血清组CFU-免疫前兔血清组CFU)/空白对照组CFU×100%]。试验重复3 次,实验数据利用SPSS22.0 软件进行统计学分析His-PK 兔抗血清对Mb 粘附EBL 细胞的抑制作用。
2 结 果
2.1 pyk 基因的扩增与原核表达载体的鉴定结果以Mb 武威株的基因组DNA 为模板,分别PCR 扩增其pyk 基因的A 片段和B 片段,再以A+B 为模板经over-lap PCR扩增得到pyk全基因。结果显示,扩增的3 个片段大小分别约为1 290 bp、147 bp、1 437 bp,均与预期一致(图1)。利用BamHⅠ和XhoⅠ对构建的原核表达载体pET-pyk 进行双酶切鉴定,酶切产物条带分别为1 437 bp 和5 400 bp,与预期大小一致(图1),测序结果显示插入的pyk 基因序列正确。表明原核表达载体pET-pyk 构建正确。
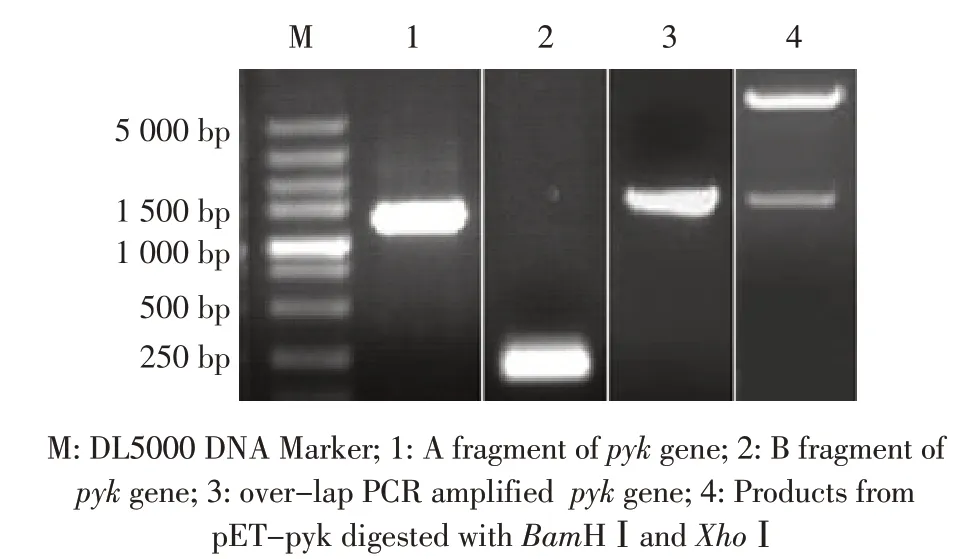
图1 Mb pyk 基因的over-lapPCR 扩增及重组表达载体pET-pyk 的双酶切鉴定Fig.1 Over-lap PCR amplification of Mb pyk gene and Identification of recombinant expression vector pET-pyk by double endonucleases digestion
2.2 重组蛋白的表达及纯化 重组质粒pET-pyk 转化大肠杆菌Rosseta(DE3)感受态细胞后,经IPTG 诱导后,利用SDS-PAGE 检测重组蛋白His-PK 的表达。结果显示,目的蛋白分子量57 ku,与预期相符(图2),表明pyk 基因在大肠杆菌中获得了表达,且表达产物主要存在于细胞裂解后的上清液中。
2.3 重组蛋白His-PK 兔抗血清的制备及其效价测定结果 利用纯化后的重组蛋白His-PK 经皮下多点注射免疫新西兰白兔,四免后采血分离血清,经间接ELISA 法检测,兔抗血清中多克隆抗体的效价高达1∶40 000,表明重组蛋白具有良好的免疫原性,且获得了高效价的His-PK 兔抗血清。

图2 重组蛋白表达的SDS-PAGE 检测结果Fig.2 SDS-PAGE analysis of the recombinant protein
2.4 PK 在Mb 细胞内分布的检测结果 将等体积的膜蛋白和胞浆蛋白经SDS-PAGE 电泳分离后,利用western blot 检测PK 在Mb 细胞内的分布情况。结果显示,重组蛋白His-PK 兔抗血清既可与Mb 菌体蛋白、膜蛋白和胞浆蛋白发生特异性结合,出现的目的条带大小为54 ku,也可与纯化的重组蛋白His-PK 结合,出现的目的条带大小57 ku(图3)。表明PK 在Mb 的细胞膜和细胞质中均有分布,且在膜中的分布量稍多于在细胞浆中的分布量。
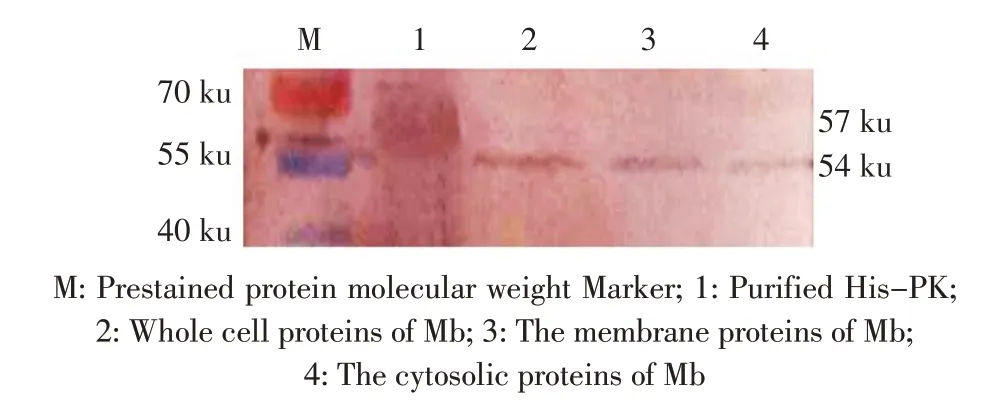
图3 重组蛋白His-PK 在Mb 中分布的检测结果Fig.3 Determination of the distribution of His-PK in Mb
2.5 His-PK 多抗介导的补体杀Mb 试验结果 利用抗体介导的补体杀支原体试验分析His-PK 兔抗血清激活补体的杀Mb 作用,以Mb 兔抗血清为阳性对照,His-PK 免疫前兔血清为阴性对照,通过菌落计数,计算可得His-PK 兔抗血清介导的补体杀Mb 的杀菌率为43.70%,Mb 兔抗血清杀菌率为85.30%(表2),与免疫前兔血清杀菌结果均差异极显著(p<0.01)。表明His-PK 兔多抗具有明显的介导补体杀Mb 作用,但Mb 兔抗血清因含有抗Mb 表面多种抗原的抗体成分,因而杀菌效果明显优于His-PK 兔抗血清。
2.6 His-PK 抗血清对Mb 粘附EBL 细胞的抑制试验结果 利用Mb 和经不同血清处理后的Mb 分别感染EBL 细胞,分析His-PK 兔抗血清对Mb 粘附EBL细胞的抑制作用。结果显示,His-PK 兔抗血清对Mb 黏附EBL 细胞的抑制率为48.48%,Mb 兔抗血清对Mb 黏附EBL 细胞的抑制率为94.69%(表3),与免疫前兔血清杀菌结果均差异极显著(p<0.01)。表明重组蛋白His-PK 兔抗血清能够抑制Mb 对宿主细胞的粘附,提示Mb PK 可能是一种感染相关蛋白,参与Mb 对宿主的感染,但Mb 兔抗血清的高抑制率也提示有PK 之外的其他Mb 膜表面分子参与Mb 对EBL 细胞的粘附。
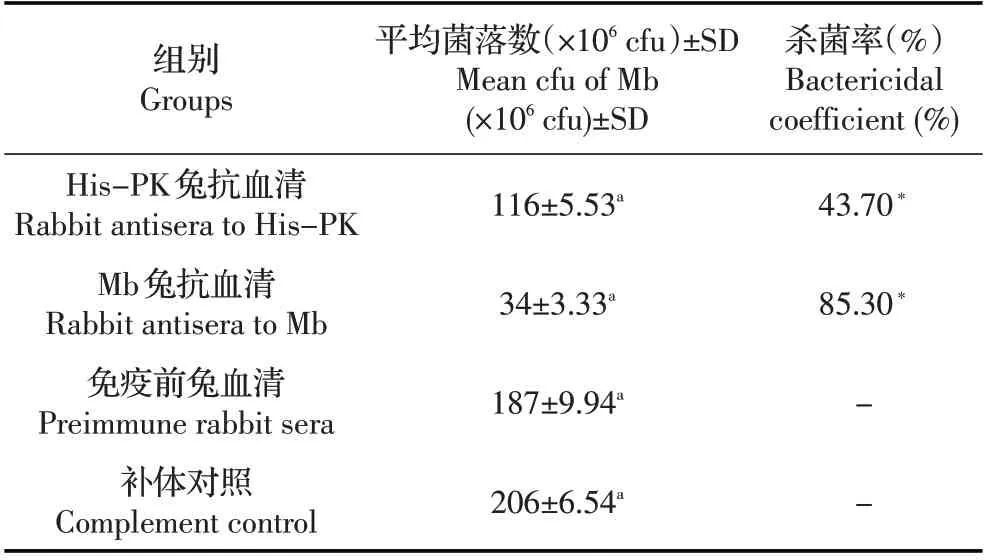
表2 His-PK 兔抗血清介导的补体杀Mb 试验结果Table 2 Sterilization rate of rabbit anti-His-PK serue
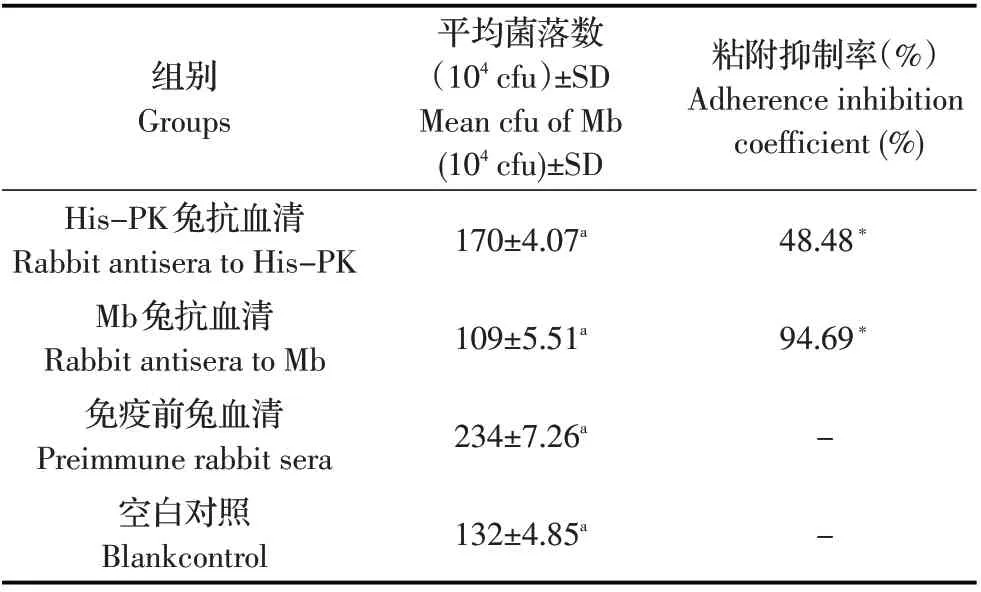
表3 His-PK 兔抗血清对Mb 粘附EBL 细胞的抑制试验结果Table 3 Inhibition coefficient of His-PK rabbit antiserum on Mb adhesion to EBL cells
3 讨 论
Mb 是牛的一种重要的致病性病原,其感染引起的牛支原体肺炎给我国乃至世界养牛业造成了重大经济损失。研究表明,支原体的大多数酶为外向酶,其分布于细胞膜表面,在支原体的感染及免疫中发挥重要作用,如甘油醛-3-磷酸脱氢酶样蛋白1(Mycoplsmasuis GAPDH-like protein 1,MSG1)位于猪嗜血支原体膜表面且参与其黏附红细胞[9];a-烯醇化酶在鸡毒支原体、猪嗜血支原体和发酵支原体中均分布于膜表面且通过结合血纤溶酶原、纤连蛋白发挥其黏附作用[10-12]。何随彬等的研究表明鸡毒支原体的PK 具有良好的免疫原性,是一种潜在的保护性抗原,且该蛋白与鸡毒支原体对细胞的黏附有关[8]。为研究Mb PK 相关的生物学功能,本研究利用PCR 扩增获得Mb pyk 基因,并采用over-lap 技术将其色氨酸密码子TGA 点突变为TGG,从而使其可有效在大肠杆菌中表达,且重组蛋白分子量为57 ku。基于此,纯化该重组蛋白免疫新西兰兔制备多抗血清,并对PK 在Mb 中的分布及抗体介导的补体杀Mb 活性和抗体对Mb 粘附EBL 细胞的抑制活性进行了检测,为该蛋白生物学功能的研究提供了实验依据。
有研究显示,鸡毒支原体、滑液支原体和Mb的多种酶均在其细胞膜中有分布[8,13-17],本研究利用His-PK 制备高效价兔抗血清,表明重组蛋白具有良好的免疫原性,是一种潜在的保护性抗原。进而采用western blot 对Mb PK 在其细胞内的分布进行了检测,结果表明Mb PK 在其细胞膜及细胞质内均有分布,且在二者的分布量相当,提示该蛋白可能与鸡毒支原体的PK 一样,是一种与Mb 免疫和感染相关的蛋白,参与其对宿主的感染过程及宿主细胞对该病原的免疫应答。因而,本研究采用抗体依赖的补体杀菌试验及粘附和粘附抑制试验来检测Mb PK 的免疫及与感染相关的生物学功能。结果表明,His-PK 兔多克隆抗体具有明显的介导补体杀Mb 的作用,其体外杀Mb 的效率可达43.70%,表明Mb PK 抗原抗体复合物可有效激活补体的杀支原体作用,从而参与宿主细胞对Mb 的免疫应答。粘附和粘附抑制试验结果显示,His-PK 兔抗血清可抑制Mb 对宿主细胞的粘附,且粘附抑制率为48.48%,表明Mb PK 参与其对宿主细胞的感染,是该病原的一种感染相关因子。
综上,本研究利用PCR 技术扩增获得Mb pyk 基因,并在完成其原核表达的基础上制备兔多抗血清,进而利用western blot 技术及抗体依赖的补体杀支原体试验和粘附抑制试验,证实PK在Mb细胞膜及细胞质中均有分布,且His-PK 的多抗具有明显的介导补体杀Mb作用和抑制Mb对宿主细胞的粘附作用。研究结果为深入探究Mb PK生物学功能奠定了基础。
