秦皇岛地区狐源大肠杆菌致病性及耐药性研究
2020-07-02刘勃兴史秋梅赵安奇杜万年柳翠翠张志强
刘勃兴,史秋梅,赵安奇,杜万年,柳翠翠,刘 畅,李 浩,张志强
(河北科技师范学院河北省预防兽医学重点实验室,河北 秦皇岛 066004)
大肠杆菌是一种条件性致病菌,广泛存在于自然界中,主要通过饮水、食物传播,并可以感染多种动物发病[1]。在毛皮动物养殖中,大肠杆菌病十分普遍,且常与其它病原微生物造成混合感染或继发感染。大肠杆菌感染狐,主要导致仔狐败血症、腹泻、呼吸及神经系统损伤,并可致母狐流产、死胎[2]。狐等毛皮动物养殖是秦皇岛地区的重要产业,大肠杆菌所致疾病对该地区的毛皮动物养殖业造成严重的经济损失。
临床上,对大肠杆菌病的治疗以抗生素类药物为主。但随着抗生素类药物的不合理应用,大肠杆菌对抗生素药物的耐药性日益严重,在临床上经常会出现抗生素无法有效的控制住大肠杆菌病,导致动物病情恶化甚至死亡,最终造成经济损失。针对上述现状,本研究对2019 年从秦皇岛地区分离的51株狐源大肠杆菌的致病性及耐药性进行研究,为该地区狐大肠杆菌病的防治提供依据。
1 材料与方法
1.1 病料样品来源 从秦皇岛市昌黎县、卢龙县、抚宁县和青龙县规模化养殖场、散养户以及养殖合作社采集病死狐肝脏、脾脏、肺脏、心脏等实质器官病料样品。
1.2 主要试剂 伊红美蓝培养基、麦康凯培养基购自北京陆桥科技股份有限公司;药敏纸片购自杭州天和微生物科技股份有限公司;2×Taq Master Mix、细菌DNA 基因组提取试剂盒购自康为世纪生物科技有限公司;DL2000 plus DNA Marker 购自中科瑞泰科技有限公司;质控菌株大肠杆菌ATCC25922、洁净级昆明小鼠(20±2 g)购自北京维通利华实验动物有限公司;PCR 扩增引物由上海生工生物工程技术服务有限公司合成。
1.3 细菌的分离鉴定 无菌采取病死狐病料样品,从肝脏、脾脏、肺脏、心脏等实质脏器分离细菌,采用伊红美蓝和麦康凯培养基对分离菌初步鉴定,选取符合大肠杆菌菌落特征的细菌进行生化鉴定和16S rDNA 序列分析,最终分离出51 株狐源大肠杆菌。
1.4 分离菌的致病性试验 1 株分离菌为1 个感染组,每组5 只小鼠,每只小鼠经腹腔注射0.1 mL 对数期菌液(浓度为1×107cfu/mL),对照组注射0.1 mL无菌PBS。观察并记录小鼠死亡情况。
1.5 分离菌的毒力基因检测 参照细菌DNA 基因组提取试剂盒说明书提取DNA,并以其为模板,参考文献[3]中的毒力基因引物序列合成引物,PCR检测分离菌iss、intimin、ler、irp2、fyuA、vat、hlyF、astA、iucD、papC、eaea、iroN、ompT、fimC 毒力基因携带情况。
1.6 分离菌的药物敏感性试验 按照美国临床和试验室标准协会(CLSI)药物敏感性试验操作方法,采用KB 纸片法检测51 株分离菌对氨苄西林、头孢曲松、阿莫西林等15 种抗生素类药物的敏感性。按照CLSI 标准对试验结果进行判定。大肠杆菌ATCC25922 为药物敏感性试验质控菌。
1.7 分离菌的耐药基因检测 以提取的分离菌的DNA 为模板,参考文献[3]中的耐药基因引物序列合成引物,PCR 检测分离菌的tetA、tetC、sul1、sul3、qnrA、qnrB、gyrA、gyrB、CTX-M、SHV、addA1、strA、strB、ermA、mefA 耐药基因。
2 结 果
2.1 分离菌的致病性试验结果 分离菌感染小鼠后连续观察1 周。结果显示,感染组小鼠精神沉郁,站立不稳,呼吸频率紊乱,对外界刺激反应降低。51 组感染组小鼠均有死亡,死亡率在20%~100%。剖检死亡小鼠,有明显败血症症状,肝脏、肺脏出血最为严重。对死亡小鼠的肝脏、肺脏、心脏等器官进行细菌分离并鉴定,同样分离到大肠杆菌,经生化鉴定与16S rDNA 序列分析,从病死小鼠分离出的大肠杆菌与感染菌株指标相近。表明51 株分离菌均具有一定的致病力。
2.2 分离菌毒力基因检测结果 采用PCR方法对分离菌的毒力基因进行检测,结果显示,检测的14种毒力基因中共检出10 种毒力基因:intimin、iucD、ler、irp2、eaea、fyuA、iroN、ompT、hlyF、fimC,检出率在1.96%~96.08%,其中fimC 基因检出率最高,为96.08%(49/51)。未检出iss、astA、papC、vat 毒力基因(表1)。对每株分离菌检出毒力基因数进行统计,检出1 种毒力基因菌株最多,占比35.29%(18/51)(图1)。结果表明,不同分离菌株携带毒力基因种类复杂。
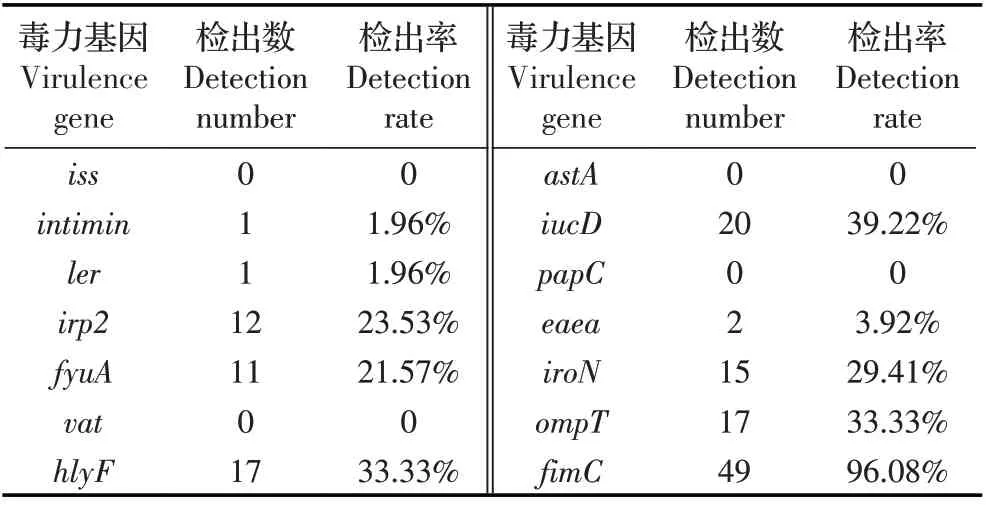
表1 分离菌毒力基因检测结果Table 1 Test results of virulence genes of isolated bacteria
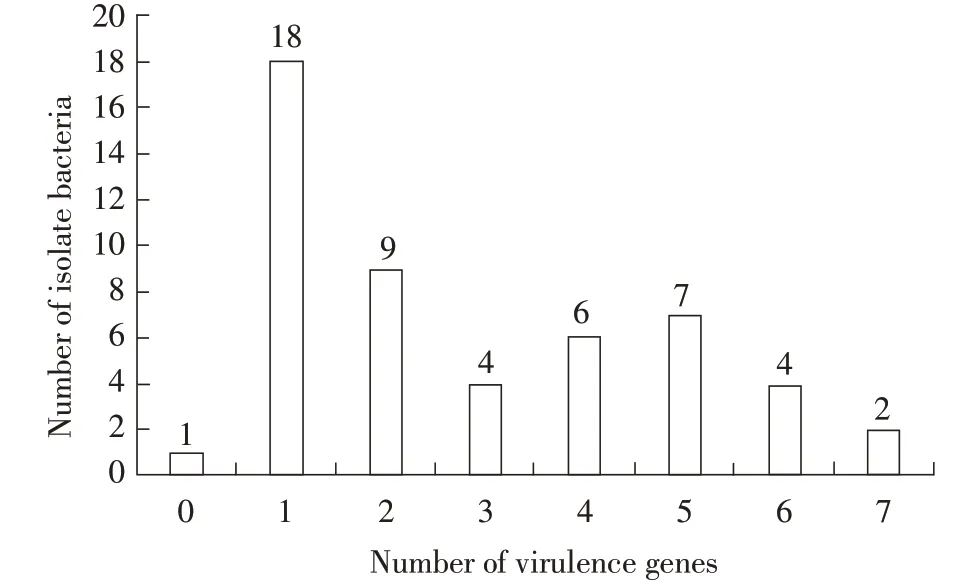
图1 分离菌毒力基因检出数量与菌株数统计结果Fig.1 Statistical results of the number of virulence genes detected and the number of strains isolated
2.3 分离菌的药物敏感性试验结果 采用KB 纸片检测分离菌对抗生素药物的敏感性,按照CLSI 标准对试验结果进行判定,结果显示,51 株分离菌对氨苄西林(AMP)、阿莫西林(AML)、新霉素(NEO)、环丙沙星(CIP)、氟苯尼考(FFC)、替米考星(TMS)、土霉素(OTC)、磺胺间甲氧嘧啶(SMM)、磺胺二甲氧嘧啶(SM2)、复方新诺明(SXT)高度耐药,耐药菌株占72.55%~94.12%。分离菌对阿米卡星(AK)、恩诺沙星(ENR)较敏感,敏感菌株分别为66.67%(34/51)、80.39%(41/51)(图2)。对分离菌的多重耐药情况进行统计,分离菌中对12 种、13 种、14 种抗生素耐药的菌株较多,占比分别为23.53%(12/51)、21.57%(11/51)、21.57%(11/51)。分离菌最少对8 种抗生素耐药,菌株占比3.92%(2/51),最多对15 种抗生素耐药,菌株占比1.96%(1/51)(图3)。分离菌株耐药情况很严重,且均表现为多重耐药,临床用药应结合分离的大肠杆菌的药物敏感性试验结果,注意合理应用各抗生素。
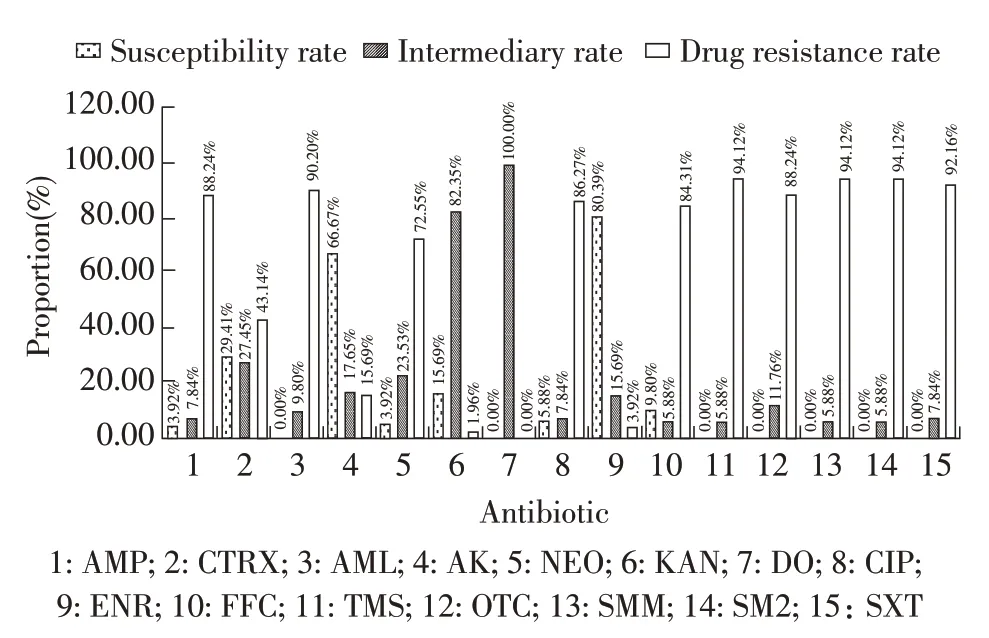
图2 分离菌对15 种抗生素的敏感性试验结果Fig.2 The sensitivity test rate of isolated bacteria to 15 kinds of antibiotics
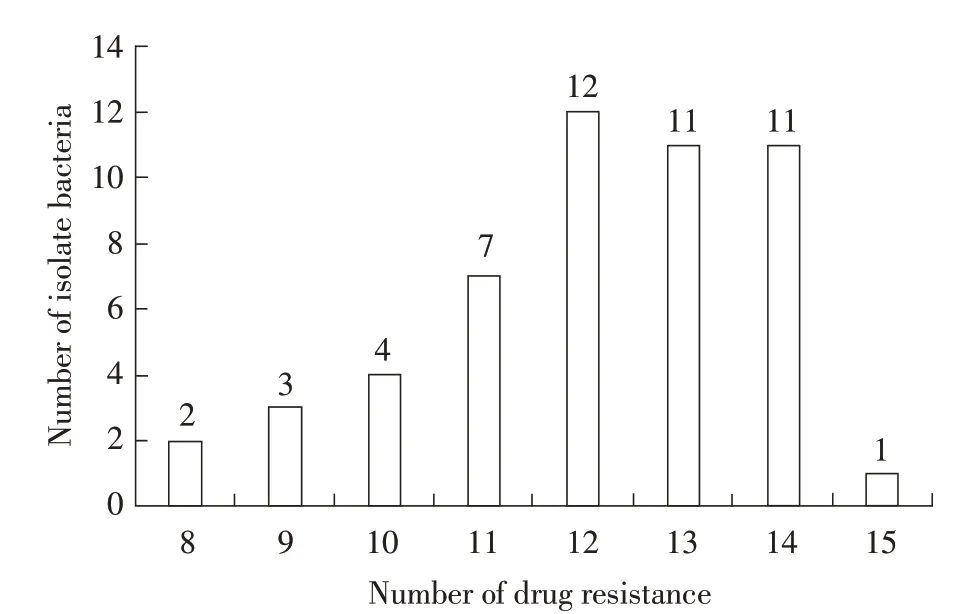
图3 分离菌多重耐药情况Fig.3 Multidrug resistance of the isolated bacteria
2.4 分离菌的耐药基因检测 采用PCR 方法对分离菌的耐药基因进行检测,结果显示,tetA、tetC、sul1、mefA 基因未检出,gyrA、gyrB、addA1 基因检出率高达100%,sul3、qnrA、qnrB、CTX-M、SHV、strA、strB、ermA 基因检出率分别为37.25%(19/51)、13.73%(7/51)、19.61%(10/51)、35.29%(18/51)、19.61%(10/51)、52.94%(27/51)、62.75%(32/51)、11.76%(6/51)(表2)。对每株分离菌的耐药基因数进行统计,51 株分离菌分别检测到3~9 个耐药基因,其中检出6 个耐药基因的菌株数最多,占比33.33%(17/51)。分离菌株均携带有3 种及以上耐药基因,且不同菌株耐药基因携带情况不同(图4)。51 株分离菌均携带有多种耐药基因,不同菌株耐药基因携带情况有一定的差别,并且耐药基因检出率与抗生素耐药性数值不完全符合。
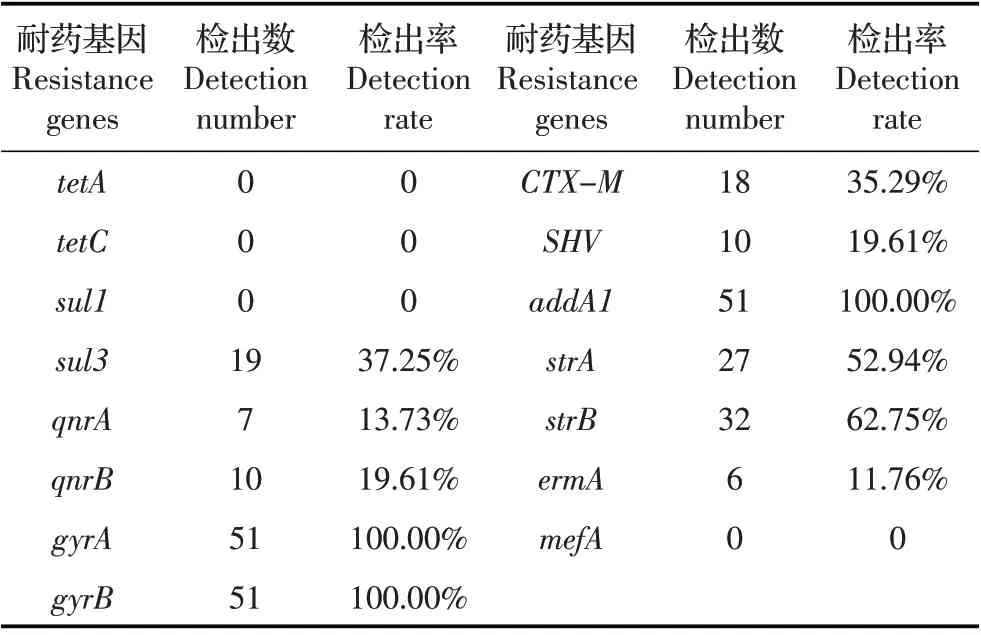
表2 分离菌耐药基因检测结果Table 2 Detection results of drug resistance genes in isolated bacteria
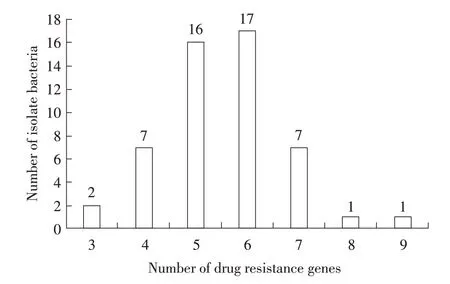
图4 分离菌耐药基因个数与菌株数的统计结果Fig.4 Statistical results of the number of drug-resistant genes and strains in isolated bacteria
3 讨 论
2019 年,本研究室采集秦皇岛地区规模化养殖场、散养户、养殖合作社等病死狐肝脏、肺脏、心脏等实质器官样品,并对其进行细菌的分离,经鉴定,分离出51 株大肠杆菌。为确定分离菌的致病性,本研究以小鼠为动物模型进行致病性试验,结果显示,51 株分离菌均对小鼠具有致病性,表明本次研究的51 株狐源大肠杆菌均具有一定的致病能力,同时提示在临床诊治狐相关疾病时,大肠杆菌是不容忽视的重要病原。
对分离菌的毒力基因进行检测,共检测出10 种毒力基因,分别为intimin、iucD、ler、irp2、eaea、fyuA、iroN、ompT、hlyF、fimC。检出率最高的毒力基因为fimC,检出率为96.08%。fimC 为黏附素I 型菌毛毒力基因,其编码FimC 蛋白介导I 型菌毛的装配,该基因变异可导致菌毛无法正常合成[4]。有研究表明,在鸡源高致病大肠杆菌菌株中,fimC 基因检出率较高[5-6]。刘雪威用基因敲除技术构建了fimC基因缺失鸡致病性大肠杆菌,并验证了该基因缺失可使大肠杆菌对鸡的毒力下降[7]。据李巧玲报道,秦皇岛地区狐肺炎大肠杆菌fimC 基因检出率71.4%(55/77)[3],而本研究狐源大肠杆菌fimC 基因检出率明显高于李巧玲的报道,这可能是由于采样时间和样品来源不同所造成。在狐源大肠杆菌fimC 基因检出率较高,表明该基因可能与狐源大肠杆菌的致病性有关,但目前鸡源大肠杆菌fimC 基因研究较多,而在狐源大肠杆菌该基因的相关研究未有报道,值得进一步研究。对每株分离菌的毒力基因检出数进行统计,发现分离菌分别检出0~7 种毒力基因,不同菌株的之间毒力基因携带情况不同,表明分离菌株毒力基因携带情况十分复杂。有1 株分离菌在本研究中未检测到毒力基因,但在致病性试验中该菌株同样对小鼠具有致病性,表明该菌可能携带本研究中检测14 种毒力基因之外的其它毒力基因,需要我们进一步研究。
目前,大肠杆菌的耐药性日益严重,给临床治疗带了严峻的挑战,因此致病性大肠杆菌耐药性的研究具有十分重要的现实意义。本研究对分离51 株狐源大肠杆菌耐药性进行研究,发现分离菌株具有严重的多重耐药性。分离菌株中最少对8 种,最多对15 种抗生素耐药,其中分离菌中对12 种抗生素耐药的菌株数最多。分离菌对15 种抗生素中氨苄西林、阿莫西林、新霉素、环丙沙星、氟苯尼考、替米考星、土霉素、磺胺间甲氧嘧啶、磺胺二甲氧嘧啶、复方新诺明表现高度耐药,对阿米卡星、恩诺沙星敏感性较高。有相关报道[3,8-10],狐源致病大肠杆菌多重耐药普遍存在,在秦皇岛地区狐源大肠杆菌对磺胺类药物的耐药性普遍较高,因此不推荐该地区继续应用磺胺类药物治疗狐大肠杆菌病,而其他类抗生素药物耐药率各不相同,建议临床用药前可先通过药物敏感性试验检测抗生素药物的抗菌效果,合理联合用药进行治疗。
为了进一步了解分离菌的耐药性,本研究对分离菌的耐药基因进行检测。结果显示,51 分离菌分别检测出3~9 耐药基因,其中gyrA、gyrB、addA13种耐药基因检出率高达100%。gyrA、gyrB 为喹诺酮类药物的耐药基因。喹诺酮类药物作用于细菌的DNA 回旋酶,影响该酶的活性,使细菌DNA 无法正常螺旋从而起到抗菌效果。gyrA、gyrB 基因分别编码DNA 回旋酶的2 个A 亚基和2 个B 亚基,这2 个基因突变使喹诺酮类药物与细菌结合率下降,造成细菌耐药[11-12]。addA1 为氨基糖苷类药物的耐药基因。氨基糖苷类药物作用于细菌核糖体30S 亚基,抑制细菌蛋白质的合成达到抗菌效果[13]。addA1 是氨基糖苷类转移酶的重要基因,氨基糖苷类转移酶是氨基糖苷类抗生素钝化酶,可对氨基糖苷类抗生素进行修饰导致细菌产生耐药性[14-15]。2019 年上半年,狐源大肠杆菌的gyrA、gyrB、addA1 耐药基因流行率较高,表明在该地区狐源大肠杆菌对喹诺酮类和氨基糖苷类耐药水平较高,应引起重视。而其它耐药基因有不同程度的检出,且不同菌株耐药基因携带情况十分复杂,提示在临床治疗该病的时候应按照规定合理用药,避免滥用现象,减少耐药基因的产生与传播,同时对大肠杆菌耐药机制产生原因做进一步研究,从根源上解决大肠杆菌耐药问题。将分离菌的耐药基因检出情况与药物敏感性试验结果进行统计分析,发现两者数值不能完全符合,分析该现象产生原因,可能与耐药性相关的检测技术的存在一定的误差,并且细菌耐药性产生是由多个基因,多种机制共同作用的结果。但通过细菌耐药基因的检测,可以了解细菌的耐药情况并作出预防措施,具有公共卫生学意义。
本研究对2019 年从秦皇岛地区分离的51 株狐源大肠杆菌的致病性及耐药性进行研究,发现分离菌均具有一定的致病性,且对抗生素类药物表现严重的多重耐药性,为狐源大肠杆菌病的致病菌和指导临床用药提供参考。
