肠出血性大肠杆菌O157 多重PCR 检测方法的建立
2020-07-02张昕杨李火明李干武蔡文通
张昕杨,李火明,夏 颖,李干武,蔡文通
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
肠出血性大肠杆菌(Enterohemorrhagic Escherichia coli,EHEC)是一种严重的食源性病原菌。依感染程度不同,被感染者会有腹泻、出血性结肠炎或溶血性尿毒综合症等症状。EHEC 的多种血清型中,以O157 的危害最严重、最广泛[1]。牛、羊等被认为是EHEC O157 的天然宿主,其养殖过程中的物料、排泄物、肉品等是污染食物的重要来源[2]。检测EHEC O157 的常用方法有基于选择性培养基的分离增菌和免疫学方法等。而分离增菌的方法消耗时间较长,特异性有待提高;免疫学方法虽能减少检测时间,却因为交叉反应而使其应用受限。基于毒力基因或特异性基因序列的多重PCR 法则耗时短、灵敏、准确,是检测中常用的方法。
双组份调控系统是广泛存在于细菌的信号转导系统,它通常介导细菌对环境、宿主的适应性[3]。双组份调控系统的调控蛋白fusR[4]和n5512[5]分别编码于OI-20 和OI-1136 基因岛上,fusR 和n5512 与EHEC的O157 血清型高度相关:NCBI 数据库中的EHEC O157 中都含有fusR 和n5512 基因,个别O55 血清型的菌株中也有,而O157 被认为是从O55 进化而来的;fusR 和n5512 基因的序列保守性很强,高达98.3%。在其它细菌中,没有高度同源的基因。因此,fusR 和n5512 是潜在的优良检测靶标。本研究通过整合入两个EHEC O157 的毒力调控蛋白编码基因fusR 和n5512,加入经典的特征性基因rfbE(O157菌体抗原基因)与毒力基因stx1(志贺氏毒素I 型编码基因)和stx2(志贺氏毒素II 型编码基因)[6],而后优化反应条件,建立一种稳定、可靠的检测EHEC O157的多重PCR 方法,并对人工染菌的饲料、肉品等进行了检测,为现地应用提供了可行技术。
1 材料与方法
1.1 菌株与实验动物 假结核耶尔森菌(缩写为pstb,cmccb 53501)和EHEC O157 BuyATCC(cgmcc 243708)购自中国医学细菌保藏管理中心;EPEC(ATCC11775)购自美国模式培养物存储库(ATCC);EHEC O157 HBWH、 EHEC O157 XUZ-1、 EHEC O157 HVRI、EHEC O157 NongB、ETEC-1、M22-5 为临床分离株;EDL933 和Salmonella LT2 由本实验室保存。BALB/c 小鼠购自维通利华实验动物技术有限公司。
1.2 主要试剂 DNA Marker 和细菌基因组DNA 提取试剂盒购自宝生物工程(大连)有限公司;琼脂糖购自Invitrogen 公司;染料和2×Taq Master Mix 购自南京诺唯赞生物科技有限公司;50×TAE 购自北京索莱宝科技有限公司。
1.3 引物的设计与合成 根据GenBank 中登录的EHEC EDL933 的stx1 基 因、stx2 基 因、rfbE 基 因、fusR 基因和n5512 基因,采用CloneManager 软件设计5 对特异性引物(表1),引物由吉林省库美生物科技有限公司合成。
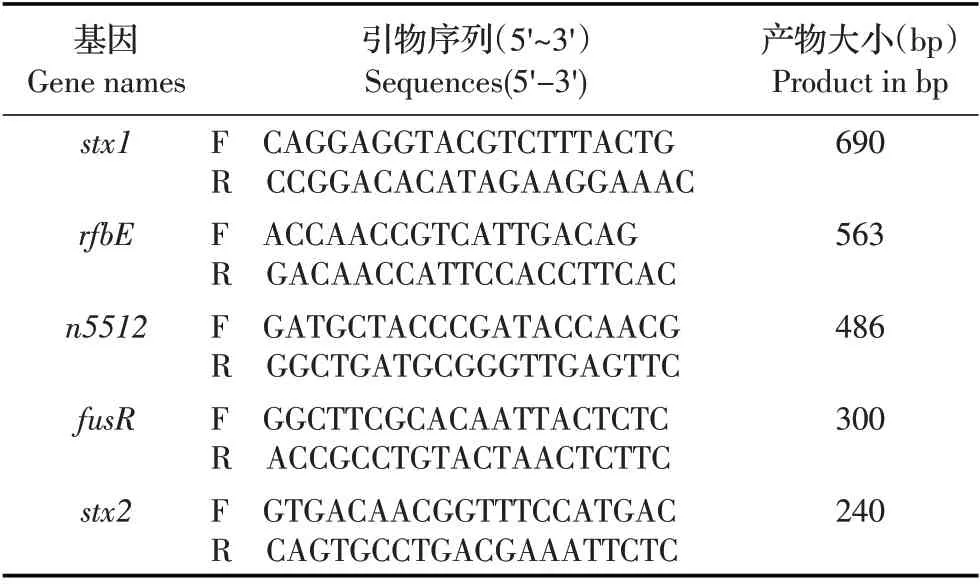
表1 PCR 引物信息Table 1 Information about the PCR primers
1.4 基因组DNA的制备 利用细菌基因组DNA 提取试剂盒分别提取本研究涉及的EDL933、BuyATCC、HBWH、HVRI、XUZ-1、NongB、ETEC-1、EPEC、M22-5、Salmonella LT2、pstb各细菌基因组DNA。
1.5 多重PCR 反应条件的优化 以EHEC O157 EDL933 株基因组DNA 为模板, 采用方阵试验(表2),对PCR引物浓度进行优化;退火温度设定为比引物的Tm值低5度。由此,确定最佳的PCR反应条件。
1.6 多重PCR 特异性试验 利用优化的PCR 反应体系对提取的各病原基因组DNA 进行扩增,以不添加模板为阴性对照,EDL933 模板为阳性对照,检测多重PCR 体系的特异性。
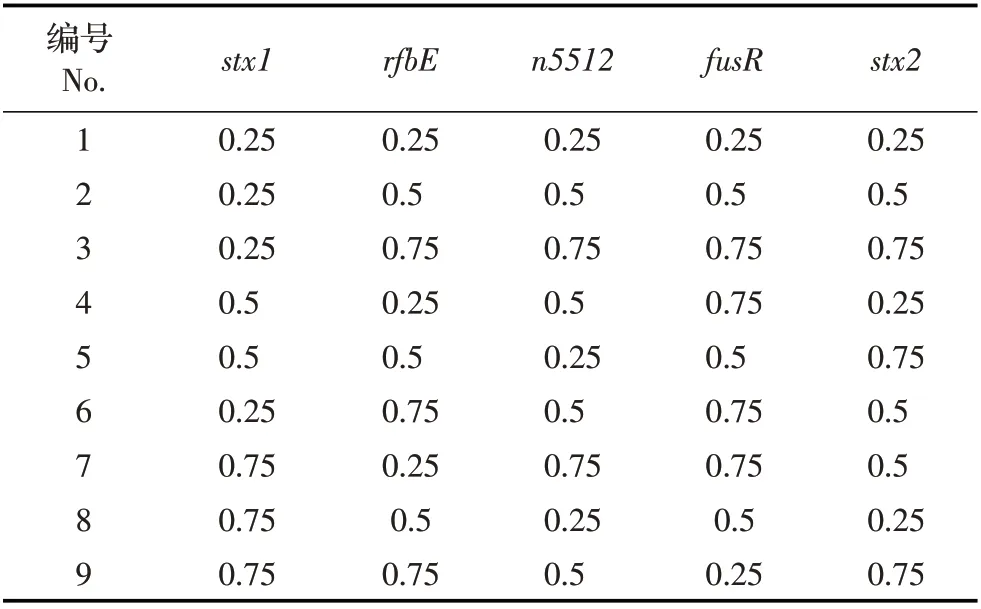
表2 正交试验优化引物浓度Table 2 Optimization of primer concentrations using an orthogonal test
1.7 多重PCR 敏感性试验
1.7.1 以细菌培养物为模板的多重PCR 敏感性试验将对数生长期EDL933 和BuyATCC 菌液的初始浓度调至5×106cfu/mL,依次10倍稀释至5×101cfu/mL。将稀释好的菌液100 ℃水浴10 min,12 000 r/min 离心2 min,取2 μL 上清液做模板。按已优化好的反应条件和反应体系进行多重PCR 扩增,PCR 产物经1.8%琼脂糖凝胶电泳检测,检测本实验建立的多重PCR反应的敏感性。
1.7.2 以基因组DNA 为模板的多重PCR 敏感性试验 将提取的EDL933 DNA 通过分光光度计测定浓度后,利用灭菌双蒸水对模板分别进行10 倍梯度稀释,由2.27×101ng/μL 稀释至2.27×10-10ng/μL。以稀释好的DNA 为模板,按已优化的反应条件和反应体系进行多重PCR 扩增, PCR 产物经1.8%琼脂糖凝胶电泳检测,检测本实验建立的多重PCR 反应的敏感性。
1.8 多重PCR的重复性试验 利用本研究建立的多重PCR方法,每2周检测一次EDL933 DNA模板,并连续检测2 个月,以检测该多重PCR 检测方法的稳定性。
1.9 多重PCR 方法对人工染菌样品中EHEC O157的检测
1.9.1 饲料、土壤、牛肉、废水样品集菌后与增菌后的多重PCR 检测 集菌法:将菌悬液由108cfu/mL进行10 倍梯度稀释后取各浓度菌液40 μL,分别人工接种于10 g 无菌饲料、10 g 无菌土壤、5 g 无菌牛肉、10 mL 无菌废水中,加入30 mL 灭菌水,充分震荡后静置10 min,取上清1 000 r/min 离心5 min,取上清,5 000 r/min 离心5 min,弃去上清,200 μL 灭菌水重悬菌体沉淀,100 ℃水浴10 min,12 000 r/min离心2 min,取2 μL 上清液做为模板,进行多重PCR 扩增。
增菌法:将菌悬液由103cfu/mL 进行10 倍梯度稀释后各浓度菌液取40 μL 分别人工接种于10 g 无菌饲料、10 g 无菌土壤、5 g 无菌牛肉、或10 mL 无菌废水中,处理步骤同上直到得到菌体沉淀,加入10 mL 液体LB 重悬沉淀,37 ℃培养8 h~12 h。取1 mL 增菌液12 000 r/min 离心2min,取2 μL 上清液做为模板,进行多重PCR 扩增。
1.9.2 粪便样品集菌后与增菌后的多重PCR 检测将EDL933 菌液于LB 液体培养基中37 ℃过夜培养,5000 r/min 离心5 min 收集菌体,灭菌水重悬沉淀,通过灌胃接种SPF BALB/c 小鼠,48 h 和72 h 后分别收集小鼠粪便。
集菌法与增菌法:将10 g 饲料改为1 g 小鼠粪便,其它处理方法同1.9.1。以1.9.1 方法制备模板并进行多重PCR 扩增。
1.9.3 样品检测限的计算 检测限(cfu/g)=

2 结 果
2.1 多重PCR 反应优化结果 以EHEC O157 的临床分离株EDL933 的基因组DNA 为模板,对各引物浓度进行优化,结果显示,各个引物的添加量分别为stx1 上 下 游 引 物 各0.5 μL(0.25 μmol/L)、stx2 和n5512 上下游引物各1 μL(0.5 μmol/L)、rfbE 和fusR上下游引物各1.5 μL(0.75 μmol/L);反应程序为:94 ℃5 min;94 ℃30 s、52.3 ℃30 s、72 ℃1 min,共32 个循环;72 ℃5 min。
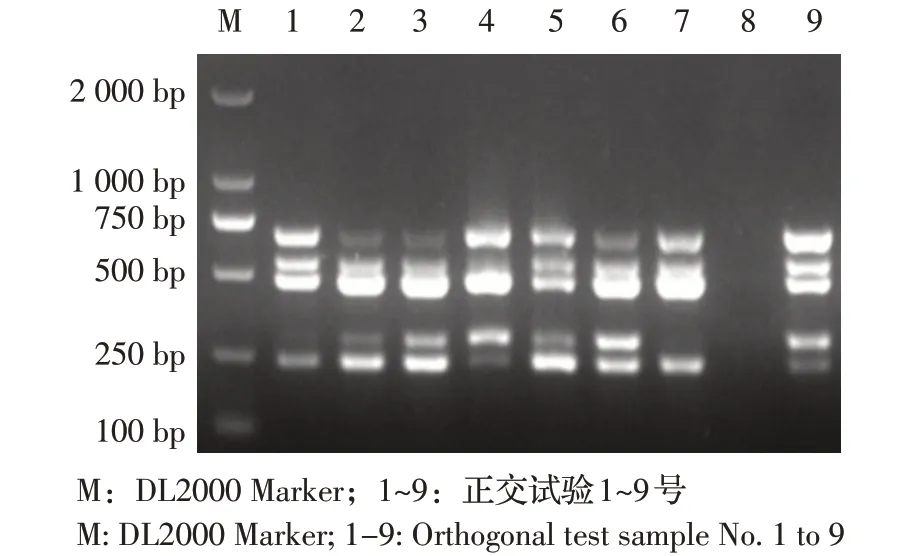
图1 引物浓度的L9(53)正交试验结果Fig.1 L9(53)orthogonal test on primer concentrations
2.2 多重PCR 特异性试验结果 利用已优化的多重PCR 反应体系对各菌株进行检测,结果显示,6 株为EHEC O157,HBWH 和NongB 只 有stx2 而 没 有stx1,HVRI 和XUZ-1 只有stx1 而无stx2;EDL933 和BuyATCC带有全部5 个基因;其它病原无扩增条带(图2)。表明本实验建立的多重PCR 体系特异性较强。
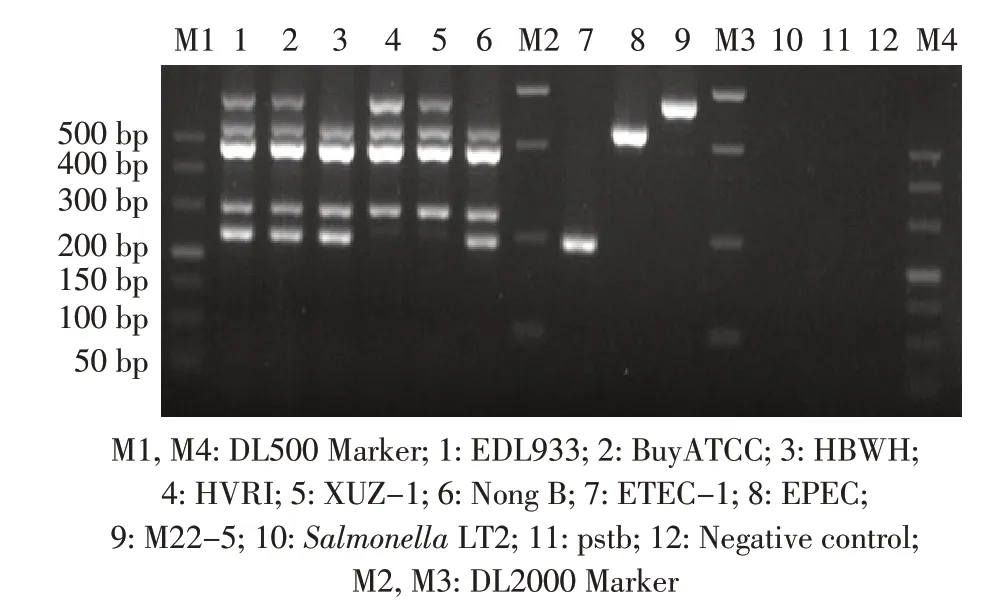
图2 多重PCR 特异性试验结果Fig.2 Specificity of the multiplex PCR method using various bacterial strains as templates
2.3 多重PCR 敏感性试验结果
2.3.1 以细菌培养物为模板的多重PCR 敏感性试验结果 对梯度稀释的EDL933 和BuyATCC 菌液进行多重PCR 检测,结果显示,在104cfu/mL(相当于PCR 反应有约200 cfu)时,仍能够扩增出相应的目的条带(图3),表明本实验建立的多重PCR 方法对细菌培养物的检测敏感性较好。
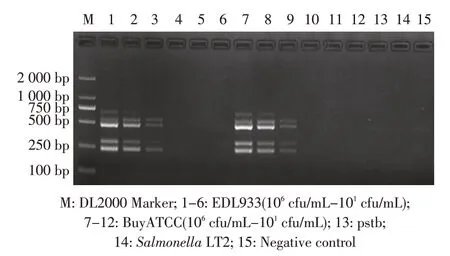
图3 菌液PCR 敏感性试验结果Fig.3 Bacterial fluid PCR sensitivity of the multiplex PCR method using boiled bacteria
2.3.2 以基因组DNA 为模板的多重PCR 敏感性试验结果 以梯度稀释的EDL933 基因组DNA 为模板进行多重PCR 检测,结果显示,多重PCR 的检测限约为2.27×10-2ng/μL(PCR 体系内模板约为1 pg)(图4),表明本实验建立的多重PCR 方法对DNA 的检测敏感性较好。
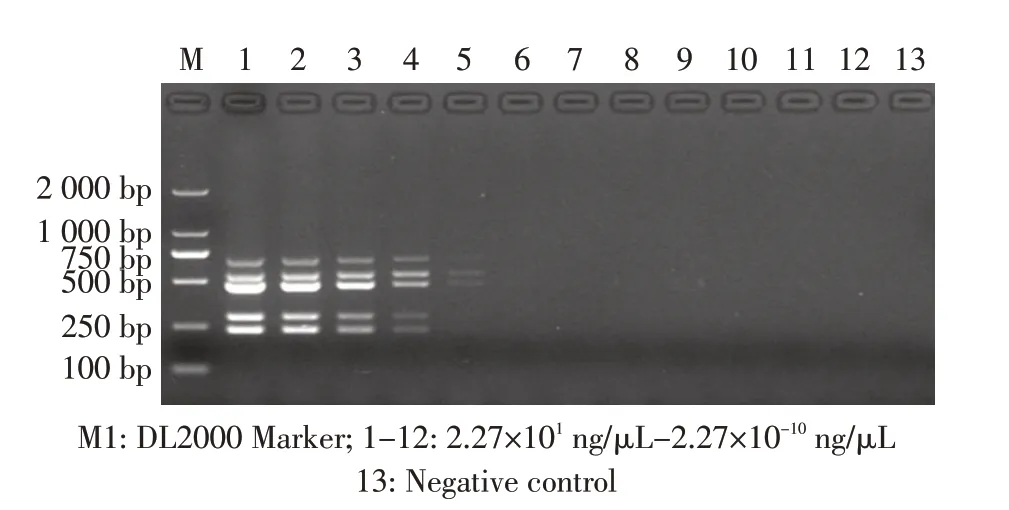
图4 基因组DNA 敏感性试验结果Fig.4 Genomic DNA sensitivity test results
2.4 多重PCR 重复性试验结果 利用已优化的多重PCR 反应体系及反应条件进行了多次重复试验,均能够清晰的扩增出相应的目的片段,表明本实验建立的多重PCR 方法具有较好的稳定性。
2.5 人工染菌样品中EHEC O157 的检测 人工染菌饲料样品经集菌制备的模板,多重PCR 检测限为4×103cfu/g,增菌培养后多重PCR 的检测限为4×10-4cfu/g;人工染菌土壤样品经集菌制备的模板,多重PCR 检测限为4×103cfu/g,增菌培养后多重PCR 的检测限为4×10-2cfu/g;人工染菌牛肉样品经集菌制备的模板,多重PCR 检测限为8×10-1cfu/g,增菌培养后多重PCR 的检测限为8×10-3cfu/g;人工染菌废水样品经集菌制备的模板,多重PCR 检测限为4×103cfu/mL,增菌培养后多重PCR 的检测限为4×10-3cfu/mL;人为感染EHEC O157 小鼠的粪便,也能够通过多重PCR 方法对细菌成功检出,而增菌前、对照组和阴性对照均为阴性结果(图5)。表明将样品进行增菌处理后,利用该方法检测其敏感性、特异性和稳定性均良好,可应用于检测已污染EHEC O157 的多种样品。
3 讨 论
多重PCR 是检测病原菌的常用方法。在建立方法时,靶标的选择至关重要。对于EHEC O157 来说,毒力因子的研究已经有很多,常用的靶标基因有rfbE(O157 菌体抗原基因)、fliC(H7 鞭毛抗原基因)、eaeA(紧密素基因)、ehx(pO157 溶血素基因)和stx2(Vero 毒素2 基因)等[6-7]。根据报道,志贺氏毒素stx1 和stx2 是最重要的毒力因子,与致病程度直接相关,EHEC O157 可能带有两者之一或都有。而三型分泌系统编码的eae,则存在于其它的致病型中,如EPEC[8]。pO157 质粒编码的溶血素基因ehx,也存在于其它血清型,如O111 和O8 中[9]。所以,eae 和ehx 并不是最理想的靶标。本研究所建立的多重PCR 方法,包含了经典的rfbE、stx1 和stx2 基因。此外,该方法还包括了最近报道的应答调控因子编码基因fusR 和n5512,这两个基因除了与O157高度相关之外,还负责调控细菌毒力,是EHEC O157 在肠道定殖的关键基因[4-5]。由于fusR 和n5512在O157 的祖先O55 血清型中也有偶尔检出[10],所以单独检测fusR 和/或n5512 都有可能造成误判;而且细菌间的基因水平转移使得检测单个基因具有较大误判风险。因此,这5 个基因的组合不仅能有效的鉴定O157 血清型,还有助于了解毒力。
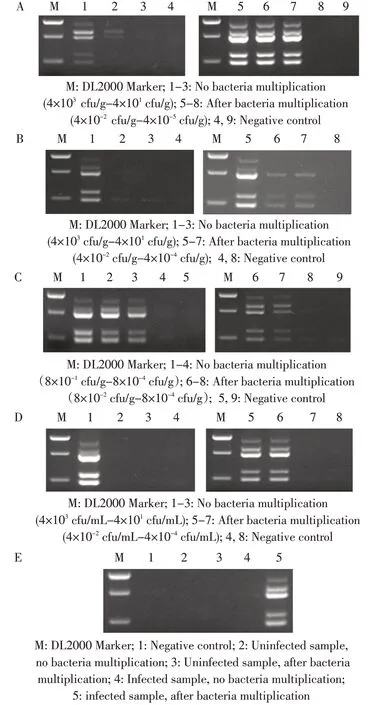
图5 人工染菌饲料(A)、土壤(B)、牛肉(C)、废水(D)及感染EHEC O157 小鼠粪便(E)的多重PCR 检测Fig.5 Multiplex PCR detection of EHEC O157 in artificially contaminated animal feed(A),soil(B),beef(C),waste water(D),and feces from infected mice(E)
经实验验证发现,该PCR 体系对EHEC O157 的检测具有很强的特异性:首先,可以区分含有stx1和/或stx2 的非O157 大肠杆菌;其次,其它常见的食源性病原菌也可以区分,如沙门氏菌和耶尔森菌。敏感性检测实验结果,与报道的其它方法对比如下:DNA 的检测敏感度显著高于杨小鹃等[11](7.5 ng)和徐晓可等[12](91 ng)的报道;检测CFU 的敏感性略低于纪雪等[13](35 个循环,5×103cfu)报道,可能是由于该PCR 体系的循环数低;但却可降低由于气溶胶等导致的非特异性扩增。此外,为了验证该方法在现地的实用性,本研究还对人工染菌的肉品、饲料、土壤、养殖废水以及肠道定殖EDL933 小鼠的粪便等进行了检测。经增菌后,检测限很低,低于10 个cfu/g,比Nagaraja 研究组报道的类似方法的检测限低约一个数量级[14-15]。但是Nagaraja 研究组利用fliC、stx1、stx2、eae、rfbE 和hlyA 6 个基因用于检测O157∶H7,而且PCR 的反应程序有所不同,只有25个循环。摄入EHEC O157 后被感染的下限约为10 cfu~102cfu,所以该方法完全满足检测要求。综上,本研究建立的检测方法为食源性肠出血性大肠杆菌O157 的防控提供了可靠的工具。
