叠氮溴化丙锭结合荧光定量PCR 测定布鲁氏菌活菌数方法的建立
2020-07-02张士军常恒祯王路鹿翟菲菲鞠丹迪卢士英李岩松柳增善李兆辉任洪林
张士军,常恒祯,王路鹿,翟菲菲,鞠丹迪,胡 盼,卢士英,李岩松,周 玉,柳增善,李兆辉,任洪林
(吉林大学 人兽共患病研究所/人兽共患病研究教育部重点实验室/动物医学学院,吉林 长春 130062)
布鲁氏菌病(Brucellosis)简称“布病”,是由胞内寄生菌--布鲁氏菌(Brucella)引起的人兽共患传染病,可感染人类和多种家畜[1]。患病动物表现出盗汗、关节疼痛、怀孕母畜流产、公畜睾丸炎等临床症状,导致重大的经济损失和严重的公共卫生安全问题,我国将其列为乙类传染病[2-3]。随着布鲁氏菌致病机致研究的开展,探究布鲁氏菌在宿主体内或胞内生存状态、数量及其与宿主平衡关系愈来愈重要,特别是机体内或胞内是否存在活布鲁氏菌及其数量已经成为评估布鲁氏菌毒力[4]、布病感染以及疫苗免疫效果[5]的重要指标之一。目前主要以平板计数法测定布鲁氏菌活菌数,但该方法耗时、工作量大、结果往往因个人主观因素造成较大误差[6],而且体内或胞内的非可培养状态(Viable but not culturable,VBNC)的细菌也不能在常规的培养条件下生长[7-8]。因此需要建立一种快速、准确、简便的测定布鲁氏菌活菌数的方法。
叠氮溴化丙锭(Propidium monoazide,PMA)是一种能与DNA 分子结合的染料,该染料可以进入DNA分子的小沟中,在光的作用下使PMA 分解产生一种氮烯类物质与DNA 分子发生共价交联反应,这种共价交联物可抑制DNA 的PCR 扩增[9]。死亡后细菌的膜完整结构破坏, PMA 可以透过受损细胞膜与死亡菌的DNA 结合,从而抑制对其DNA 的PCR 扩增,而此时PCR 只能扩增出活菌的基因,从而实现对活菌的检测[10]。布鲁氏菌外膜蛋白31(Brucella cell surface protein 31 ku,bcsp31)是其重要的外膜结构蛋白,Baily 等人证明编码该蛋白的基因(bcsp31)存在于不同种的布鲁氏菌中,Mayfield 等人曾对该基因进行了克隆和测序,证明该基因在布鲁氏菌属中较为保守,因而利用其能鉴别所有种的布鲁氏菌[11-13]。也有研究者将bcsp31 基因作为检测布鲁氏菌的重要靶分子[14]。基于此,本研究将PMA 与qPCR 技术相结合,以布鲁氏菌bcsp31 基因为检测靶标,建立测定布鲁氏菌活菌数的叠氮溴化丙锭--荧光定量PCR(PMA-qPCR)方法,以期为胞内布鲁氏菌活菌数测定和其它评估布鲁氏菌活菌数的相关领域工作,提供一种快速检测方法。
1 材料与方法
1.1 菌株及细胞 猪种布鲁氏菌弱毒株S2(Brucella suis S2 CVCC 22)、大肠杆菌模式株(Escherichia coli CMCC 44817)、沙门氏菌(Salmonella typhimurium CGMCC 1.1194)、小肠结肠炎耶氏菌(Yersinia enteroco⁃litica CMCC 52208)、副溶血弧菌(Vibrio parahemolyti⁃cus CGMCC 1.1616)、小鼠巨噬细胞RAW 264.7 由吉林大学人兽共患病研究所细菌病研究室保存。
1.2 主要试剂 细菌基因组DNA 提取试剂盒、质粒小提纯化试剂盒购自天根生物技术有限公司;PMA 购 自Biotium 公 司;Fast Start Universal SYBR Green Master(Rox)购自Roche 公司;布氏肉汤培养基购自青岛日水生物技术有限公司;Triton X-100购自上海生工技术有限公司。
1.3 重组质粒标准品的制备、鉴定及标准曲线的建立 利用细菌基因组DNA 提取试剂盒提取布鲁氏菌弱毒株S2 基因组,利用酶标仪检测其浓度,-20 ℃保存备用。根据牛种布鲁氏菌(B.abortus)外膜蛋白基因bcsp31(M20404.1)序列,利用Premier Primer 5 设计1 对特异性引物:5'-AAACATCAAATCGGTCGC-3'/5'-CCGCCCACAAAGAAATAG-3',预期扩增片段长度为200 bp,引物由长春库美生物科技有限公司合成。以提取的S2基因组为模板,采用上述引物PCR扩增目的片段,PCR产物回收纯化后克隆至pMD18-T载体,构建重组质粒,对其进行PCR 及测序鉴定,将鉴定正确的重组质粒测定其浓度,并按公式换算成相应拷贝数:拷贝数=浓度(ng/μL)×阿佛加德罗常数(NA)×10-9/(660×重组质粒的碱基数),作为质粒标准品保存备用。以该质粒标准品做为模板,将退火温度在为50 ℃~60 ℃、引物浓度在0.25 μmol/L~0.75 μmol/L 进行qPCR反应条件的优化,将质粒标准品10 倍倍比稀释后(101~107)分别作为模板,利用优化好的反应条件进行qPCR 扩增,每个浓度重复3次。以质粒标准品拷贝数的对数值为横坐标,以到达阈值的平均循环数(Threshold cycle,Ct)为纵坐标绘制标准曲线,并根据公式:E=10-1/k-1(k 为标准曲线的斜率),算出其扩增效率E。
1.4 PMA 对布鲁氏菌S2 处理条件的优化 PMA 与布鲁氏菌DNA 的结合与曝光时间与PMA 的浓度有关,所以对其曝光时间及浓度进行优化:①取7 份相同浓度热致死的布鲁氏菌S2 菌液各500 μL,其中1份不加PMA 做对照,其余6 份分别加入PMA 使其终浓度为15 μg/mL,用650 W 卤素灯分别对样品经不同时间(0、5 min、10 min、15 min、20 min、25 min)曝光后,经建立的PMA-qPCR 方法检测,以确定最佳曝光时间。②取7 份相同浓度热至死的布鲁氏菌S2菌液各500 μL,分别加入不同浓度的(0、5 μg/mL、10 μg/mL、15 μg/mL、20 μg/mL、25 μg/mL、30 μg/mL)PMA,按照最佳曝光时间处理,经建立的PMAqPCR 方法检测,确定PMA 能够完全抑制死菌DNA扩增的最佳浓度。③取6 份同浓度的S2 活菌菌液各500 μL,分别加入不同浓度的(0、5 μg/mL、10 μg/mL、15 μg/mL、20 μg/mL、25 μg/mL)PMA,按照最佳曝光时间处理,经建立的PMA-qPCR 方法检测,以确定不影响活菌DNA扩增的最佳PMA浓度。
1.5 PMA-qPCR 方法的特异性试验 分别利用PMA 最佳条件处理并提取大肠杆菌、沙门氏菌、小肠结肠炎耶氏菌、副溶血弧菌、S2 株的基因组作为模板,按照本研究建立的PMA-qPCR 方法扩增,设无RNase 水为阴性对照,重组质粒标准品作为阳性对照;同时利用1.3 的引物进行常规PCR 扩增,评估本研究建立的PMA-qPCR方法的特异性。
1.6 PMA-qPCR 方法的敏感性试验 按照PMA 最佳条件处理2.0×108cfu/mL 的S2 活菌菌液后,提取其基因组DNA,将其10 倍倍比稀释(2.0×108cfu/mL~2.0×10-1cfu/mL)后分别作为模板,进行PMA-qPCR扩增;同时提取未经PMA 处理过的相同浓度的S2活菌基因组,10 倍倍比稀释后作为模板,进行常规qPCR 扩 增;利 用1.3 的 引 物,经 常 规PCR 对 上 述PMA 处理过的各稀释度菌液基因组进行扩增,评估建立的PMA-qPCR 方法的敏感性。
1.7 PMA-qPCR方法的重复性试验 按照PMA最佳条件处理2.0×108cfu/mL S2活菌菌液,分3批次提取其基因组,均将其10 倍倍比稀释(2.0×108cfu/mL~2.0×10-1cfu/mL)。选择同批次提取的浓度为105cfu/mL~107cfu/mL 的S2 菌液基因组DNA 作为模板进行批内重复性试验,试验重复3 次,计算批内变异系数(CV);选择不同批次浓度为105cfu/mL~107cfu/mL 的S2 菌液基因组DNA 作为模板进行批间重复性试验,试验重复3 次,计算批间变异系数(CV),评估本研究建立的PMA-qPCR方法的重复性。
1.8 PMA-qPCR 对不同比例的S2 活菌数的测定将浓度为6.5×108cfu/mL 的S2 活菌和死菌菌液按活菌占比为0、10%、30%、50%、70%、100%的比例混合,取各混合菌液1 mL 加入15 μg/mL 的PMA 经10 min 曝光处理后提取混合菌液基因组DNA 进行PMA-qPCR 定量检测,同时以不加PMA 处理的各混合菌液样品经常规qPCR 定量检测,比较二者的检测结果。
1.9 PMA-qPCR 法与平板计数法对S2 菌液及巨噬细胞内活菌数量的测定 以TSB 培养基培养S2,提取其基因组后分别利用PMA-qPCR 和平板计数法测定未知浓度的S2 菌液浓度,随后进行细胞侵染试验:将小鼠巨噬细胞RAW 264.7 接种于12 孔细胞培养板,12 h 后换无抗培养基培养1 h,分为A 和B 两组,每组6 个孔(其中3 个孔做PMA-qPCR 扩增,另外3 个孔做平板计数),A 组感染500 μL 浓度为1.28×1012cfu/mL 的S2 菌液,B 组感染500 μL 浓度为0.64×1012cfu/mL 的S2 菌 液,感 染1 h 后,经Triton X-100 裂解细胞,释放出胞内的布鲁氏菌,经最佳条件的PMA 处理后,提取布鲁氏菌基因组作为模板,利用PMA-qPCR 测定胞内布鲁氏菌活菌,将所得Ct 值带入构建的标准曲线,计算出活菌基因组拷贝数,再根据体系中模板的体积,换算出样品中的活菌浓度;同时利用平板计数法对细胞裂解后的胞内布鲁氏菌活菌数进行测定,并将两种方法得出的活菌数进行统计分析。
1.10 数据的统计分析 利用SPSS 19.0 统计分析试验数据,经t 检验,当p<0.05 时差异显著,p>0.05 时无显著差异。
2 结 果
2.1 质粒标准品的构建和标准曲线的建立 以布鲁氏菌S2 基因组为模板,使用1.3 中合成的引物进行PCR 扩增。结果显示,扩增的目的片段长度约为200 bp,与预期结果相符(图略);构建的重组质粒标准品pMD-18T-bcsp31 经PCR 鉴定结果显示,扩增出大小约为200 bp 的目的条带。测序结果也显示,插入的bcsp31 基因序列正确,表明正确构建重组质粒标准品。重组质粒经测定浓度为398.408 ng/μL;经公式换算得出约为6.28×1010拷贝/μL。
2.2 qPCR 方法的优化及标准曲线的建立 优化后的qPCR 反应体系为20 μL:Fast Start Universal SYBR Green Master(Rox)10 μL,模板2 μL,上下游引物各1 μL(10 μmol/L),ddH2O 6 μL;优化后的反应程序 为: 94 ℃2 min, 94 ℃45 s, 55 ℃30 s, 72 ℃32 s,40 个循环。以不同稀释度的质粒标准品为模板经优化后的qPCR 方法扩增获得该方法的标准曲线(图1),其回归方程为:y=-3.492 x+36.303,其中y 代表Ct 值,x 代表基因拷贝数的对数值;R2=0.999,所构建的标准曲线Ct 值与拷贝数的对数值之间的线性关系良好,根据公式算得扩增效率为93.36%。
2.3 最佳PMA 处理条件的优化结果 对PMA 的最佳曝光时间、最适浓度进行优化。不同曝光时间结果显示,随着曝光时间的延长,Ct 值不断增大,当曝光时间≥10 min 时各个曝光时间点的Ct 值均无显著差异(p>0.05)(图2A);不同浓度PMA 对热致死菌作用的结果显示,随着PMA 浓度的增大,扩增的Ct 值不断增大,但当浓度为≥15 μg/mL 时,目的基因无扩增表明PMA 完全抑制了热致死菌的DNA 扩增(图2B);PMA 对活菌作用的结果显示,当PMA 浓度在0~15 μg/mL时,S2基因组扩增的Ct值均无显著差异(p>0.05),当PMA浓度继续增大时,Ct值明显增高(图2C),表明较高浓度的PMA 会影响对活菌DNA 的PCR扩增。综合上述结果,最终将PMA最佳曝光时间确定为10 min,最适浓度确定为15 μg/mL。

图1 qPCR 的标准曲线Fig.1 The standard curve for qPCR based on the template of recombinant plasmid standard pMD-18T-bcsp31

图2 PMA 处理条件的优化结果Fig.2 Optimization results of PMA treatment conditions
2.4 特异性试验结果 以提取PMA 处理过的大肠杆菌、沙门氏菌、小肠结肠炎耶氏菌、副溶血弧菌、S2 菌株的基因组为模板,以质粒标准品为阳性对照,无RNase 水为阴性对照,利用本研究建立的PMA-qPCR 方法进行扩增。结果显示,除了S2 菌株与质粒标准品有特异性扩增外,其余菌株及无RNase 水均呈无扩增(图3A)。并对扩增产物进行熔解曲线分析,当Tm 值在87.87 ℃~88.36 ℃时熔解曲线呈单一熔解峰,无引物二聚体和非特异性扩增(图3B),同时常规PCR 结果也与PMA-qPCR 结果一致(图3C)。表明本研究建立的PMA-qPCR 方法特异性较强。
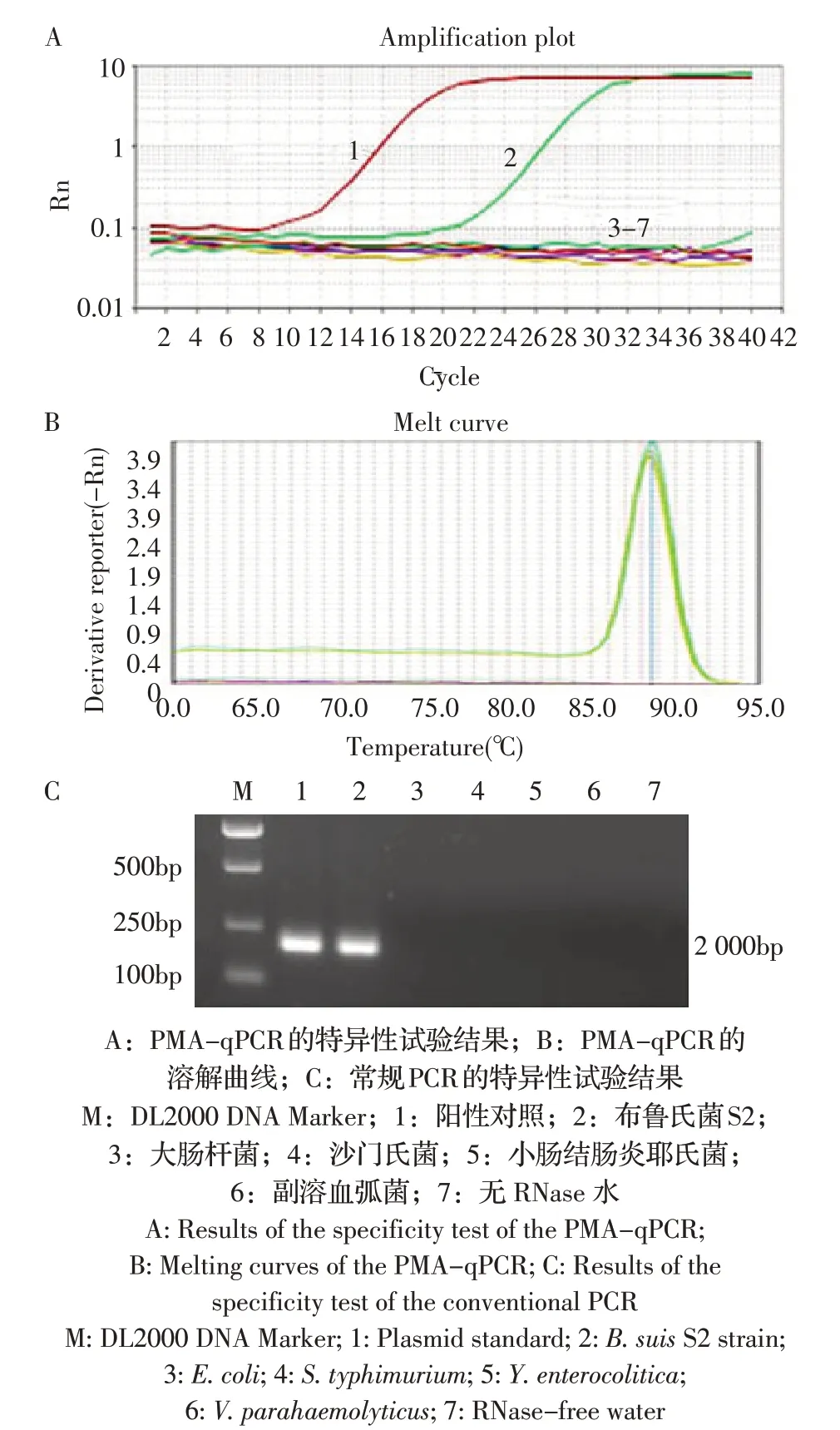
图3 PMA-qPCR 的特异性试验结果Fig.3 Results of the specificity test of the PMA-qPCR
2.5 敏感性试验结果 提取PMA 处理过的S2 菌株基因组,10 倍倍比稀释后作为模板,采用PMA-qP⁃CR 扩增。结果显示,当菌液浓度在2.0×103cfu/mL~2.0×108cfu/mL 范 围 内,布 鲁 氏 菌S2 经PMA 处 理(PMA-qPCR 方法检测)和未经处理(常规qPCR 检测)的扩增曲线基本吻合(图3A)。敏感性试验结果显示,PMA-qPCR 的敏感性为103cfu/mL(图4A)。常规PCR 扩增PMA 处理过的布鲁氏菌S2 基因组结果显示,其敏感性为105cfu/mL(图4B),PMA-qPCR 敏感性是常规PCR 的100 倍。表明本研究建立的方法可对布鲁氏菌活菌数进行准确定量,且一定浓度的PMA 不对qPCR 的扩增造成干扰。
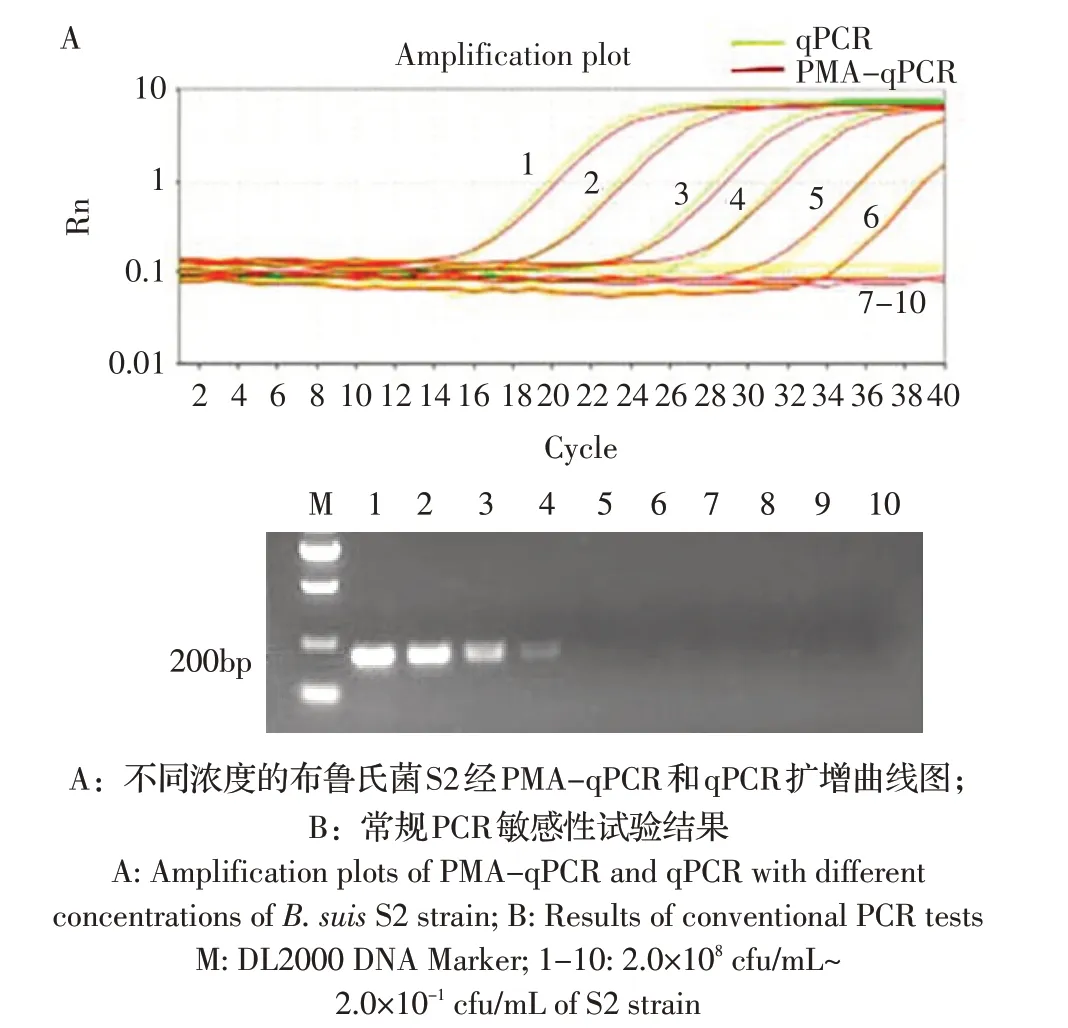
图4 PMA-qPCR 的敏感性试验结果Fig.4 Sensitivity test of the PMA-qPCR
2.6 重复性试验结果 选择105cfu/mL、106cfu/mL、107cfu/mL 3 个稀释度的S2 菌液DNA 进行批内及批间重复性试验,根据平均Ct 值及标准偏差(SD)计算批内及批间重复性试验的变异系数(CV)。结果显示,批内及批间重复性试验的变异系数均为0.63%~2.04%(表1),表明PMA-qPCR的稳定性、重复性较好。

表1 PMA-qPCR 的重复性试验结果Table 1 Repeatability test of the PMA-qPCR
2.7 PMA-qPCR 对不同比例的S2 活菌数的检测结果 将已知浓度的S2 活菌与死菌按不同比例混合并经PMA 处理后,提取不同比例的混合菌液基因组作为模板,进行PMA-qPCR 扩增,同时以不加PMA处理的样品作对照(qPCR 扩增)。结果显示,随着活菌比例的增高,PMA-qPCR 的Ct 值逐渐降低,但均高于未经PMA 处理过的qPCR 的Ct 值,当活菌含量为100%时,二者Ct 值无明显差异(p>0.05);可见随着活菌比例逐渐增大至100%时,PMA-qPCR 检测结果与qPCR 检测结果也更接近(图5),表明PMA有效抑制了样品中死菌DNA 的扩增,同时也表明一定浓度的PMA 对活菌检测无影响,且PMA-qPCR 方法可对活菌数进行准确定量。
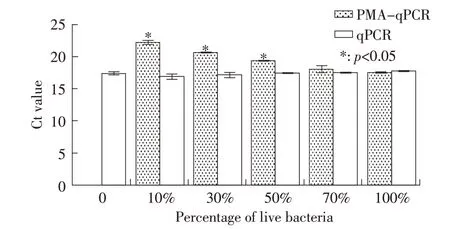
图5 PMA-qPCR 对不同比例的S2 活菌数的检测结果Fig.5 Results of different proportions of viable B.suis S2 detected by PMA-qPCR
2.8 PMA-qPCR 与平板计数法对S2 菌液及巨噬细胞内活菌数量的测定结果 采用PMA-qPCR 与平板计数法分别测定S2 菌液的浓度。结果显示,PMA-qPCR 测得菌液浓度为2.69×107cfu/mL,平板计数法测得菌液浓度为2.28×107cfu/mL,两种方法测得菌液浓度数量级吻合且差异不显著(p=0.07);随后采用这两种方法分别对感染不同浓度S2 活菌(1.28×1012cfu/mL、 0.64×1012cfu/mL)的小鼠巨噬细胞内的活菌数进行测定,利用所建立的标准曲线换算得出活菌数,并统计分析。结果显示, A 组胞内活菌数经PMA-qPCR 法与平板计数法测得结果分别为3.24×104cfu/mL 和1.17×104cfu/mL,二者结果差异显著(p=0.048);B 组胞内活菌数经两种方法测得结果分别为8.82×103cfu/mL 和1.2×103cfu/mL,二者结果仍差异显著(p=0.042),但两组经这两种方法测得的活菌数在一个数量级并与侵染的活菌数呈正相关,且活菌数量变化趋势一致(图6)。表明所建立的PMA-qPCR 方法可对样品中布鲁氏菌活菌数进行简便快速地定量检测。
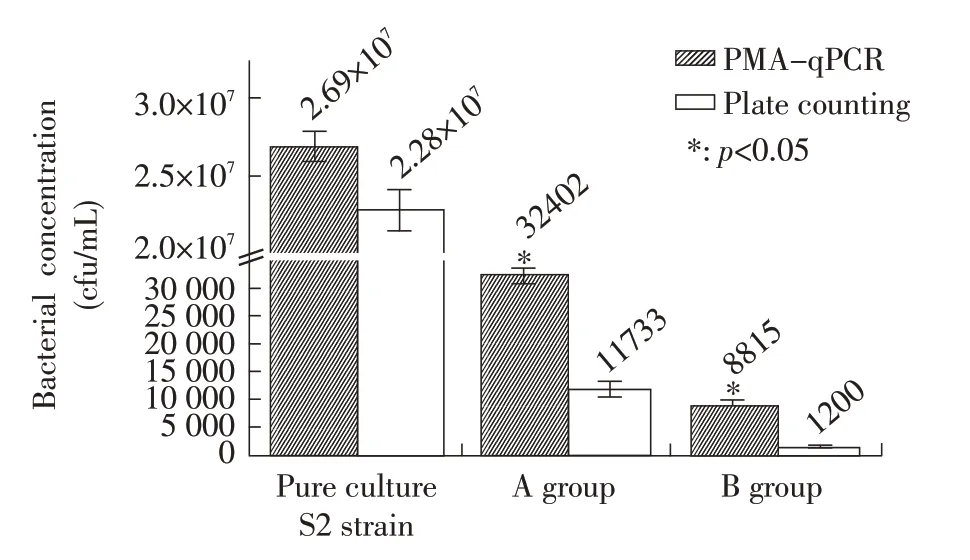
图6 PMA-qPCR 法与平板计数法对布鲁氏菌S2 菌液及巨噬细胞内的活菌数的测定结果(单位:cfu/mL)Fig.6 Result of determination of the amount of the viable B.suis S2 strain in bacterial suspensions and within macrophages by PMA-qPCR and plate counting(Unit:cfu/mL)
3 讨 论
细菌的分离鉴定作为检测布鲁氏菌的“金标准”存在着耗时,操作危险的缺点;布鲁氏菌的血清学检测方法有虎红平板凝集试验(RBT)、乳牛全乳环状试验(MRT)、试管凝集试验(SAT)、补体结合试验(CFT)等,这些方法敏感性、特异性较强,但存在假阳性等缺点[15];其分子生物学检测方法主要为PCR 及其衍生技术,但常规PCR 方法只能根据产物量推算起始量,操作易引入系统误差,只能达到半定量[16];而荧光定量PCR 方法可以监测每轮DNA 扩增的荧光信号,达到绝对定量或相对定量的目的,灵敏性和准确性更高,是目前应用较广的定量方法[17]。常用于布鲁氏菌检测的靶基因主要有omp25、16S rDNA、is711、bcsp31 等。bcsp31 为单拷贝基因,被多国学者证实该基因在各个种的布鲁氏菌中均高度保守,可特异、敏感、可靠的用于布鲁氏菌的核酸检测[11]。所以本研究选用bcsp31 基因作为建立PMA-qPCR 方法的靶基因。
布鲁氏菌为胞内寄生菌,被其侵染的细胞经细胞裂解液处理后,胞内活布鲁氏菌仍具有完整细胞膜结构,在细菌质膜的保护下PMA 不能与活布鲁氏菌DNA 结合,从而使得活菌DNA 能够被PCR 扩增;而死亡布鲁氏菌质膜已损坏,PMA 可以穿过其质膜而与该菌DNA 结合,从而抑制死菌DNA 的PCR扩增[18-19]。先前研究表明过高浓度的PMA 对活细菌具有一定的毒性,可以破坏细菌正常的膜结构并与其DNA 结合,从而抑制活菌DNA 的PCR 扩增[18];而与死菌结合后多余的PMA 也会对检测结果产生影响,利用650 W 卤素灯对菌液中的PMA 进行曝光,曝光后的PMA 发生钝化反应而失活,这样就能消除多余PMA 对活菌DNA PCR 扩增的影响。为确保有足够的PMA 能完全结合死菌DNA,又要确保该浓度下的PMA 不会对活菌的扩增造成影响,在PMA的实际应用中往往需要对其作用浓度及曝光时间进行优化[20]。本研究对其优化的结果为PMA 浓度为15 μg/mL,对其曝光时间为10 min,其可最大限度的抑制死菌DNA 的PCR 扩增,又能使活菌DNA 得到有效扩增。
Nogva 等首次将叠氮类染料结合PCR 技术应用于活细菌检测[21],但目前未见将该技术用于测定布鲁氏菌活菌数的研究报道。本研究首次将PMA 与qPCR 结合,经各反应条件与PMA 浓度与曝光时间的优化,建立了用于快速定量测定布鲁氏菌活菌的PMA-qPCR 方法。该方法特异性强,敏感性高,重复性好,可用于布鲁氏菌活菌数的快速定量检测。
本研究又将该方法的实用性做了评估:同时采用PMA-qPCR 和常规qPCR 测定同浓度的布鲁氏菌S2 活菌菌液浓度,结果显示, PMA-qPCR 扩增曲线与qPCR 扩增曲线基本吻合,表明经优化条件处理的PMA 不影响qPCR 对活菌DNA 的扩增;又利用本研究建立的PMA-qPCR 方法与平板计数法分别对TSB 纯培养的布鲁氏菌S2 菌液及其侵染的巨噬细胞胞内布鲁氏菌活菌数进行定量测定,并进行统计分析,结果显示PMA-qPCR 方法与平板计数法对纯培养的S2 活菌的测定结果无显著差异,但利用这两种方法对胞内活菌数的测定结果却差异显著,平板计数法测定值小于PMA-qPCR 的测定值,分析可能有以下原因:1、平板计数结果往往容易受个人主观因素影响造成该方法的结果产生误差;2、Triton X-100 裂解液可能抑制了细菌在平板上的生长;3、感染细胞内部分活布鲁氏菌可能进入VBNC 状态,无法实现体外平板培养出能肉眼可见的菌落[22-24];4、本研究建立的方法为一种绝对定量方法,计算结果依赖于质粒标准品构建的标准曲线,而实际样品成分复杂,导致计算结果存在误差。尽管PMA-qPCR 方法与平板计数法测定的结果差异显著,但二者测定的活菌数量级和变化趋势一致,且均与侵染的布鲁氏菌数量呈正相关。但PMA-qPCR方法测定活菌数量的时间却大大缩短,还可同步实现布鲁氏菌的定性定量检测,具有一定的可应用性,为研发新型布鲁氏菌活菌数快速检测方法做了有意义的探索。
综上,本研究以布鲁氏菌bcsp31 基因为检测靶标,建立了快速定量测定布鲁氏菌活菌数的PMA-qPCR 方法,该方法特异性强、敏感性高、重复性好,可以同步实现布鲁氏菌的定量和定性检测,为布鲁氏菌活菌数快速测定提供了可行方法。
