地方品种鸡ALV-J 的分离鉴定及全基因组序列分析
2020-07-02许默儒钱学智蔡丙严穆晓惠秦爱建
许默儒,钱学智,沈 习,蔡丙严,穆晓惠*,秦爱建*
(1. 江苏农牧科技职业学院,江苏 泰州 225300;2. 扬州大学 兽医学院,江苏 扬州 225009)
禽白血病(Avian leukosis,AL)是AL 病毒(ALV)引起的各种可传播的良性和恶性肿瘤的总称[1]。其主要引起淋巴细胞瘤,髓细胞瘤,血管瘤等肿瘤疾病,虽然死亡率不高,但是能够引起免疫抑制和生产性能下降,给全世界养鸡业造成了严重的经济损失。根据抗体中和试验和env 囊膜蛋白基因等,鸡源ALV 主要分为A、B、E、J 和K 等5 个亚群[2]。除E 亚群为内源性外,其余均为外源性病毒。外源性病毒能够不同程度的引起肿瘤的发生。近年来许多研究表明我国蛋鸡、肉鸡、水禽和野禽均出现ALV-J[4-8],其已成为我国养鸡业面临的新挑战,尤其对我国地方优良鸡种造成威胁。2009 年赵成棣等从北京HR 土鸡中检测到ALV-A 与ALV-J 共感染的情况[9]。2010 年,冷毕丹等发现广西麻鸡,三黄鸡等优良地方鸡种不同程度的感染ALV-J[10]。陈静等对2009 年~2011 年,山东五大地方优质品种鸡群进行流行病学调查,发现5个品种均存在ALV-J的感染[11]。
2013 年苏禽绿壳蛋鸡正式成为国家级蛋鸡新品种,但苏禽绿壳蛋鸡中AL 的流行情况至今未见报道。本研究对苏禽绿壳蛋鸡ALV 进行分离、鉴定和全基因组序列分析,提供了苏禽绿壳蛋鸡ALV 感染的流行病学信息,丰富了ALV 的生物信息数据库。
1 材料与方法
1.1 主要实验材料 23 份肝脏组织无菌采集自江苏省扬州市某苏禽绿壳种鸡场的纯种祖代鸡场具有典型临床症状的成年苏禽绿壳蛋鸡。鸡成纤维细胞系(DF-1)购自中国科学院(上海)细胞库,由本实验室保存;小牛血清、DMEM(sp+)培养基购自Thermo公司;双抗(青霉素/链霉素)购自华北制药股份有限公司;胰蛋白酶购自Sigma 公司;DNA Marker、dNTP 等试剂购自上海生工生物工程技术有限公司;DNA 提取试剂盒购自AXYGEN 公司;禽白血病抗原ELISA 检测试剂盒购自美国IDEXX 公司。
1.2 病毒分离与检测 取无菌采集的肝脏组织200 mg充分研磨后加入PBS 至1 mL,同时加入终浓度为100 U/mL 的氨苄青霉素和链霉素,8 000 r/min 离心5 min,取上清,0.22 μm 滤器过滤后,取上清液接种至长成70%的DF-1 单层细胞,37 ℃孵育2 h,弃上清,PBS 清洗细胞1 次,加入200 μL 1%胎牛血清的生长维持液继续培养7 d。7 d 后取细胞培养板于-20 ℃冻融1 次,收取上清,利用IDEXX 禽白血病抗原ELISA 检测试剂盒进行检测。对阳性细胞进一步利用特异性引物H5/H7[12]鉴定ALV-J 亚群,利用引物H5/AD[11]鉴定ALV-A/B/E/K 亚群。
1.3 引物设计及合成 根据GenBank登录的ALV-J原型株(HPRS-103,Z46390)序列,设计末端相互重叠的3 对引物F1/R1、F2/R2 和F3/R3(表1),分别用于病毒全基因组的1 bp~2 554 bp,2 543 bp~5 263 bp,5 104 bp~7 818 bp 位置的扩增,引物由生工生物工程(上海)股份有限公司合成。
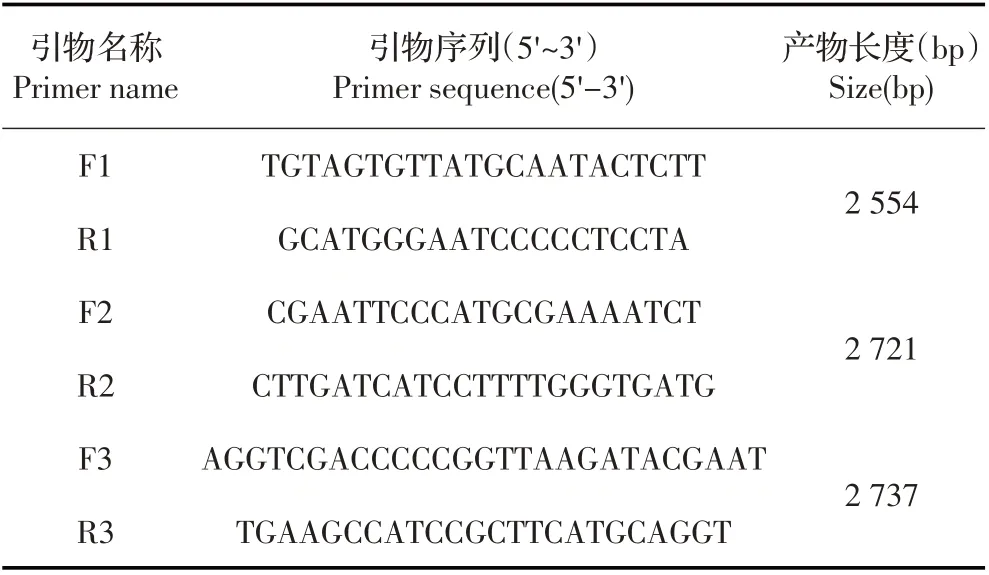
表1 本研究中使用的PCR 引物Table1 PCR primers used in this study
1.4 病毒亚群鉴定与测序 收集200 μL 经1.2 中ELISA 检测阳性的细胞上清,采用苯酚-氯仿法提取前病毒基因组,利用引物H5/H7 检测ALV-J 亚群,引物H5/AD 检测ALV-A/B/E/K 亚群,PCR 反应程序为95 ℃5 min,95 ℃30 s、58 ℃30 s、72 ℃30 s,共30 个循环,72 ℃10 min;利用引物F1/R1、F2/R2 和F3/R3 进行全基因组分段扩增,反应程序为95 ℃5 min,95 ℃1 min、50 ℃2 min、72 ℃3 min,共30个循环,72 ℃10 min。PCR 产物经1%琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司进行测序。
1.5 全基因组序列分析 利用DNAStar 中的SeqMan软件对3 个基因片段的测序结果进行剪辑、拼接。利用Lasergen 7.0 软件的ClusterW 程序对拼接的全基因组序列与GenBank 中已发表的9 株ALV-J 参考株序列进行全基因组序列和env 基因核苷酸和氨基酸序列分析。利用MEGA6.0 软件绘制全基因组和env 基因系统进化树谱(bootstrap 值为1 000)。通过在线预测(http://gene-regulation.com)潜在转录因子结合位点。
2 结 果
2.1 病毒分离鉴定结果 对收集样品经病毒分离培养后利用IDEXX禽白血病抗原ELISA检测试剂盒进行检测,结果显示,23份样品均为阳性,表明分离病毒均为ALV。进一步分别利用引物H5/H7,H5/AD 进行亚群鉴定,结果显示J 亚群特异性引物PCR 扩增的结果为阳性,ALV-A/B/E/K 亚群通用PCR 扩增的结果为阴性(图1)。表明本次分离株为ALV-J 亚群。

图1 ALV-J 亚群PCR 检测电泳图Fig.1 PCR results ofALV-J
2.2 ALV-J 分离株全基因组分析 对分离毒株ALV-J 基因组进行分段扩增后拼接,结果显示其基因全长7 608 bp;与ALV-J 参考毒株的全基因组核苷酸序列比对分析,结果显示,3 个主要结构基因gag、pol、env 长度分别为2 106 bp、2 622 bp 和1 701 bp;3'UTR 长度为553 bp,主要包括rTM、DR-1 和E 元件;3'LTR 长度为314 bp。系统进化分析结果显示,该分离株处在J 亚群分支,与2009 年江苏地区蛋鸡分离毒株JS09GY3 处在同一分支,其中核苷酸同源性为91.2%,氨基酸同源性为93.7%(图2),进一步表明分离病毒为ALV-J,命名为JS18YZ09株。
2.3 ALV-J 分离株5'LTR 基因序列分析 对苏禽绿壳蛋鸡分离毒株JS18YZ09 的5'LTR 进行序列分析,结果显示其与2013 年分离毒株GD13GZ 同源性最高,同源性为96.4%。ALV-J 亚群的5'LTR 主要有325 bp 和314 bp 两种长度,部分2013 年后的分离毒株从110 bp~120 bp 处存在11 bp(GGTATGATCGTA)的碱基缺失。将本研究分离株与其他9 株参考毒株进行比较,可以发现U5 区和R 区相对保守,突变区域主要集中在U3 区。通过在线生物信息学软件分析,结果显示,与2009 年江苏蛋鸡分离毒株JS09GY3相比,苏禽绿壳蛋鸡分离毒株JS18YZ09多形成了5 个转录调控元件alpha-CP1、c-Jun、c-Fos、EFI 和Oct-1,缺 失ENKTF-1、RAR-alph、NF-1、NF-KappaB和Zen-1,并且在其100 bp~110 bp 处缺失的11 bp 附近未发现潜在的motif。值得注意的是,该分离毒株有多至6 个转录调控元件C/EBPalp,这可能与ALV 致病性的变化有关。

图2 JS18YZ09 分离毒株全基因组遗传进化树分析Fig.2 Phylogenetic analysis of whole genome of JS18YZ09 isolate
2.4 ALV-J 分离株env 基因序列分析 env 基因编码囊膜蛋白SU 和TM,是最容易发生突变的结构基因,也是鉴定不同亚群ALV 最主要的基因。ALV-J亚群在遗传进化树上形成一个独立的分支,与其他亚群的同源性只有40%,而J 亚群内部不同毒株的同源性达到88%~96%。对本研究分离的苏禽绿壳蛋鸡ALV-J 毒株JS18YZ09 env 基因分析,结果显示,其env 基因与华南地区分离毒株GD13GZ 亲缘关系较近(图3),核苷酸同源性为95.6%,氨基酸同源性为92.3%。表明JS18YZ09 株的env 基因可能来源于广东的ALV-J 毒株gp85 基因的N68T 和D192N 两个突变导致两个新的糖基化位点的产生,这可能会导致病毒囊膜蛋白表面空间结构的变化,进而引起细胞嗜性发生变化,最终引起不同的临床症状。
2.5 ALV-J 分离株3'UTR 基因序列分析 不同ALV-J 亚群在3'UTR 区域存在不同程度的插入或缺失突变,而这一部分与病毒的复制与表达有很大关系。本研究分离的苏禽绿壳蛋鸡ALV-J毒株JS18YZ09与国内不同时间不同宿主分离到的22 株ALV-J 的3'UTR基因序列进行比对分析,结果显示,不同毒株的3'UTR 基因序列主要存在3 种大范围的缺失:与原型毒株HPRS103 相比,中国境内蛋鸡分离毒株主要 在rTM 和DR 区 域 存 在205 bp(175 bp 在rTM 区域,30 bp 在DR-1 区域)的缺失;2013 年前的肉鸡分离毒株主要在E 元件处存在200 bp 的缺失;而2013 年之后的肉鸡分离株在rTM 区域存在210 bp 左右的缺失,在E 元件处存在175 bp 左右的缺失。而本研究分离的JS18YZ09 毒株,在rTM 和DR 区域存在205 bp 的缺失,与蛋鸡分离毒株亲缘关系较近(图4)。表明,JS18YZ09 毒株的骨架结构可能来源于蛋鸡分离株。
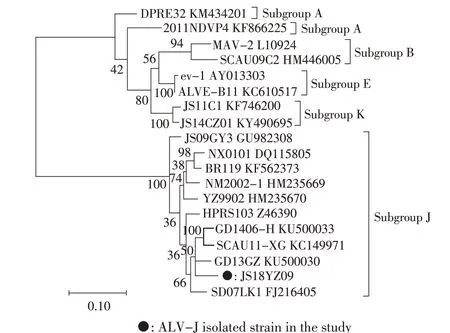
图3 ALV-J 分离毒株env 基因遗传进化树分析Fig.3 Phylogenetic analysis of env gene of ALV-J isolates

图4 ALV-J 分离毒株与其他参考株3'UTR 基因序列分析Fig.4 Sequence analysis of 3'UTR of ALV-J isolated strain and other reference strains
3 讨 论
在国内ALV-J 亚群感染约占所有ALV 感染的70%[13],而且ALV-J 感染宿主范围不断扩大,这可能与病毒不断地重组与突变有关。2010 年高玉龙等分析了近半个中国的ALV 蛋鸡分离株,发现蛋鸡分离株env 基因和UTR 区域基因与肉鸡分离株完全处于不同的进化分支[4]。2013 年,谢青梅等在华南地区肉鸡上分离出一批独特的ALV-J,其在3'LTR 和UTR 区域基因存在大范围的缺失突变[14]。
ALV-JJS09GY3 毒株是2009 年从具有典型血管瘤和髓细胞瘤的褐色商品化蛋鸡中分离到的[15]。全基因组序列比对分析发现,本研究苏禽绿壳蛋鸡分离毒株JS18YZ09 与JS09GY3 分离毒株亲缘关系最近,所有J 亚群毒株中,JS09GY3 毒株和本研究分离毒株与其他分离毒株不在同一个进化分支上,这或许代表了江苏地区蛋鸡毒株的独特性。
LTR 是反转录病毒整合入宿主基因组所特有的结构,也是控制病毒mRNA 转录的关键组分。本研究比对分析发现分离毒株JS18YZ09 5'LTR 的长度为314 bp,与2013 年华南地区肉鸡分离毒株亲缘关系最近,这说明本研究分离毒株的LTR 部分很可能来源于华南地区肉鸡分离毒株。分析LTR 的潜在转录调控因子结合位点,发现314 bp 的LTR 反而比以往的325 bp的LTR多出了3~4个motif,其中C/EBPalp的数量也明显增多。C/EBPalp 是髓过氧化物酶增强子结合蛋白,尤其在脊椎动物的骨髓细胞中大量表达,有研究发现C/EBPalp 与急性髓细胞白血病(AML)的增殖分化关系很大[16]。考虑到髓细胞瘤是ALV-J 感染鸡的一个重要的病理指标,C/EBPalp 是否与ALV-J 的致瘤机制有关,仍然需要进一步研究。
ALV 的env 基因编码的囊膜蛋白通常可以充当病毒入侵时细胞表面受体的配体,其与病毒的致病力,宿主范围等均有密切关系。本研究比较了19 株ALV 的env 基因,其中包括11 株J 亚群和8 株其它亚群,J 亚群毒株的突变主要集中在hr1、hr2 和Vr3 区域。研究表明,hr1 和hr2 区域参与病毒与细胞受体的直接反应,而Vr3 区域负责特异性受体的识别,即决定着宿主的范围[17]。近年来AL 的临床症状主要表现为髓细胞瘤和血管瘤,有研究者认为AL 的临床症状、致瘤性和宿主范围均由env 决定[18]。本研究分离毒株的env 基因与广东肉鸡分离毒株GD14GZ 最为相似,这提示蛋鸡分离毒株或许已经与肉鸡分离毒株发生了重组,且蛋鸡分离毒株拥有肉鸡分离毒株的env 基因。不同分离毒株之间的重组是否会导致临床症状和肿瘤表型的变异仍然需要进一步研究。
3'UTR 由rTM、DR-1 和E 元件组成,与ALV 的表达调控,复制动力学密切相关。研究表明,中国地区的ALV-J 分离毒株在3'UTR 区域主要存在几个大范围的缺失,本研究分离毒株与蛋鸡分离毒株一致,主要在rTM 和DR 区域存在缺失。rTM 区在不同毒株中的缺失不同,其或许不能直接影响ALV 的复制。DR 区域的功能也未知,但其以很保守的形式存在于几乎所有的毒株中[19]。E 元件与病毒的宿主范围和复制均有一定的关系,不同毒株间缺失的大小虽然不尽相同,却始终有一段22 bp 的保守序列,这一保守序列或许在病毒复制方面发挥着关键作用。
本研究从苏禽绿壳蛋鸡中分离得到ALV-J JS18YZ09 毒株,通过对其进行全基因组测序和序列比对分析发现, JS18YZ09 分离毒株很可能是由早些年的蛋鸡分离毒株与近期华南地区的肉鸡分离毒株重组而产生的,该病毒的致病性及对我国肉种鸡、蛋种鸡和本地鸡群的影响目前还不清楚。同时,本研究探究了毒株来源及其变异趋势,对研究病毒的溯源有重要意义。
