口蹄疫病毒IRES RNA 元件与宿主蛋白eEF1a相互作用抑制病毒复制的研究
2020-07-02杨德成刘文明曹志远
赵 博,杨德成,刘文明,曹志远,孙 超,于 力
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
口蹄疫(Foot-and-mouth disease,FMD)是由FMD病毒(FMDV)引起的主要感染牛、羊、猪等偶蹄动物的一种急性、热性、高度接触性传染病[1]。该病的发生与流行不但严重危害畜牧业生产,也严重影响畜产品的进出口贸易。鉴于口蹄疫对世界经济造成的严重危害,世界动物卫生组织(OIE)将其列为必须报告的动物疫病,我国将其列为一类动物疫病。
FMDV 属于微RNA 病毒科(Picornaviridae)口蹄疫病毒属(Aphthovirus)的成员,基因组为单股正链RNA,全长约8.5 kb。FMDV基因组按功能可分为5'非翻译区(5'UTR)、开放阅读框(Open reading frame,ORF)、3'非翻译区(3'UTR)和Poly(A)尾。5'UTR 长约1 300 nt,主要包括S 片段、Poly(C)区段、假结节(PKs)区、以及内部核糖体进入位点(Internal ribo⁃some entry site,IRES)。IRES 长约450 nt,形成多个茎环[2],通过与多种真核翻译起始因子和IRES 反式作用因子(ITAF)结合招募40S 和60S 核糖体亚基,介导病毒蛋白的翻译。近年来,研究者在微RNA 病毒科中发现多种与病毒IRES 相互作用的宿主蛋白,并且表明这些宿主蛋白通过不同方式(影响IRES 的结构和稳定性、影响IRES 对其他蛋白的招募、影响IRES 活性)调控病毒的感染及复制[3]。有报道显示:Gemin5 蛋白通过C 端与FMDV IRES 结合,对PTB 结合产生竞争效应,对IRES 介导的翻译起始起负调节作用[4];erbB-3 结合蛋白1(erbB-3-binding protein 1,Ebp1)与FMDV IRES 结构域3 结合,与PTB 协调促进FMDV IRES 的活性[5-6];IRES 结构域的替换可通过影响病毒蛋白的翻译起始效率改变病毒的毒力和嗜性[7]。一般认为,病毒IRES 元件与宿主细胞蛋白的相互作用影响病毒的复制及感染能力,从而决定病毒的毒力及嗜性。然而,哪些宿主蛋白参与FMDV IRES 介导的翻译以及其在病毒复制周期中的调控作用,知之甚少。
本研究以生物素标记的FMDV IRES RNA 为“诱饵”,通过RNA pulldown 试验联合质谱分析筛选到了与IRES 可能存在特异性结合的宿主蛋白eEF1a,进而采用western blot 和激光共聚焦显微镜观察进一步证实了eEF1a-IRES 相互作用,瞬时过表达eEF1a蛋白结合病毒感染研究发现该蛋白具有抑制FMDV病毒复制的功能。这些结果将为深入研究eEF1a 蛋白在调控IRES 介导的翻译起始及其在FMDV 感染和复制中发挥的生物学功能奠定基础。
1 材料与方法
1.1 细胞系、病毒和质粒 牛肾原代细胞pBK、猪肾细胞IBRS-2 和仓鼠肾细胞BHK-21 均由本实验室保存;O 型FMDV O/YS/CHA/05 株由FMDV 全长cD⁃NA 感染性克隆质粒pYS[8]转染细胞拯救所得;px458质粒由美国麻省理工大学张峰教授惠赠;pVAXIRES 质粒由本实验室构建。pcDNA-HA 真核表达载体由本实验室基于pcDNA3.1(+)改造构建。
1.2 主要试剂 大肠杆菌DH5α感受态细胞、Prim⁃erscript II 反转录酶、Prime STAR®HS DNA 聚合酶和各种限制性核酸内切酶均购自TaKaRa 公司;T4 DNA 连接酶购自NEB 公司;胎牛血清和DMEM 培养基购自Gibico 公司;DynabeadsTMM-280 Streptavidin磁珠购自Invitrogen 公司;Biotin-16-UTP、蛋白酶抑制剂cocktail 和X-treme GENE HP DNA Transfection Reagent 转染试剂均购自Roche 公司;体外转录试剂盒RiboMAXTMLarge Scale RNA Production Systems-T7 kit 购 自Promega 公 司;TRIzol 试 剂 购 自Invitrogen 公司;无缝克隆连接酶购自Vazyme 公司;ECL 发光液购自Millipore 公司;抗O 型FMDV 的单克隆抗体(MAb)4B2 由本实验室制备;鼠源抗β-actin MAb 和鼠源抗HA MAb 均购自Genescript 公司;鼠源抗双链RNA(dsRNA)MAb J2 购自SCICONS 公司;兔源抗eEF1a 抗体购自Proteintech 公司;马抗鼠IgG-HRP 和山羊抗兔IgG-HRP 均购自Cell signaling 公司;山羊抗鼠TRITC 标记IgG(IgG-TRITC)和山羊抗兔FITC 标记IgG(IgG-FITC)均购自Sigma 公司。
1.3 生物素标记IRES RNA pulldown 试验 将含有T7-FMDV IRES 的质粒pVAX-IRES 经EcoR V 酶切线性化后作为体外转录模板,采用RiboMAXTMLarge Scale RNA Production systems-T7 在体外合成非生物标记的FMDV IRES RNA。同时,按照上述方法在体外转录体系中添加4 μL 10 mmol/L Biotin-16-UTP 以合成生物素标记的FMDV IRES RNA。体外转录获得的以上IRES RNA 均经酚-氯仿抽提纯化后置于4 ℃备用。
利用制备的生物素标记和非标记的FMDV IRES RNA 进行pulldown 试验,具体操作为:收集长满单层的BHK-21 细胞于冰上裂解30 min,12 000 r/min离心10 min 后,取上清,加入Egg white avidin 和Yeast tRNA,4 ℃孵育20 min,去除内源性非特异结合蛋白。12 000 r/min,4 ℃,离心10 min 后,取上清,加入200 U/mL RNasin 后分别与纯化的非生物素标记的FMDV IRES RNA 和生物素标记的FMDV IRES RNA 混合,4 ℃孵育2 h,加入链霉亲合素偶联的磁珠,室温孵育15 min。使用磁力架吸附磁珠,洗涤磁珠5 次,去除非特异结合蛋白。将蛋白样品经12%SDS-PAGE 分离考马斯亮蓝染色后,比较生物素标记的IRES RNA 实验组与非生物素标记的IRES RNA 对照组的条带,切取差异条带并送往中国科学院上海生命科学研究院进行质谱鉴定分析。
1.4 Western blot 检测生物素标记IRES RNA pulldown 样品 参照1.3 方法,利用制备的IRSA RNA 在鼠源BHK-21 细胞,猪源IBRS-2 细胞和牛源pBK 细胞上分别进行RNA pulldown 试验。将RNA pulldown 试验得到的样品进行SDS-PAGE 电泳后,转印至硝酸纤维素膜,5%脱脂乳封闭后,以兔抗eEF1a 多抗(1∶200)为一抗,山羊抗兔IgG-HRP(1∶3 000)为二抗,western blot 检测eEF1a 蛋白。
1.5 激光共聚焦试验分析eEF1a 与FMDV IRES RNA 的相互作用 将FMDV O/YS/CHA/05 株(MOI 1)接种生长至约90%单层的BHK-21细胞,37 ℃培养8 h后使用4%多聚甲醛常温固定细胞20 min,0.5%Triton X-100 处理10 min,1%BSA 室温封闭1 h。同时以鼠抗dsRNA MAb J2(1∶500)和兔抗eEF1a 多抗(1∶200)为一抗,山羊抗鼠IgG-TRITC(1∶500)和山羊抗兔IgG-FITC(1∶500)为二抗,DAPI(1∶2 000)复染细胞核后,在激光共聚焦显微镜下观察eEF1a 与FMDV IRES RNA 的相互作用。设置不接病毒细胞作为对照。
1.6 真核表达载体的构建与鉴定 参照GenBank 中鼠 源eEF1a 基 因 序 列(NM_007906.3),设 计 引 物eEF1a-F 和eEF1a-R(表1)。利 用TRIzol 法 提 取BHK-21 细胞的总RNA,以经反转录获得的cDNA 为模板,采用引物eEF1a-F/eEF1a-R 扩增eEF1a 基因,利用同源重组法将eEF1a 基因片段克隆到经EcoR I 和EcoR V 双酶切的pcDNA-HA 真核表载体中获得pcD⁃NA-HA-eEF1a 重组质粒。以px458 质粒为模板,使用引物EGFP-F/EGFP-R(参照质粒px458 基因序列设计,见表1)扩增EGFP 片段,利用同源重组法将EGFP 基因片段克隆到经EcoR I 和EcoR V 双酶切后的pcDNA-HA 载体中构建pcDNA-HA-EGFP 重组质粒。以上所得重组质粒均经PCR 和测序验证。
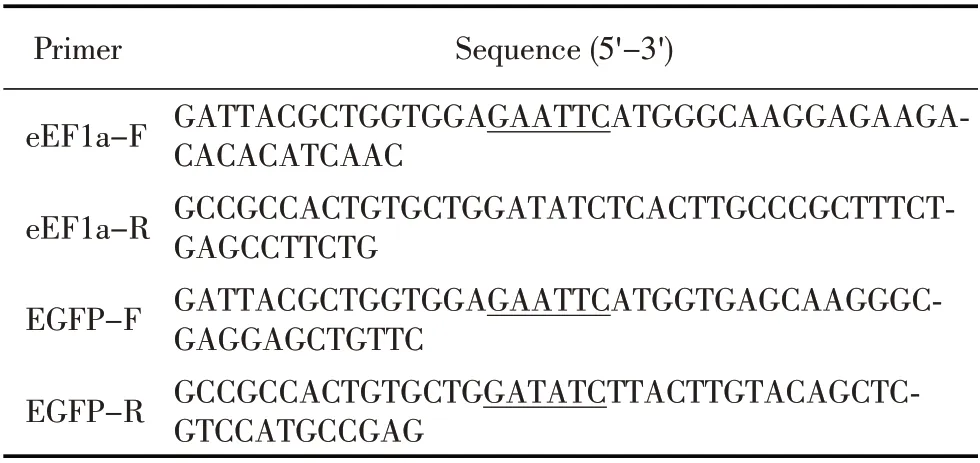
表1 本研究中使用的PCR 引物Table 1 Primers used in this study
1.7 过表达eEF1a 蛋白对FMDV 复制的影响 分别 将2 μg 的pcDNA-HA-eEF1a、pcDNA-HA-EGFP和pcDNA-HA 质粒使用无血清DMEM 培养液稀释至0.01 μg/μL,分别按照转染试剂(μL)与DNA(μg)3∶1 的比例将转染试剂与稀释DNA 轻柔混合,静置15 min 后分别转染BHK-21 细胞。37 ℃培养24 h 后感染FMDV O/YS/CHA/05 株(MOI 1),分别于感染后4 h、8 h 和12 h 收集感染细胞并反复冻融裂解,将收集的细胞裂解物以FMDV VP2 蛋白特异性MAb 4B2(1∶1 000)为一抗,马抗鼠IgG-HRP(1∶3 000)为二抗,western blot 检测FMDV VP2 蛋白。将收集的病毒样品用DMEM 做连续10 倍系列稀释,各稀释度取100 μL 接种预先铺满单层BHK-21 细胞的96 孔板,相同稀释度的病毒液做8 个重复,72 h 后观察细胞病变,根据Kärber 法计算TCID50/mL 值。
2 结 果
2.1 生物素标记IRES RNA pulldown 试验结果 对RNA pulldown 试验得到的蛋白样品经12% SDSPAGE 分离后结果显示,与非生物素标记的FMDV IRES RNA 对照组捕获的蛋白条带相比,生物素标记的FMDV IRES RNA 试验组在50 ku 处有1 条差异性条带(图1),表明捕获到未知的与FMDV IRES 结合的宿主蛋白。差异蛋白条带切胶回收后进行质谱分析,筛选出4 种可能与FMDV IRES RNA 存在相互作用的宿主蛋白,分别为eEF1a、RPS3、DDX5 和DDX3X(表2)。根据蛋白评分数据,选择评分最高的eEF1a 蛋进一步白进行RNA-蛋白互作验证和功能性研究。
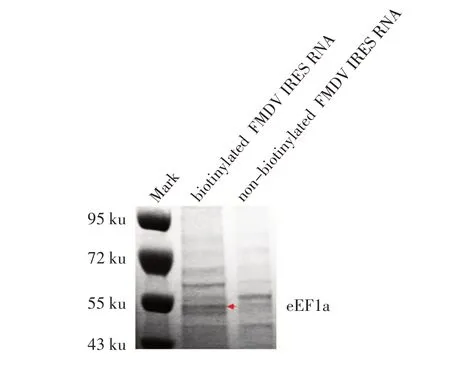
图1 与FMDV IRES RNA 结合的宿主细胞蛋白的筛选结果Fig.1 Screening of the cellular proteins associated with FMDV IRES RNA
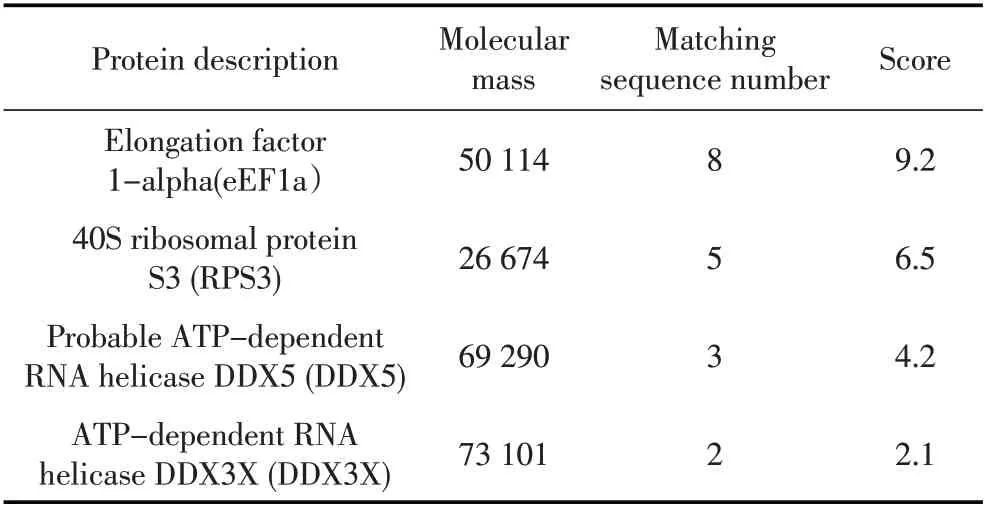
表2 与FMDV IRES RNA 结合的细胞蛋白的筛选Table 2 Identification of host proteins interacting with FMDV IRES RNA by Mass Spectrometric
2.2 eEF1a 蛋白与FMDV IRES RNA 特异性相互作用 使用eEF1a 蛋白的特异性抗体对在RNA pull⁃down 试验中与FMDV IRES RNA 结合的鼠源BHK-21细胞蛋白进行western blot 检测。结果显示,生物素标记的FMDV IRES RNA pulldown 样品中存在eEF1a蛋白,而生物素未标记的FMDV IRES RNA、Bio⁃tin-16-UTP 以及空白beads 这3 个对照样品中均无此蛋白,表明eEF1a 蛋白与FMDV IRES RNA 特异性结合(图2)。为进一步研究FMDV 易感的其它种属细胞中eEF1a 蛋白能否与FMDV IRES RNA 特异性结合,本研究选择猪源IBRS-2 细胞和牛源pBK 细胞进行RNA pulldown 试验,结果显示,猪源和牛源eEF1a 蛋白与鼠源eEF1a 蛋白均可与FMDV IRES RNA 特异性结合(图2)。以上结果表明,FMDV 不同种属易感细胞的eEF1a 蛋白均能够与FMDV IRES RNA 特异性结合。
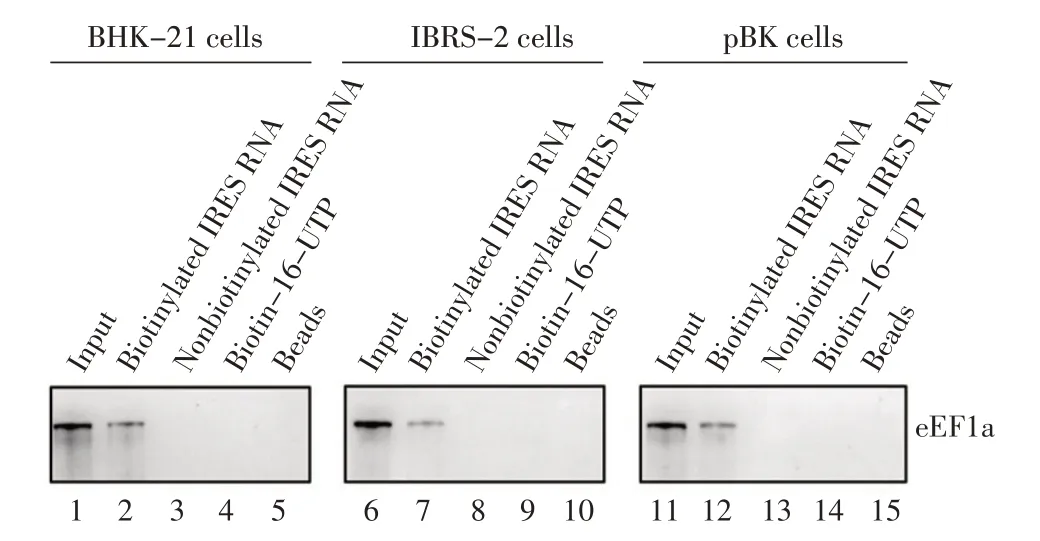
图2 FMDV IRES RNA 与不同种属易感细胞eEF1a 蛋白的结合Fig.2 Binding activity of FMDV IRES RNA with eEF1a derived from FMDV susceptible cellsofdifferent species
在FMDV 感染的情况下,用激光共聚焦显微镜观察宿主细胞中eEF1a 蛋白与FMDV 基因组RNA 在细胞内的共定位。结果显示,FMDV 感染后eEF1a蛋白从细胞核迁移至细胞质中,并与FMDV 基因组RNA 在细胞质中形成共定位(图3)。该结果进一步证实,eEF1a 蛋白与FMDV IRES RNA 存在特异性相互作用。
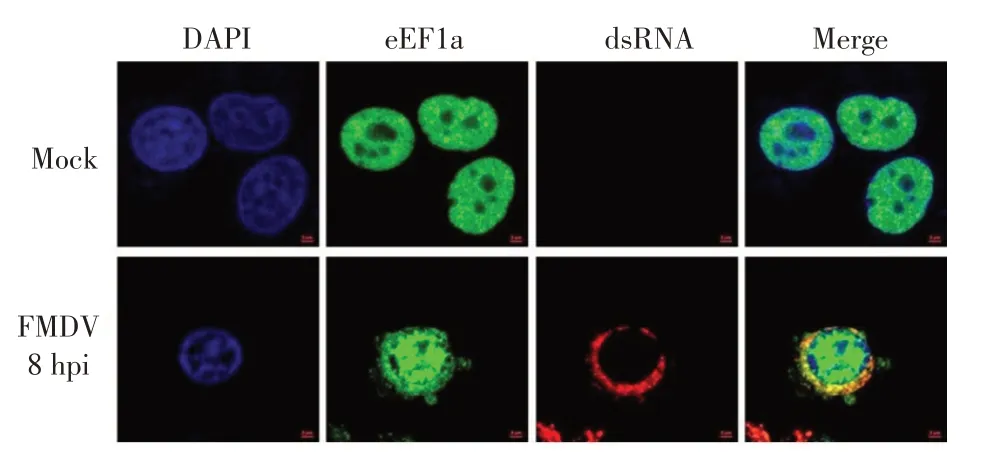
图3 在FMDV 感染的BHK-21 细胞中eEF1a 蛋白与FMDV RNA 共定位的检测结果Fig.3 Co-localization of the eEF1a with FMDV RNA in the cytoplasm of FMDV-infected BHK-21 cells
2.3 真核表达载体的构建与鉴定结果 利用同源重组技术构建真核表达质粒pcDNA-HA-eEF1a 和pcDNA-HA-EGFP,分别对两个重组质粒进行PCR鉴定,结果显示,重组质粒pcDNA-HA-eEF1a扩增的eEF1a基因片段大小约为1.3 kb,pcDNA-HA-EGFP扩增的EGFP 基因片段约为0.7 kb,与预期相符,而空载体pcDNA-HA 未扩增出条带(图4)。序列测定结果显示,目的基因序列以及阅读框正确,表明eEF1a 和EGFP 基因的真核表达重组质粒正确构建。
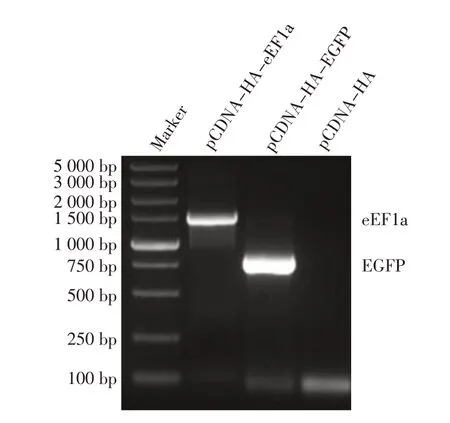
图4 eEF1a 和EGFP 基因重组质粒的PCR 鉴定Fig.4 Identification of recombinant plasmids containing genes of eEF1a and EGFP by PCR
2.4 过表达eEF1a 蛋白对FMDV 复制的影响BHK-21 细胞转染pcDNA-HA-eEF1a、pcDNA-HAEGFP和pcDNA-HA 24 h后,以MOI 1的剂量感染FM⁃DV,分别于病毒感染4 h、8 h和12 h后收集样品进行检测。结果显示,在病毒感染8 h 后,pcDNA-HA 和pcDNA-HA-EGFP 质粒转染对照组的病毒滴度分别为4.83 logTCID50/mL 和4.66 logTCID50/mL, 而 过 表 达eEF1a 蛋白的细胞病毒滴度仅为3.66 log TCID50/mL(图5A)。在病毒感染4 h、8 h 和12 h 后,过表达eEF1a 蛋白细胞中病毒蛋白VP2 的表达量明显低于pcDNA-HA 和pcDNA-HA-EGFP 质粒转染对照组(图5B)。表明,宿主蛋白eEF1a 过表达显著抑制FMDV 的复制。
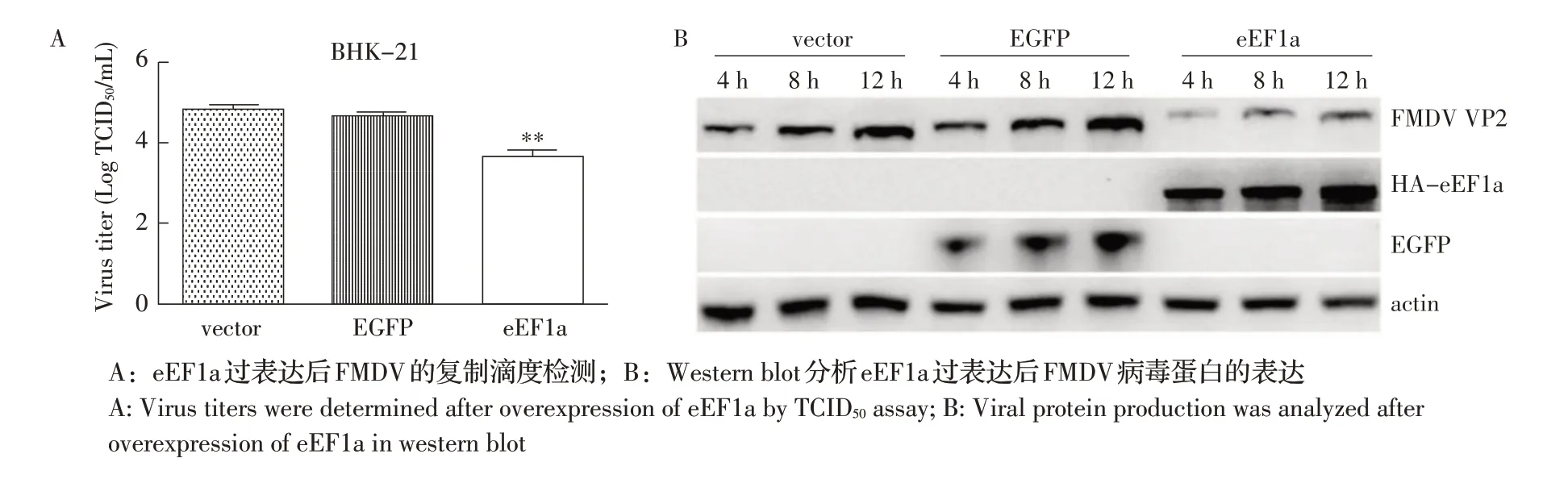
图5 eEF1a 过表达抑制FMDV 的复制Fig.5 FMDV replication was inhibited by overexpression of eEF1a
3 讨 论
为探索IRES 如何通过与宿主蛋白相互作用实现对FMDV 复制的调控,本研究利用生物素标记的FMDV IRES RNA 为“诱饵”,通过RNA pulldown 技术在BHK-21 细胞中筛选得到与FMDV IRES RNA 具有潜在相互作用的宿主蛋白,经质谱分析鉴定获得4 种宿主蛋白,分别为eEF1a、RPS3、DDX5 和DDX3X。进一步的western blot 分析和激光共聚焦试验证实,eEF1a 蛋白与FMDV IRES RNA 存在特异性的相互作用,进一步研究发现,过表达eEF1a 蛋白可以显著抑制FMDV 的复制。
eEF1a 蛋白是哺乳动物细胞中最丰富的蛋白质合成因子之一,在活跃的分裂细胞中占可溶性蛋白的1%到4%[9]。eEF1a 蛋白的典型功能是以GTP 依赖的方式结合氨基酰tRNA(AA-tRNA),并在蛋白质合成过程中将其传递到核糖体上的A 位点[10]。此外,eEF1a 蛋白还参与错误折叠蛋白的转运、细胞凋亡和细胞周期[11-12]。eEF1a 蛋白可作为辅助因子参与多种病毒的转录、翻译和组装。eEF1a 蛋白是HIV逆转录复合体(RTC)的一部分,在HIV 复制的早期阶段发挥了关键作用[13]。HIV Nef-eEF1a 相互作用有利于eEF1a 蛋白的核质穿梭,并抑制应激介导的巨噬细胞凋亡[14]。eEF1a 蛋白有利于病毒复制复合物(RPC)的组装,促进登革热病毒的复制[15]。最近的研究发现,eEF1a 与猪瘟病毒的NS5A 蛋白相互作用抑制该病毒的复制[16]。
FMDV 在流行过程中病毒的毒力及宿主嗜性经常发生变异,然而有关FMDV 的致病机理尚不清楚。本实验室的研究表明,IRES 元件是FMDV 毒力和细胞嗜性的分子决定因素(未发表资料),因此研究FMDV IRES 与宿主蛋白之间的相互作用,对进一步阐明FMDV 的致病机理就显得尤为重要。本研究首次发现宿主蛋白eEF1a 与FMDV IRES RNA 相互作用,而且发现eEF1a 蛋白对FMDV 的复制具有负调控作用。本研究为深入了解IRES 介导的翻译起始机制以及FMDV 在宿主体内复制的分子调控机制奠定了基础。
