沙门菌分离、筛检和确认流程技术关键点分析
2020-06-30张红芝顾其芳朱颖莹许学斌
刘 玥, 张红芝, 顾其芳, 刘 诚, 朱颖莹, 许学斌
(上海市疾病预防控制中心,上海 200336)
2015年,世界卫生组织(World Health Organization,WHO)评估全球31种食源性疾病病例约为6亿例,死亡42万例[1],其中非伤寒和副伤寒病例约9 400万例[2]。沙门菌也是我国优势食源致病菌,以培养为主的检测标准应用于临床、兽医和流通监管领域,标准滞后会影响行业发展和政府公信力[3-4]。美国食品药品监督管理局(U. S. Food and Drug Administration,FDA)2018年新颁布的食品沙门菌检测标准突出了高敏感性的特点[5]。本研究集成2006年区域性WHO沙门菌检测流程的技术关键点挖掘和评估方法,结合国内外食品沙门菌检测标准的梯度增菌和选择性分离原则,构建由沙门菌选择性增菌液和分离平板构成的多维组合检测流程,评估菌落甄别、筛检效率和方法敏感性,为各级标准提供全流程及多变量解析证据,以满足不同机构对沙门菌的更高敏感性检测方法的需求。
1 材料和方法
1.1 参比菌株
典型和非典型沙门菌包括伤寒沙门菌(CMCC 50071)、甲型副伤寒沙门菌(ATCC 9150)、猪霍乱沙门菌(ATCC 7001)、鼠伤寒沙门菌(ATCC 14028)、猪霍乱沙门菌孔成道夫变种(ATCC 12011);非沙门菌肠杆菌包括肺炎克雷伯菌(ATCC 700603)、奇异变形杆菌(ATCC 35659)、弗劳地枸橼酸杆菌(ATCC 43864)和大肠埃希菌(ATCC 25922)。
1.2 仪器与试剂
菌液浊度仪及细菌鉴定质谱仪(法国生物梅里埃公司)。非选择性增菌液[缓冲蛋白冻水(buffered peptone water,BPW)],选择性增菌液[亚硒酸盐胱氨酸增菌液(selenite cystine broth,SC)、四硫磺酸钠煌绿增菌液(tetrathionate broth,TTB)、罗伯特增菌液(Rappaport Vassiliadis broth,RV)、亚硒酸盐煌绿增菌液(selenite brilliant green broth,SBG)];沙门菌选择性平板按原理和配方分为3类:沙门菌显色平板(CHORMagarSalmonella,CAS)、木糖赖氨酸脱氧胆酸盐平板(xylose lysine deoxycholate,XLD)和木糖赖氨酸十四烷基硫酸钠平板(xylose lysine tergitol 4 agar,XLT4)属中选择性;亚硫酸铋平板(bismuth sulphite agar,BS)和赫氏肠道菌平板(Hektoen enteric agar,HE)属强选择性。增菌液和平板均为自配,试剂购自美国BD公司,10℃以下避光保存,有效期内使用。其他试剂:血平板、哥伦比亚琼脂斜面、沙门菌诱导软琼脂和肠道菌筛选双糖管(广州迪景微生物公司),API20E氧化酶试剂及生化鉴定条(法国生物梅里埃公司),130种沙门菌分型血清(丹麦SSI诊断公司),平板和血清等均于10℃以下避光保存,有效期内使用。
1.3 方法
1.3.1 参比菌株生化特征验证 复苏和纯化5株沙门菌和4株非沙门菌,取单个菌落接种肠道菌筛选双糖管和CAS进行表型生化初筛及系统生化、质谱鉴定复核。见图1。
1.3.2 比较沙门菌选择性增菌液的定量回收 (1)靶菌回收。5株沙门菌标准菌株经血平板纯化后取1~3个纯菌落制成0.5麦氏浓度菌液,以0.9%氯化钠溶液梯度稀释成10-1~10-10悬液。取各稀释度的菌液100 μL分别加入TTB、RV、SC和SBG中。TTB和RV 41.5 ℃、SC和SBG 36 ℃孵育。18 h后分别取10 μL增菌液接种XLD和CAS,36 ℃放置24 h,记录菌株生长浓度。(2)模拟样加标回收。取市售猪肉糜56 ℃ 30 min预处理,按图1流程:取25 g模拟样,加入225 mL BPW,取制备好的标准菌株悬液10-1~10-10各0.1 mL加入对应模拟样与BPW混合物,36 ℃放置8 h取1 mL各稀释度BPW于TTB、SC、SBG和RV,TTB和RV置41.5 ℃、SC和SBG置36 ℃,18 h后分别取10 μL增菌液接种XLD和CAS,36 ℃放置24 h后,记录靶菌在模拟样中的生长浓度。
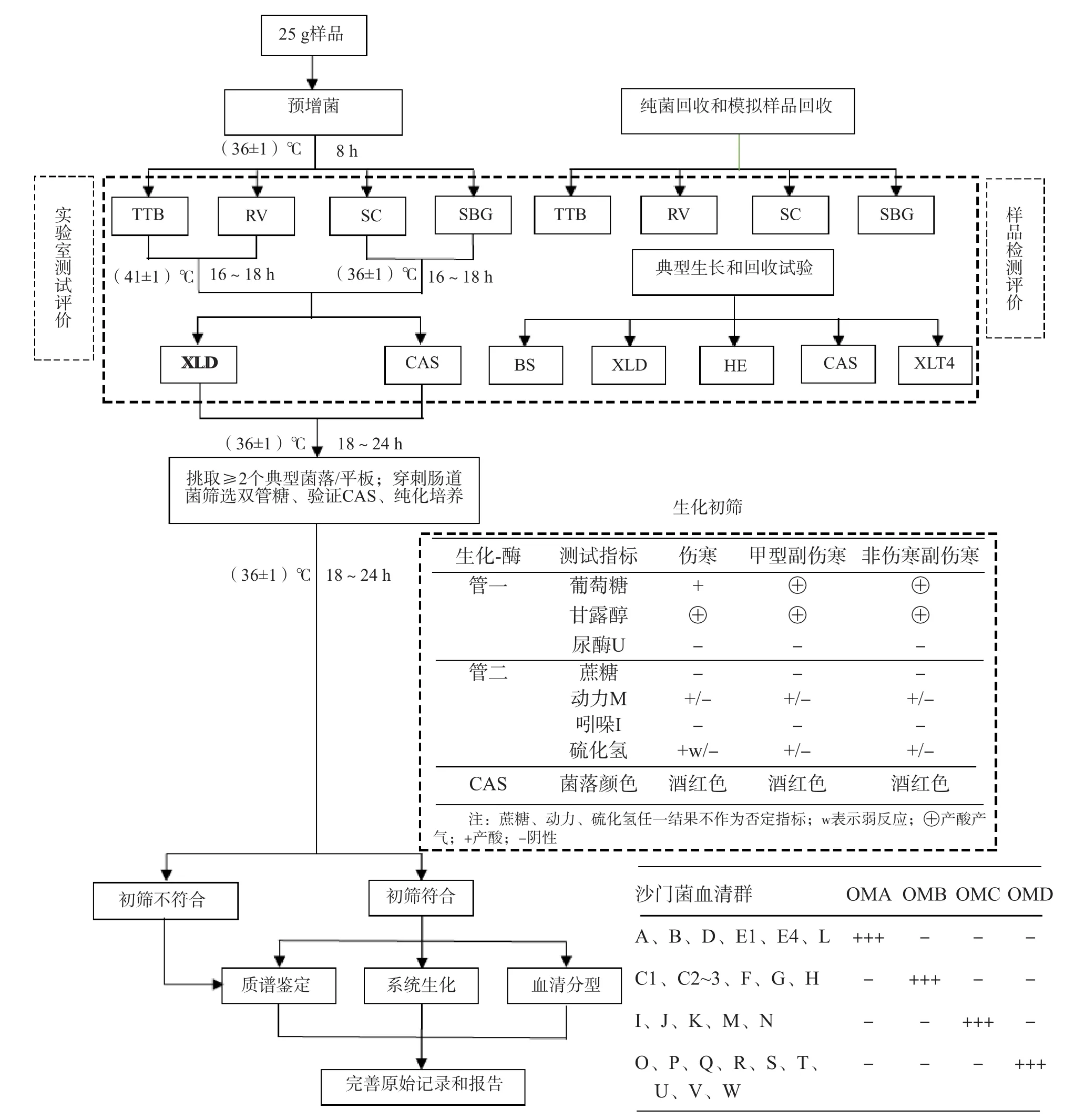
图1 沙门菌方法学评价技术路线流程图
1.3.3 验证沙门菌选择平板的典型菌株特征 将5株沙门菌和4株非沙门菌纯化,制成0.5麦氏浓度菌液,并取100 μL菌液涂布于XLD、XLT4、CAS和BS、HE,36 ℃放置24 h后观察菌落特征。预期生长典型菌落:XLD和XLT4均为中心黑色的淡红色湿润菌落,CAS为酒红色光滑湿润菌落,BS为金属光泽棕黑色菌落,HE为中心黑色淡绿色湿润菌落。
1.3.4 沙门菌检测流程的应用和技术关键点评估 2019年7—9月,定点采集市售肉制品和水产品84件,单独包装待检。按图1流程完成BPW和TTB、RV、SC、SBG两步增菌及XLD、CAS接种,选择疑似典型菌落进行生化初筛,用系统生化与质谱(经血平板纯化新鲜菌落)鉴定和血清分型。定义统计参数:将各选择性平板上生长的符合典型特征的菌落视为疑似阳性菌(数);将符合肠道菌筛选双糖管初筛的菌落数视为初筛阳性菌(数);将系统生化和质谱仪鉴定结果视为确认阳性菌(数);将各平板确认的最终阳性菌落视为筛检菌落的真阳性;基于各平板确认不同沙门菌型株(数)交集值视为检测真阳性,分别统计各平板和增菌流程筛检沙门菌的敏感性和阳性预测值[6]。
2 结果
2.1 标准菌株生化表型验证
5株沙门菌包括伤寒沙门菌、副伤寒沙门菌和非伤寒沙门菌,猪霍乱沙门菌为硫化氢阴性沙门菌,经肠道菌筛选双糖管和CAS验证均符合沙门菌初筛表型特征。4株非沙门菌除奇异变形杆菌不能排除沙门菌,需要进一步生化确认外,其余包括产生硫化氢的弗劳地枸橼酸杆菌初筛验证均可排除沙门菌,见表1。
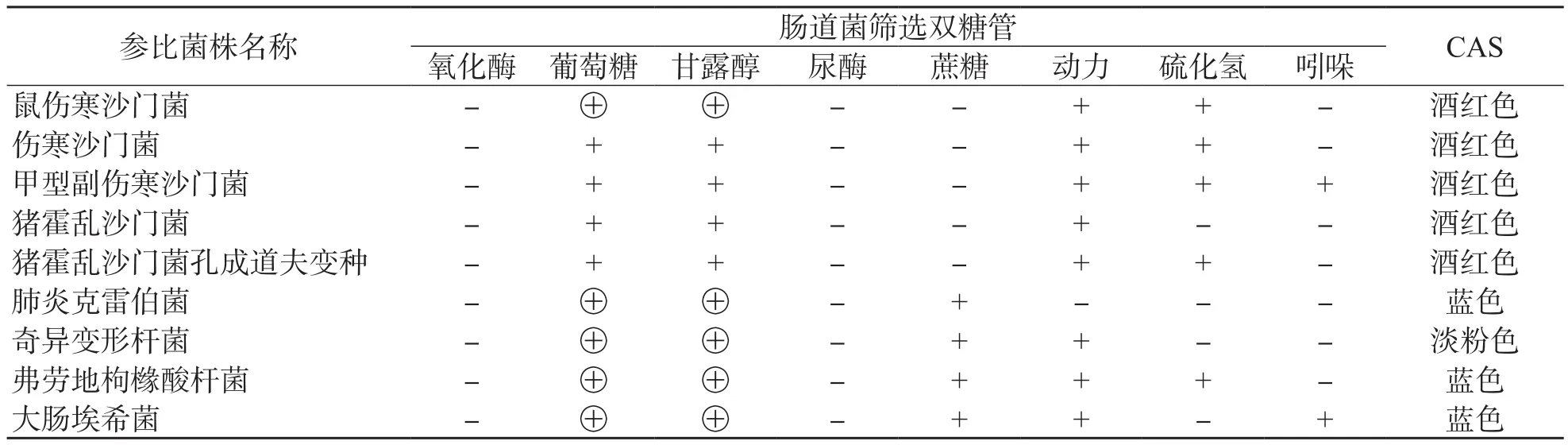
表1 验证测试参比菌株在初筛流程的表型特征
2.2 沙门菌选择性增菌液定量回收试验
靶菌对RV、TTB和SBG回收结果无显著差异。SC回收伤寒沙门菌和甲型副伤寒沙门菌的梯度均高于RV、TTB和SBG 1个稀释度,回收猪霍乱沙门菌及其孔成道夫变种的梯度均低于RV、TTB和SBG 2~3个稀释度。模拟样加标对RV、TTB、SBG回收结果也无显著差异。见表2。
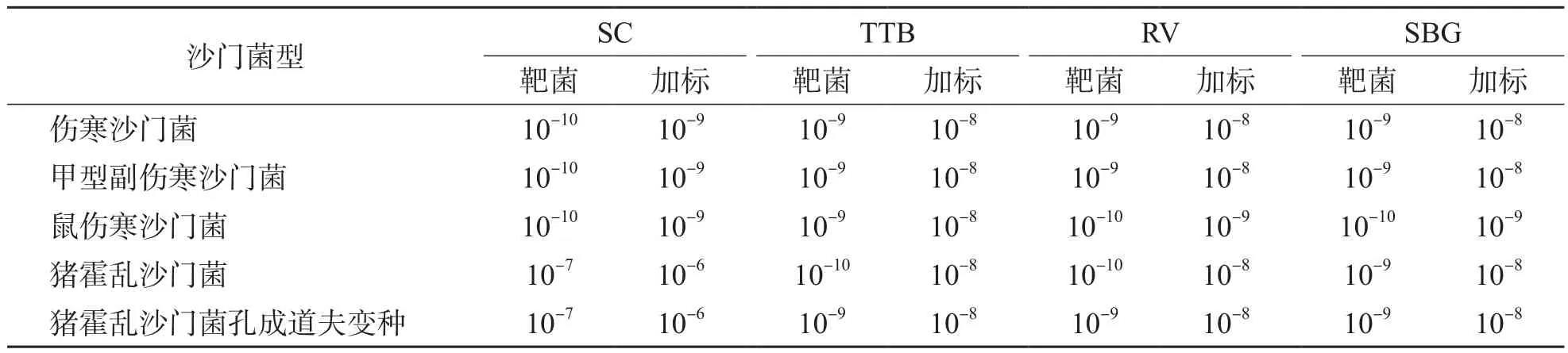
表2 4种沙门菌选择性增菌液靶菌回收和模拟样加标回收试验结果
2.3 沙门菌选择性平板的预期典型菌落生长状况
CAS验证5株沙门菌皆呈典型菌落,其余平板对伤寒猪霍乱沙门菌、副伤寒猪霍乱沙门菌和猪霍乱沙门菌因24 h内硫化氢阴性和菌落小而无法判断为典型菌落。XLD典型菌落为鼠伤寒沙门菌、猪霍乱沙门菌孔成道夫变种,XLT4为鼠伤寒沙门菌,BS为鼠伤寒沙门菌,HE为鼠伤寒沙门菌,见图2。XLT4和BS验证4株非沙门菌未见预期典型菌落,而CAS(奇异变形杆菌)、XLD和HE(均为弗劳地枸橼酸杆菌)验证结果均为假阳性菌落,见图3。
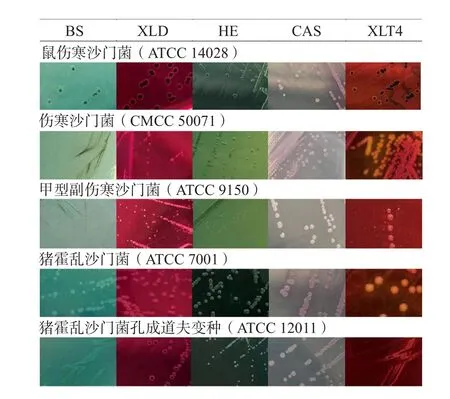
图2 沙门菌参比菌株在不同类型沙门菌选择性平板生长24 h的菌落特征
2.4 沙门菌的实样检测
84件样品包括畜肉22件、禽肉32件和水产品30件。经多种选择性增菌液和选择性平板的多维组合分离、初筛和表型确认,阳性样品数为25件,分离沙门菌42株:畜肉27株、禽肉14株、水产品1株。血清型:鼠伤寒7株、罗森5株、伦敦5株、肠炎4株、德比4株、鸭4株、黄金海岸3株、科瓦利斯2株、明斯特1株、火鸡1株、哈达尔1株、科特布斯1株、肯塔基1株、汤卜逊1株、利文斯通1株和胥戈成格隆1株。

图3 非沙门菌在不同类型沙门菌选择性平板生长24 h的菌落特征
2.4.1 选择性增菌液和选择性平板多维组合分离效果 经RV、TTB、SBG、SC梯度增菌、CAS和XLD筛检沙门菌的敏感性分别为88%、84%、72%和0。将SC视作偏移,RV和TTB、RV和SBG、TTB和SBG双组合筛检沙门菌的敏感性分别为100%、92%和88%。见表3。
2.4.2 选择性平板的分离效果 RV和TTB分离敏感性均为CAS高于XLD,CAS分别为68%、48%,XLD分别为68%、60%;SBG则相反,分别为48%、56%;而沙门菌的菌型敏感性均为CAS高于XLD,以RV-CAS(88.10%)、SBGCAS(85.71%)敏感度较高,见表3。
2.4.3 选择性平板菌落甄别、初筛和确认效率评估 除SC外,各组选择性增菌液分离平板后的疑似菌落数在34~50个,经生化初筛后确认除3株为非沙门菌的肠杆菌科干扰菌,其余均为沙门菌;生化初筛排除的非沙门菌经系统生化和质谱确认无漏检。肠道菌筛选双糖管筛检沙门菌疑似典型菌落具备高特异性,除1株CAS产红色脂溶性色素的液化沙雷菌存在误判,其余符合初筛阳性菌落和系统生化、质谱比对的确认结果均为100%符合,提示肠道菌筛选双糖管筛检沙门菌疑似典型菌落具备高阳性预测值。见表3。
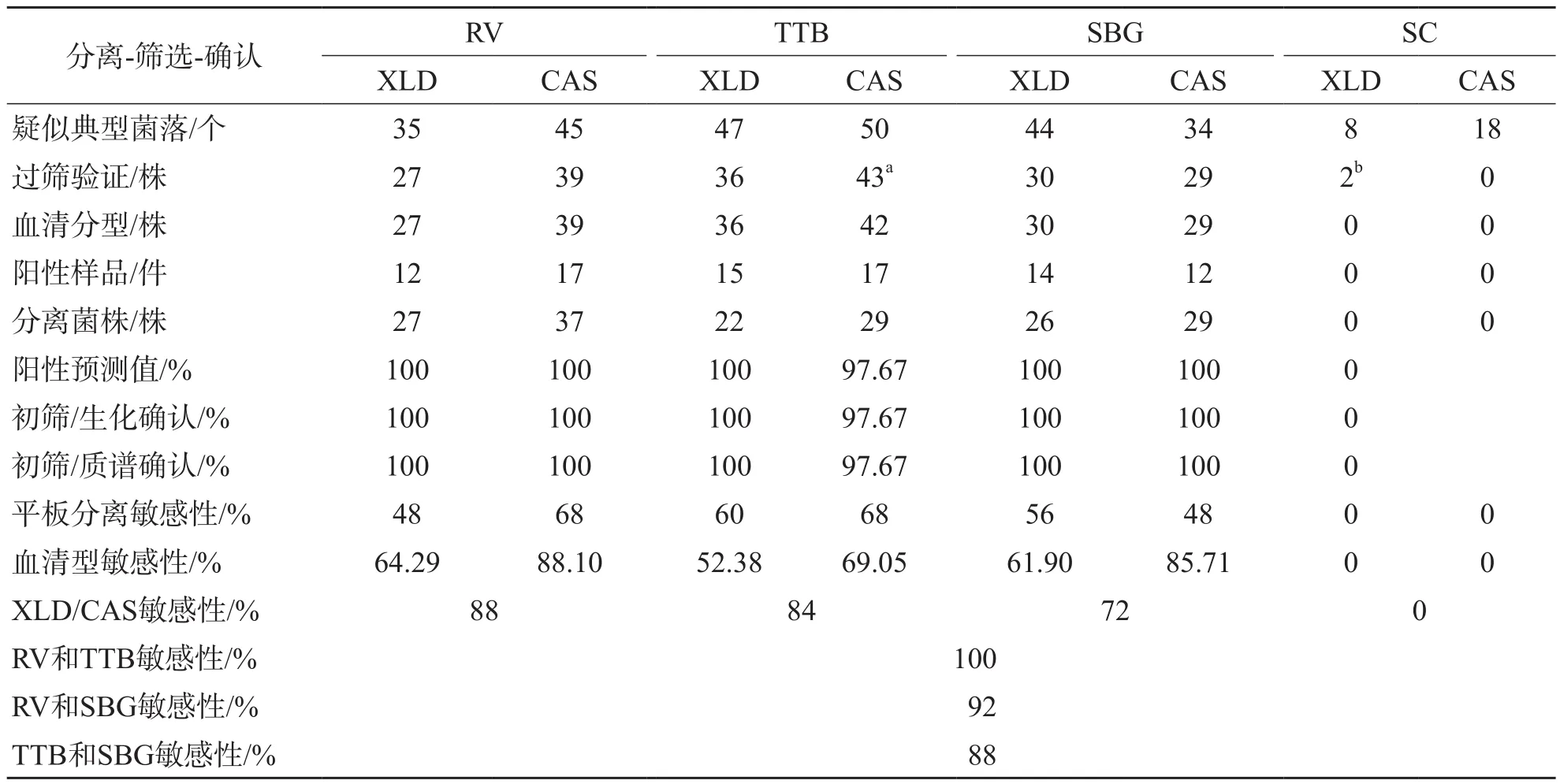
表3 选择性增菌液和平板组合分离、筛选和确认沙门菌的参数统计
3 讨论
有效增菌能提高肠道沙门菌检测敏感性,以达到精准诊断的要求[7]。沙门菌腹泻的优势病原菌为鼠伤寒沙门菌和肠炎沙门菌,肠外优势血清型为猪霍乱、甲型副伤寒和伤寒等侵袭性血清型[8-11]。医疗诊断和风险监测可为改善诊疗行为、优化抗菌药物使用和暴发病例溯源与防控提供参考[12-13]。为了给我国食品沙门菌检测标准的修订提供科学依据,本研究根据国内外食品沙门菌相关检测标准构建多维度组合筛检流程,基于菌株验证、回收试验和实样检测进行多维度组合测试、评价。
食品沙门菌的检测包括两步法增菌和选择性分离。本研究依据沙门菌到达增菌曲线峰值时间(18~24 h)设计4种不同选择性增菌液的回收试验[14],结果表明,SBG、RV和TTB的回收率较一致,SC对伤寒沙门菌和甲型副伤寒沙门菌的回收较前3种增菌液高1个稀释度(10倍),对鼠伤寒沙门菌、猪霍乱沙门菌及其孔成道夫变种的回收明显低于前3种增菌液2个稀释度度(100倍),间接证实了国家标准[3]中SC重点针对伤寒沙门菌和副伤寒沙门菌;模拟试验证实,食品的物理特性对沙门菌增殖效率的影响为1个稀释度(10倍)。SC增菌实样检测未分离到沙门菌,提示亚硒酸盐类增菌液有效增菌时间为8~12 h,过峰值后样品中的杂菌会掩盖沙门菌导致平板分离出现假阴性[14]。GB对伤寒沙门菌和副伤寒沙门菌的倾向性间接降低了非伤寒沙门菌的检测敏感性,与我国实际监测的人源和食源性沙门菌菌型分布并不匹配[8,15]。
CAS和中等选择性平板(XLD)组合几乎不会漏检增菌后粪便样本中的沙门菌[16]。有食品标准[17]中注释用强选择性平板(BS、HE)可提高复杂样品筛选效率和伤寒及乳糖阳性沙门菌的选择性。本研究用硫化氢有差异的沙门菌验证平板结果符合预期:除CAS外,其他4种以硫化氢为筛选原理的平板均无法呈典型菌落,而其他非沙门菌(产硫化氢肠杆菌)疑似典型菌落筛选结果为无效筛选,降低了检测特异性;相关食品标准[17]注释对强选择性平板延迟至48 h是缘于24 h菌落较小(相比XLD和XLT4),而检测时效是临床实验室方法评价、应用的重要前提。
本研究选择性增菌液和平板组合基本满足国内外食品沙门菌检测的标准。实样检测证实SC不适用于非伤寒沙门菌的选择性增菌。其他3种增菌液经CAS、XLD(单增菌液和单平板)组合分离敏感性为48%~68%、双平板分离敏感性为72%~88%,提示单增菌液检测食品样品沙门菌的敏感性存在局限性,2种增菌液和多种平板搭配可提高敏感性。以国家标准方法(SC、TTB和BS、HE)检测肉制品沙门菌阳性检出率为11.11%~21.50%[15,18-19],更换选择性平板(SC/TTB和CAS/XLT4)后肉制品沙门菌的阳性检出率为26.50%[20],更换选择性增菌液(SBG和CAS/XLD)后生鲜肉制品沙门菌的阳性检出率为26.10%[21],本研究多增菌液和双平板组合检测阳性率为29.76%,证实RV适用于食品沙门菌的增菌。
除有效增菌和菌落识别外,沙门菌疑似菌的简易甄别、筛选也是重要的特异性指标,质谱仪对临床肠道菌属(沙门菌属)的鉴定依赖经纯化的培养物[22],非伤寒沙门菌存在多个血清型的硫化氢表型异质性[23]。瑞典与血清型有关的硫化氢阴性鼠伤寒单相变种的食源性暴发提示诊疗技术面临新的挑战[24]。本研究未漏检不典型沙门菌(猪霍乱沙门菌和甲型副伤寒沙门菌)的原理是基于肠道菌生化筛选组合——动力-吲哚-尿酶[25]。
综上所述,梯度增菌、菌落甄别、简易筛选为沙门菌检测的技术关键点。FDA食品沙门菌标准重视硫化氢阴性和乳糖阳性等表型异质沙门菌,我国修订中的感染性腹泻诊断标准推荐分别选用SBG和TTB作为首选和次选增菌液,均是以敏感性为导向的规则转变[4-5,7]。
