替加环素联合亚胺培南对黏液型铜绿假单胞菌的体外抗菌活性及生物膜抑制作用分析
2020-06-30张晶晶方咏梅陶秀彬
钟 峰, 冯 艺, 张晶晶, 许 岩, 方咏梅, 陶秀彬, 吴 竞
(1.皖南医学院第二附属医院检验科,安徽 芜湖 241000;2. 安徽省妇幼保健院病理科,安徽 合肥230001;3. 皖南医学院护理学院,安徽 芜湖 241000)
铜绿假单胞菌是院内感染的主要病原菌之一,常引起肺部、尿路等多部位严重感染[1]。在进行侵入性治疗时,插管、引流管等可引起外源性感染,也是导致细菌生物膜产生及诱发因素之一。有研究结果表明,铜绿假单胞菌生物膜与临床感染毒力、耐药性有主要关系,碳青霉烯类耐药菌株的生物膜形成能力较敏感菌株明显升高[2-3]。因此,亟需一种有效的用药方案,以解决形成生物膜菌株的耐药问题。
细菌生物膜是细菌在生长过程中为适应生存环境而形成的一种与浮游细胞相对应的生长方式,通过自身合成的多糖蛋白复合物黏附在固体表面,并在糖蛋白复合物中生长繁殖而形成的细菌群落[4]。大环内酯类抗菌药物可通过抑制铜绿假单胞菌生物群体密度感应系统而抑制细菌生物膜的形成[5],但由于大环内酯类抗菌药物抗菌谱较窄,且耐药率逐年升高,在临床治疗时往往效果并不理想。亚胺培南对革兰阴性菌的抗菌活性较强,抗菌谱较广[6],但单独使用稳定性差,且肝脏毒副作用大,对细菌生物膜的抑制及破坏作用较差。本研究拟探讨替加环素联用亚胺培南对黏液型铜绿假单胞菌(mucoidPseudomonas aeruginosa,MPA)的抗菌活性及生物膜抑制作用,为临床抗感染治疗提供参考。
1 材料和方法
1.1 菌株来源
收集2016年9月—2018年5月皖南医学院第二附属医院分离自临床样本(痰、中段尿和分泌物等)的89株MPA,剔除分离自同一患者相同部位的重复菌株。质控菌株铜绿假单胞菌(ATCC 27853)购自中国药品生物制品检定所。
1.2 主要仪器和试剂
VITEK-2 Compact全自动细菌鉴定仪、DR100型比浊仪(法国生物梅里埃公司),96孔细菌培养板、全功能微孔板检测酶标仪(郑州安图生物公司),替加环素、亚胺培南(上海阿拉丁生化科技股份有限公司),M-H培养基、MHB培养基(北京索莱宝公司)。
1.3 方法
1.3.1 体外药物敏感性试验 采用微量肉汤稀释法测定替加环素和亚胺培南对89株MPA的最小抑菌浓度(minimum inhibitory concentration,MIC)。将替加环素和亚胺培南倍比稀释成0.062 5~32 μg/mL系列浓度的菌液,分别注入无菌的96孔细菌培养板,每孔200 μL,每排设2个空白对照孔,用MHB营养肉汤将培养18~24 h的MPA配制成浓度为1.0×106CFU/mL的菌液,每孔加入200 μL,混匀,放入37℃温箱培养16~20 h后观察结果,此MIC为无菌生长的最低药物浓度。
1.3.2 联合用药效果评价 采用棋盘滴定法测定替加环素和亚胺培南体外协同效应,用MHB营养肉汤将替加环素和亚胺培南倍比稀释成0.062 5~32 μg/mL系列浓度的菌液,以棋盘法将不同浓度的药物两两组合,加入到96孔细菌培养板中,再加入浓度为1.0×106CFU/mL的菌液,设置阴性对照(MHB培养基)和阳性对照(不加药物),放入37℃温箱培养16~20 h后观察结果,两药联合的MIC为微孔内液体澄清的最低药物浓度。采用分级抑菌浓度指数(fractional inhibitory concentration index,FICI)判定2种药物联用对MPA的抑菌作用。FICI=联用时A药的MIC/单A药的MIC+联用时B药的MIC/单B药的MIC。判定标准:FICI≤0.5为协同作用,0.5<FICI≤1为相加作用,1<FICI≤2为无关作用,FICI>2为拮抗作用[7]。
1.3.3 时间杀菌曲线实验 设置0.5 MIC亚胺培南组、0.5 MIC替加环素组、0.5 MIC亚胺培南+替加环素组、对照组(MIC为0)4个组。菌液浓度均为1.0×106CFU/mL,抗菌药物终浓度为该药物的亚MIC。混匀后放入37℃摇床内培养,分别于0、2、6、12、24 h吸取100 μL培养液,用无菌0.9%氯化钠溶液10倍稀释4次后涂板,常规培养18~24 h后计数,取计数值的对数绘制出时间杀菌曲线,根据菌落计数判断2种药物联用后的杀菌效应。杀菌/抑菌效应定义:培养24 h细菌浓度比初始接种细菌浓度降低>3 log10CFU/mL;协同效应定义:培养24 h联合组细菌浓度比最强单药组细菌浓度降低≥2 log10CFU/mL[8]。
1.3.4 生物膜抑制实验 将替加环素和亚胺培南联合用药为协同作用效应的6株MPA[3]和质控菌株铜绿假单胞菌(ATCC 27853)分别接种于MHB培养基中,37℃培养箱内培养过夜,用比浊仪将菌液浓度分别调整为1.0×106CFU/mL,注入无菌96孔细菌培养板(质控菌株为阳性对照,空白对照孔内只加MHB),用MHB培养基分别将替加环素稀释成1、1/2、1/4 MIC系列浓度,将亚胺培南稀释成1、1/2、1/4 MIC系列浓度。以棋盘法将不同浓度的替加环素和亚胺培南进行两两组合,37℃培养24 h后,弃去培养基,用磷酸盐缓冲液冲洗2遍,加入100%甲醇200 μL固定20 min,弃去固定液后加入0.5%结晶紫染色20 min,蒸馏水冲洗后晾干,加入33%冰乙酸200 μL。用酶标仪检测96孔板内液体在波长570 nm处的吸光度(A570nm)值,每株菌株设立3个复孔,计算经抗菌药物作用组与未经抗菌药物作用组的A570nm均值,均值越低,表示抗菌药物对生物膜的抑制能力越强。
1.4 统计学方法
采用SPSS 17.0软件进行统计分析,呈正态分布的数据以±s表示,组间比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 抗菌药物单用及联用对MPA的MIC比较
采用微量肉汤稀释法检测替加环素、亚胺培南单用及联用对89株MPA的MIC,得出的MIC分别为0.0625~2 μg/mL和0.125~2 μg/mL,89株MPA均为敏感菌株。MIC50分别为0.25 μg/mL和1 μg/mL,MIC90分别为0.5 μg/mL和2 μg/mL(表1)。FICI指数结果分析得出2药联合应用对MPA的协同作用为46.07%(41株)、部分协同作用为14.6%(13株)、相加作用为12.36%(11株)、无关作用为26.97%(24株)、无拮抗作用。2种药物联用对89株MPA的累计抑菌百分率(cummulative inhibitory ratio,CIR)见图1。相比单独用药,替加环素与1/2 MIC亚胺培南联用的累计抑菌曲线明显左移,在相同CIR下,替加环素与亚胺培南联用较单用所需的药物浓度低。在相同的给药浓度下,联合用药的抗菌作用明显增强。

表1 替加环素与亚胺培南单用及联用对MPA的MIC μg/mL
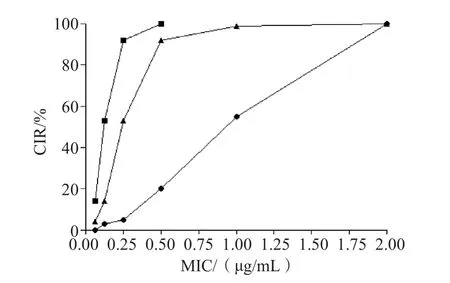
图1 替加环素与亚胺培南单用及联用对MPA的MIC CIR曲线
2.2 替加环素与亚胺培南联合抗菌实验结果
选取亚胺培南和替加环素联合用药有协同作用的6株MPA,在联合应用亚胺培南和替加环素24 h后菌落数均减少,较最强单药组浓度降低≥2 log10CFU/mL,联合用药对6株MPA均表现为协同作用。见图2。
2.3 亚胺培南和替加环素对MPA生物膜的体外作用效应
在无亚胺培南作用时,1/4、1/2 MIC替加环素与对照组比较,差异无统计意义(P>0.05);加入1/4、1/2或1 MIC替加环素后与单独使用1/4 MIC替加环素相比,A570nm值明显下降(t值分别为2.45、2.24、2.07,P<0.05)。在无替加环素作用时,1/4、1/2 MIC亚胺培南与0 MIC比较,差异无统计意义(P>0.05);加入1/4、1/2或1 MIC替加环素后与单独应用1/4 MIC亚胺培南相比,A570nm值明显下降(t值分别为2.47、2.35、2.16,P<0.05)。见表2。

图2 替加环素(1/2 MIC)与亚胺培南(1/2 MIC)单用及联用的时间杀菌曲线
表2 替加环素联合亚胺培南对MPA生物膜的作用效应(A570nm值) ±s

表2 替加环素联合亚胺培南对MPA生物膜的作用效应(A570nm值) ±s
注:与同一浓度单用亚胺培南对照组(MIC=0)比较,* P<0.05;与同一浓度单用替加环素对照组(MIC=0)比较,#P<0.05
亚胺培南MIC替加环素MIC 0 0.261±0.006 0.214±0.005* 0.211±0.009* 0.136±0.004*1/4 0.248±0.005 0.189±0.008*# 0.175±0.006*# 0.129±0.01*1/2 0.227±0.004 0.164±0.005*# 0.136±0.001*# 0.125±0.005*1 0.128±0.007# 0.13±0.003# 0.126±0.006# 0.126±0.004 1/4 1/2 1 0
3 讨论
铜绿假单胞菌的耐药机制主要包括形成生物膜、主动外排系统和药物渗透障碍等,特别是MPA黏液化与生物膜形成有关,一般认为MPA为形成生物膜的阳性菌株,MPA和非黏液型铜绿假单胞菌均能形成生物膜,但两者形成生物膜的表型及阶段特异性存在差异[9-10]。有研究结果表明,MPA比非黏液型铜绿假单胞菌感染持续时间更长,更不易清除,能够使菌体逃脱宿主免疫系统的清除[11],同时由于胞外黏多糖的屏障作用,使得抗菌药物难以渗透入细胞内,导致MPA相关的慢性感染易反复,且难以清除,给临床治疗带来严重困扰[12-13]。
近年来,由于多重耐药铜绿假单胞菌不断增多,且氨基糖苷类及喹诺酮类抗菌药物的不良反应,碳青霉烯类抗菌药物已成为治疗首选,但是由于铜绿假单胞菌生物膜的形成,增加了其对碳青霉烯类抗菌药物的耐药性。有研究结果表明,替加环素的抗菌作用机制是以阳离子-四环素类复合物穿过细菌外膜,积聚于包膜间质,再通过弥散方式透过细胞膜进入细胞质,并与核糖体30S亚基结合,阻断氨酰基-转移RNA进入A位点,通过阻断肽链的延长来抑制细菌蛋白质的合成及细菌的生长[14]。本研究联用亚胺培南和替加环素,计算FICI指数,分析得出2种药物联用对MPA主要为协同及相加作用,无拮抗作用,替加环素能明显降低亚胺培南的MIC50值(P<0.05),在相同的给药浓度下,联合用药的抗菌作用明显增强。
有生物膜的MPA对抗菌药物的耐药性逐渐增强,给临床治疗带来极大困扰,单独使用1种抗菌药物难以清除生物膜。目前,在破坏细菌生物膜的方法中,碳青霉烯类抗菌药物与小剂量大环内酯类抗菌药物联用效果较好[15],但关于甘氨酰环素类抗菌药物对黏液型细菌体外抑菌作用的研究较少,替加环素甘氨酰环素类抗菌药物主要被用于治疗复杂性腹腔及软组织感染。有研究结果显示,替加环素对鲍曼不动杆菌形成的生物膜具有明显抑制作用,通常作为一、二、三线抗菌药物治疗失败或对青霉素过敏及不能耐受其他药物患者的治疗选择[16]。本研究结果显示,替加环素能够抑制MPA的生物膜,并且在MIC范围内,随着抗菌药物浓度的增加,生物膜抑制的程度逐渐增加。但单独应用不同浓度的亚胺培南(1/4、1/2 MIC)对生物膜的抑制作用无差异,可能是生物膜阻碍了亚胺培南进入生物膜内,导致杀菌作用被抑制。但在亚胺培南浓度相同的情况下,加入1/4或1/2 MIC的替加环素可以使细菌生物膜明显减少;在替加环素浓度相同的情况下,加入1/4或1/2 MIC的亚胺培南也可以使细菌生物膜明显减少,提示2种药物联用可明显抑制MPA生物膜的形成。
抗菌药物的不合理使用使多重耐药菌日渐增多,单独使用抗菌药物难以完全清除处于生物膜保护下的细菌。抗菌药物联合应用不仅能协同抑菌,还可降低药物的毒副作用及诱导突变耐药作用。本研究发现,在体外亚胺培南联合应用替加环素,不仅具有协同抑制MPA的效果,而且还能抑制生物膜的形成,临床应用价值显著。但这种协同作用局限于体外试验,在体内是否有协同作用,仍需要更多的动物实验和临床试验进一步验证。
