小动脉木村病1例
2020-06-29宣瑞红刘小丽
宣瑞红,刘小丽
患者男性,76岁,左眉弓上方皮下小动脉外膜肿物伴瘙痒1年余,为明确诊断,行手术活检。体检未见明显异常。术中见左眉弓上方皮下肿物呈梭形,手术完整切除。
病理检查眼观:送检皮下组织1块,大小2.2 cm×0.5 cm×0.3 cm,肿物界限清楚,未见明显包膜,切面灰红色,实性质中。其内可见2处直径小于0.1 cm的管腔样结构,与周围组织黏连。镜检:多处直径0.05~0.1 cm的小动脉周围淋巴组织增生(图1),淋巴滤泡形成(图2),破坏小动脉外膜;毛细血管内皮细胞增生,形成肉芽肿样结构(图3);嗜酸性粒细胞浸润形成嗜酸性微脓肿(图4),并伴不同程度的纤维化(图5)。免疫表型:生发中心及少量套区细胞CD20阳性(图6),生发中心滤泡树突细胞CD21阳性,生发中心B细胞CD79a弱阳性,滤泡其余细胞阳性,滤泡生发中心Ki-67高表达,其余区域Ki-67增殖指数均较低,均显示滤泡结构存在。
病理诊断:嗜酸性粒细胞增生性淋巴肉芽肿。
讨论木村病是一种特殊的淋巴组织增生性疾病,也称为嗜酸性粒细胞增生性淋巴肉芽肿,最早由中国学者金显宅提出,1948年日本学者Kimura再次报道。该病好发于亚洲人,通常累及头颈部皮下组织、淋巴结、口腔、腋窝、腹股沟、四肢和躯干等部位,眼眶、眼睑和眼外肌发病文献报道较少[1]。该病病程较长,中青年男性占主导地位,男女比为3.5 ∶1,可单发也可多发,常伴瘙痒及外周血嗜酸性粒细胞增高及免疫球蛋白IgE水平升高[2],无其他不良反应,病因尚不明确,可能的因素包括过敏、感染、节肢动物咬伤、T细胞调控异常、嗜酸性粒细胞动力学异常和IgE合成异常。手术切除常有复发,非甾体消炎药、类固醇激素、冷冻疗法、化疗、放疗、激光治疗可作为术后辅助治疗[3]。
病理学检查是诊断该病的关键,表现为大量淋巴细胞浸润,形成淋巴滤泡,大量的嗜酸性粒细胞浸润,形成嗜酸性微脓肿,血管内皮细胞增生,形成肉芽肿样结构,不同程度的纤维胶原组织增多[4]。
鉴别诊断:木村病需与其他淋巴组织增生性病变鉴别,主要是血管淋巴样增生伴嗜酸性粒细胞增多症(angiolym-phoid hyperplasia with eosinophilia, ALHE),又称上皮样血管瘤,该病更少见,常见部位是头颈部,属于良性血管肿瘤[5],主要组织学特征是大小不等的血管增生,且内皮细胞胞质丰富、肿胀,形成上皮样或组织细胞样结构,周围浸润的炎细胞以T淋巴细胞为主,淋巴滤泡形成较少,其本质为良性血管瘤,免疫组化标记CD3、CD34均阳性,CD20阴性。木村病毛细血管内皮细胞增生,形成肉芽肿结构,增生的是薄壁血管,且非肿瘤性增生;炎症细胞主要是B淋巴细胞为主,免疫组化标记CD20、CD79a阳性,伴有嗜酸性粒细胞,且可形成淋巴滤泡,免疫组化标记能清楚显示滤泡结构。
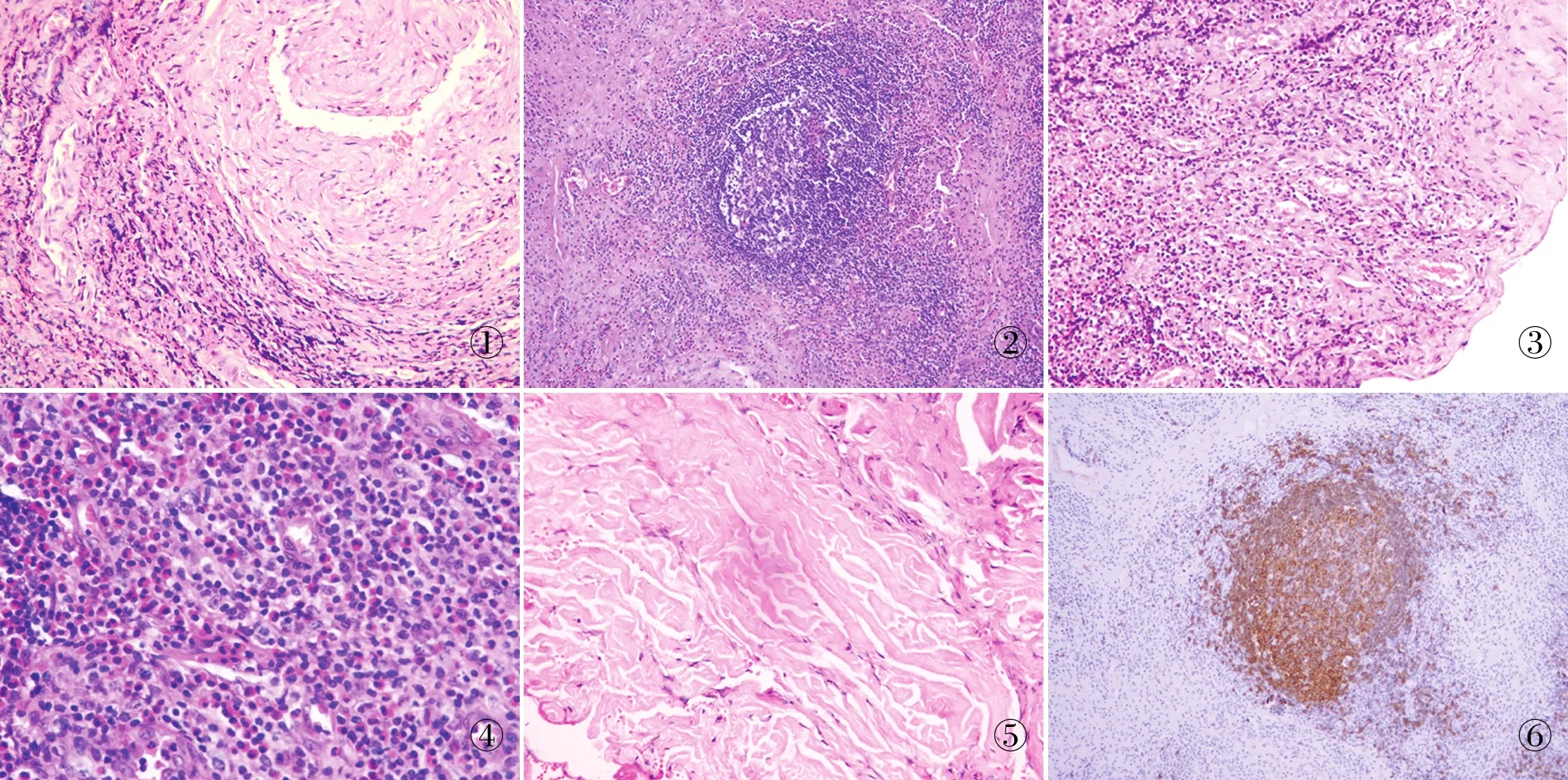
图1 小动脉周围可见淋巴细胞广泛浸润 图2 淋巴滤泡形成 图3 血管内皮细胞增生,形成肉芽肿样结构 图4 大量的嗜酸性粒细胞浸润,形成嗜酸性微脓肿 图5 伴不同程度的纤维化 图6 生发中心及少量套区细胞CD20阳性,显示滤泡结构存在,EnVision法
另外,有文献报道木村病可导致肾病综合征,诱发可逆性的继发性膜性肾病,单纯激素治疗效果不明显,随着肿块增大,蛋白尿和氮质血症均加重。手术切除肿块后,肾脏功能可恢复正常。该表现可能由未知的分泌分子引起[6-7]。系膜增生、嗜酸性细胞浸润和足突融合是这类患者的显著组织学特征。患者对强的松治疗敏感,但易复发。局部切除术有助于防止复发[6]。
有学者对木村病的细胞学进行分析,其镜下表现与组织学检查结果相关。细胞学特征包括:大量淋巴细胞、大量嗜酸性粒细胞、胶原组织碎片、内皮细胞、偶见的多核细胞。但此类细胞学特征并非木村病特有,其他肿瘤可能有类似的疾病表现及细胞学表现。在诊断木村病之前必须排除这些因素。探讨木村病的细胞学特点需紧密结合临床病理学特征[8]。
