胃肠肿瘤病人术前营养状况筛查及危险因素分析
2020-06-29董妞,吕阳
董 妞,吕 阳
营养不良是胃肠道肿瘤病人较常见的并发症之一,发生率高达40%~80%,且约1/3的病人存在厌食、进行性体重下降、贫血或低蛋白血症等[1]。营养不良使病人面临创伤愈合减慢、免疫功能低下、骨骼肌功能下降,心肺功能不全的危险,从而增加手术相关并发症、再住院率和病死率,延长住院时间并增加病人的经济负担[2]。近年大量临床证据表明:围术期营养支持治疗可改善胃肠手术病人的预后[3-4]。而营养风险筛查是营养支持治疗的前提,术前通过营养状况的筛查了解病人的营养状况,可为临床医师针对不同病人采取个性化的营养支持方案提供理论依据。鉴于此,本研究选取2018年6月—2019年5月入住某三级甲等医院接受胃肠道肿瘤手术的病人作为研究对象,分析其术前营养状况及营养不良发生的可能危险因素,为临床营养干预提供循证依据,以降低手术相关并发症的发生率,改善病人的临床结局,提高手术的治疗效果。
1 资料与方法
1.1 研究对象
采用前瞻性研究方法,选取2018年6月—2019年5月入住某三级甲等综合医院胃肠外科拟行胃肠道恶性肿瘤切除术的病人526例。纳入标准:①年龄18~90岁的胃癌或结直肠癌病人;②入院后拟行手术治疗;③术后病理检查结果显示原发性胃肠道肿瘤;④意识清醒且愿意配合者。排除标准:①术前已进行新辅助治疗;②术后病理检查结果显示良性病变;③合并有其他恶性肿瘤;④合并严重感染、水肿或脏器功能衰竭者。
1.2 营养状况评估方法
采用营养风险筛查工具2002(Nutrition Risk Screening 2002,NRS 2002)于病人入院24 h内完成营养状况评估。NRS 2002是中华肠内肠外营养协会首推用于病人的营养风险筛查表[5],不仅应用相对简单,且具有循证医学证据[6]。我国学者龚丽青等[7-8]的研究证实,NRS 2002筛查工具在肿瘤病人中具有较好的适用性。NRS 2002包括3个维度[9]:疾病相关评分、营养状况评分及年龄评分(年龄≥70岁者得1分,否则为0分),其中营养状况评分涉及病人的体质指数(BMI)、近期体重变化、膳食摄入变化3部分内容。总分≥3分说明病人存在营养风险,需根据其具体情况制定个性化的营养支持方案;评分<3分者暂无营养风险,但需持续临床观察,每周至少进行营养评估1次。
1.3 临床资料
在查阅国内外文献资料及咨询胃肠外科专家的基础上,制定胃肠肿瘤病人一般资料收集表,包括病人的一般基本资料如年龄、性别、身高、体重(病人身高、体重的测量方法为住院次日晨起空腹、着薄衣、免鞋测量);血液检查结果(住院次日晨起抽血化验所得)如中性粒细胞/淋巴细胞比值(NRL)、血红蛋白、白蛋白、前白蛋白,肿瘤标志物如癌胚抗原(CEA)、糖类抗原125(CA125)、糖类抗原19-9(CA19-9)、糖类抗原724(CA724)、肿瘤发生的部位、分化程度等。
1.4 统计学方法

2 结果
2.1 研究对象的基本资料
本研究共纳入2018年6月—2019年5月入住某院胃肠外科的胃肠肿瘤病人526例,其中男312例,女214例,年龄25~76(54.22±8.31)岁。从原发疾病看,胃癌298例,结肠癌130例,直肠癌98例;NRL≥2.32的病人296例,NRL<2.32的病人230例(NRL临界值的计算方法:制作ROC曲线,以敏感性和特异性之和的最大值作为最佳临界值);肿瘤标志物阳性检出率:CEA 97例,CA125 72例,CA19-9 86例、CA724 94例;肿瘤分化程度:高分化84例,中高分化72例,中分化152例,中低分化135例,低分化83例。
2.2 病人营养状况筛查结果分析
调查结果显示526例病人中NRS 2002评分≥3分者275例,占52.28%。进食量减少、体重下降、低BMI、低白蛋白、低前白蛋白在胃肠恶性肿瘤病人中的发生率较高。最常发生的为近3个月内进食量减少,发生率达62.36%,其次为体重下降(47.15%)、低前白蛋白(45.06%)、低血红蛋白(41.44%)、低白蛋白(11.22%)、低BMI(9.32%)。胃肠肿瘤病人营养相关指标的调查结果详见表1。
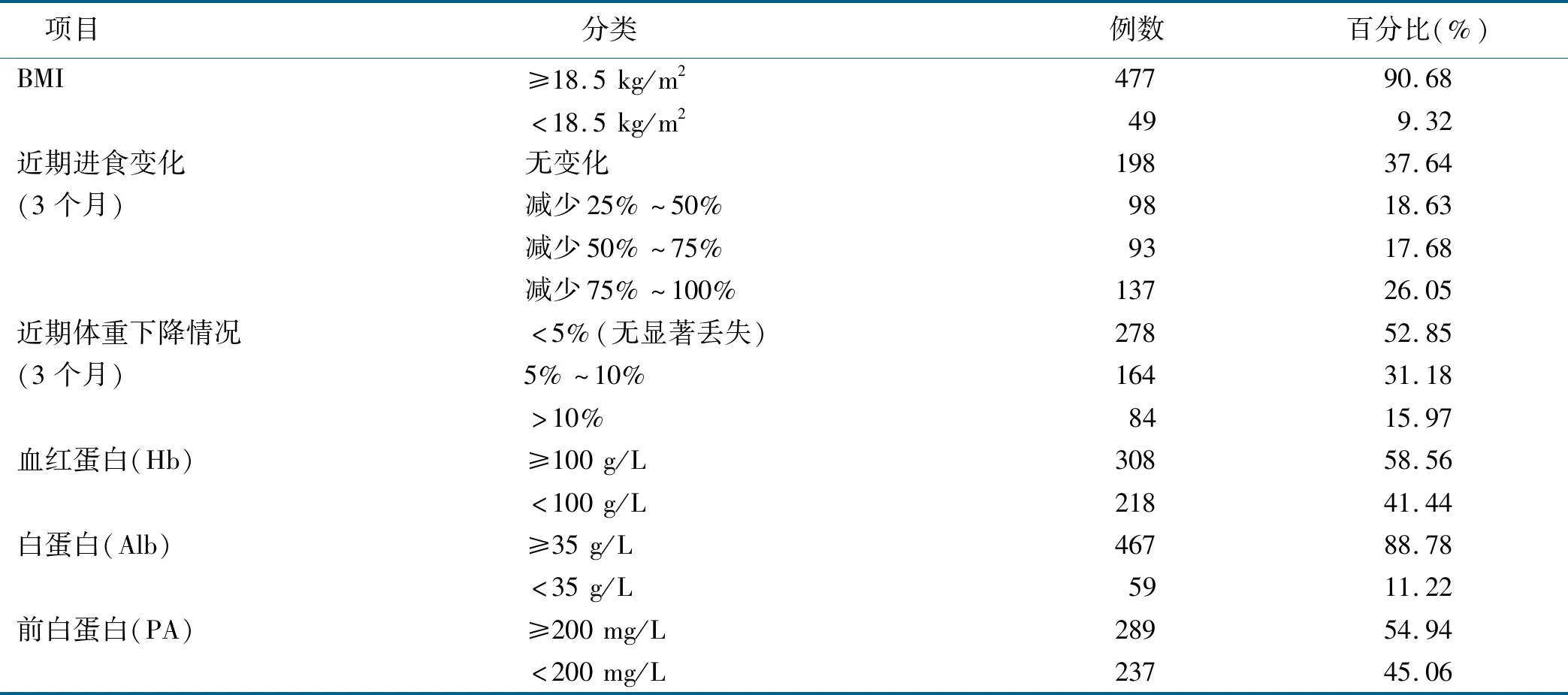
表1 胃肠道恶性肿瘤病人营养相关指标调查结果 (n=526)
2.3 不同病人发生营养不良危险因素的单因素分析
单因素分析结果表明,不同年龄、NRL、CEA、CA125含量及肿瘤细胞分化程度病人的营养不良发生率相比差异有统计学意义(P<0.05),结果详见表2。
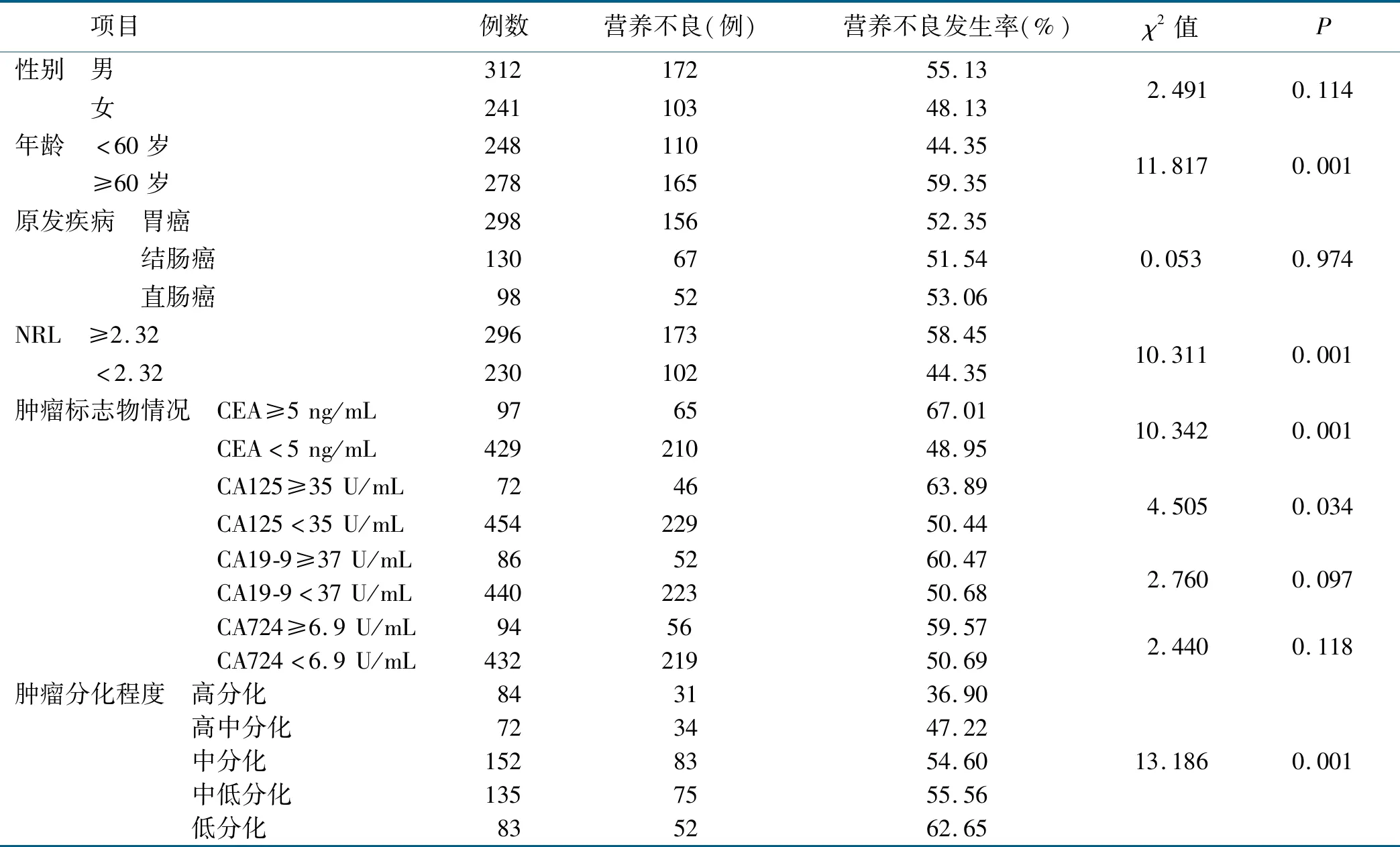
表2 胃肠肿瘤病人营养不良风险的单因素分析 (n=526)
2.4 不同病人发生营养不良危险因素的Logistic回归分析
将营养不良作为因变量,以单因素分析结果中差异有统计学意义的项目作为自变量进行Logistic回归分析,结果显示,年龄、NRL、肿瘤标志物CEA以及肿瘤分化程度是胃肠肿瘤病人发生营养不良的独立危险因素。结果见表3。
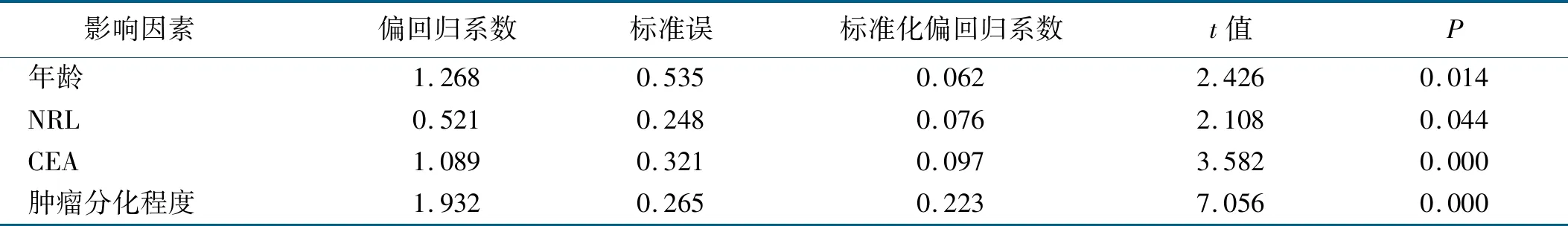
表3 胃肠肿瘤病人营养不良风险的Logistic回归分析 (n=526)
3 讨论
3.1 胃肠肿瘤病人营养状况分析
本研究结果显示,526例胃肠肿瘤病人营养不良的发生率达52.28%,与我国学者杜艳平等[10-11]的研究结果相近,低于丰大利等[12]的调查结果,可能与其调查的胃肠肿瘤病人大多处于中晚期有关,提示多数病人术前均需要进行营养支持。在进食量减少、体重下降、低BMI、低血红蛋白、低白蛋白、低前蛋白等营养指标中,以进食量减少的发生率最高,达62.36%。食欲减低所致的进食量减少是发生营养不良的早期表现。Kuppinger等[13]指出进食量减少是早期及时进行营养干预的最有意义的依据。肿瘤病人本身的高代谢状态使病人的能量消耗增加,加之肿瘤相关症状如恶心、呕吐、进食量减少等,致使病人出现体重下降,BMI降低。低血红蛋白主要与胃肠肿瘤病人合并的隐性失血有关。本研究中有11.22%的病人术前白蛋白低于35 g/L,有学者的研究表明,胃肠手术病人术后白蛋白平均较术前降低10 g/L,术后低蛋白可引起肠道水肿等并发症,而术前高蛋白摄入可将病人的平均住院日减少4 d[14]。为此,对此类病人,术前应积极纠正低蛋白血症,最好将白蛋白提升到40 g/L,以降低术后低蛋白血症所致的肠道水肿及与此相关并发症的发生率。
3.2 胃肠肿瘤病人营养不良发生的危险因素分析
单因素分析结果表明年龄、NRL、CEA、CA125、肿瘤分化程度是胃肠肿瘤病人发生营养不良的可能危险因素。为排除混杂因素的干扰,行Logistic回归分析,结果显示年龄、NRL、CEA、肿瘤分化程度是胃肠肿瘤病人发生营养不良的独立危险因素。老年病人随着年龄的增长,机体各脏器功能减退,防御疾病及消化吸收能力减弱,因此发生营养风险的概率较高。本研究结果显示,年龄≥60岁病人的营养不良发生率是<60岁病人的1.34倍。且我国学者王雷等[15-16]的研究结果表明,60岁以上病人发生营养风险的概率较中青年病人高。营养不良常伴随着代谢紊乱,其中炎症因子发挥着重要作用,不少研究证实NRL是消化道肿瘤不良结局的独立预测因素[17]。本研究结果显示,NRL≥2.32病人的营养不良发生率是NRL<2.32病人的1.32倍。肿瘤标志物是瘤体组织在生长代谢过程中产生的排放到血液中的活性物质,也是肿瘤早期诊断的最有价值的指标[18]。各肿瘤标志物阳性检出率越高,越能说明病人发生肿瘤的概率越大,与此相关疾病对病人各系统造成的不利影响越大。本研究结果显示,CEA≥5 ng/mL病人营养不良的发生率是CEA<5 ng/mL病人的1.37倍。且近年大样本研究表明CEA是胃肠肿瘤病人预后不良的独立相关因素,术前较高水平的CEA提示远处转移尤其是肝转移的风险越高,提示病人的病情较重[17]。肿瘤细胞分化程度越低,说明肿瘤的恶性度越高,表明肿瘤对机体各系统造成的影响越严重,进而病人发生营养不良的风险就会越高。且本研究结果表明,随着病人肿瘤细胞分化程度的降低,胃肠肿瘤病人营养不良发生率越高。
4 小结
胃肠肿瘤病人因疾病本身造成的食欲减退、恶心、呕吐、潜在失血等,导致多数病人合并有营养不良的风险,加之围术期病人常处于应激性饥饿状态,营养物质摄入不足、机体消耗增加以及创伤炎症反应均加重病人已存在的氮丢失和机体组织消耗,进而影响病人的临床结局。因此,为改善病人的临床结局,确保手术治疗效果,术前营养状况的筛查及个性化的营养支持势在必行。营养不良危险因素可为临床医师对潜在风险病人采取前瞻性的营养干预提供理论依据,本课题组下一步预建立术前营养不良风险模型,以便识别潜在营养不良病人,使营养干预前移,规避手术相关的并发症,进而提高病人的临床治疗效果。
