弹性超声、细针穿刺细胞学检查、BRAF基因检测对甲状腺恶性结节术前诊断价值分析
2020-06-26王玉国武心萍隆仙琴谈芝含丁文波
王玉国, 武心萍, 隆仙琴, 谈芝含, 丁文波
在甲状腺恶性病变中,乳头状癌最为常见,占80%~90%,尤其是微小乳头状癌的出现,大大提升了乳头状癌所占比例。良性结节中,结节性甲状腺肿最为常见[1]。由此可见,甲状腺良恶性结节的鉴别最主要是乳头状癌和结节性甲状腺肿的鉴别。目前超声检查是发现和评估甲状腺结节最常用的技术手段,高分辨率超声和高频传感器的应用甚至可以检测到2~3 mm的病变,弹性超声(ultrasonic elastography,UE)问世的20余年来,作为一种完全独立存在、人为依赖性极低的成像模式,在临床中已作为一种常规的检查方法在应用[2]。细针穿刺病理学检查(fine needle aspiration cytology,FNAC)被国内外指南推荐作为术前评估甲状腺结节良恶性的最佳方案,目前多采用Bethesda报告系统。BRAF基因突变对于乳头状甲状腺瘤来说是一种重要的诊断标记物,BRAF基因突变与甲状旁腺浸润、淋巴结转移和复发具有明显的相关性。本研究对弹性超声、FNAC、BRAF基因检测三种方法的单一及联合应用的诊断价值做一探讨,为临床判断提供参考。
1 资料与方法
1.1 一般资料
收集2015年1月至2017年12月南京中医药大学附属中西医结合医院甲状腺外科住院行手术切除的193例患者病例资料。男44例,女149例,年龄21~64岁,平均年龄(42.65± 5.6)岁,纳入标准:① 术前接受甲状腺UE、FNAC及BRAF基因检测;② 获得医院伦理委员会批准,患者知情同意。排除标准:① 既往有甲状腺手术或者甲状腺转移瘤患者;② FNAC中无法判断良恶性或取材不满意的。
1.2 方法
1.2.1 弹性超声检查 采用日立-二郎神型超声诊断仪,频率为4~9 MHz线阵探头检查,受检者取仰卧位,头部过伸以充分暴露颈部,记录甲状腺形态、大小、边界情况,检查甲状腺内部是否有结节状结构,观察其大小、边界、内部回声、弹性评分等。弹性超声评分:每个结节的横切和纵切弹性图分别进行Asteria弹性评分(elastography score,ES)。根据甲状腺肿瘤内部红色、蓝色及绿色的组成比例评分,0分:病灶区为囊性,基本不见实性成分,表现为红蓝绿三色相间;1分:病灶整体显示为绿色;2分:病灶大部分显示为绿色(绿色区域面积>50%);3分:病灶范围内显示蓝色为主(蓝色区域面积50%~90%); 4分: 病灶几乎为蓝色覆盖(蓝色区域面积>90%)[3-4]。甲状腺占位性病变弹性图像分级越高,说明甲状腺占位的弹性系数大,硬度高,恶性程度越高;甲状腺占位性病变弹性图像分级越低,说明甲状腺占位的弹性系数小,硬度低,良性可能越大。以弹性评分3分为诊断界点,≥3分为恶性(UE诊断为阳性),<3分为良性(UE诊断为阴性)。运用甲状腺占位超声弹性图像特点,鉴别诊断甲状腺良恶性肿瘤。
1.2.2 细针穿刺穿刺病理学检查 患者保持仰卧位,垫高颈部,头朝后仰,使穿刺部位充分暴露,找好穿刺点,并进行标记。常规消毒穿刺部位后,铺无菌方巾,运用利多卡因对患者进行局部麻醉,按照常规方法,在超声引导下运用负压穿刺器对患者进行穿刺取样。完成取样后,及时送至病理科进行涂片镜检,FNAC报告采用Bethesda报告系统进行分类。Ⅰ:取材无法诊断或不满意(恶性风险1%~4%);Ⅱ:良性病变(恶性风险0~3%);Ⅲ:意义不明的细胞非典型性病变或意义不明的滤泡性病变(AUS/FLUS)(恶性风险5%~15%);Ⅳ:滤泡性肿瘤或可疑滤泡性肿瘤(FN/SFN)(恶性风险15%~30%);Ⅴ:可疑恶性肿瘤(恶性风险60%~75%);Ⅵ:恶性肿瘤(恶性风险97%~99%)。本研究剔除Bethesda报告系统结果为Ⅰ、Ⅲ的病例,结果为Ⅱ判定为良性(FNAC诊断为阴性),Ⅳ、Ⅴ、Ⅵ判定为恶性(FNAC诊断为阳性)。
1.2.3 BRAF基因检测 在超声引导下进行负压穿刺取样,BRAF基因突变检测试剂盒采用ADx-ARMS®专利技术,利用新型探针在实时PCR平台上实现对BRAF基因突变的检测。BRAF基因突变结果分阳性和阴性两类,本研究阳性结果判定为恶性,阴性结果判定为良性。
1.3 统计学方法
数据采用SPSS 18.0软件进行统计学分析,以术后组织病理结果为金标准,评估UE、FNAC、BRAF基因检测诊断甲状腺恶性结节的灵敏性和特异性,绘制诊断甲状腺结节的ROC曲线,计算曲线下面积(area under the curve,AUC)。联合诊断的结果判定:联合应用项目中全部结果为阳性, 则结果为阳性,以P<0.05表示差异有统计学意义。Z检验比较UE、FNAC、BRAF基因检测诊断甲状腺恶性结节AUC的差异,以P<0.05为差异有统计学意义。
2 结果
2.1 UE、FNAC、BRAF基因检测与术后病理对比
UE、FNAC、BRAF基因检测与术后病理结果对比见表1。
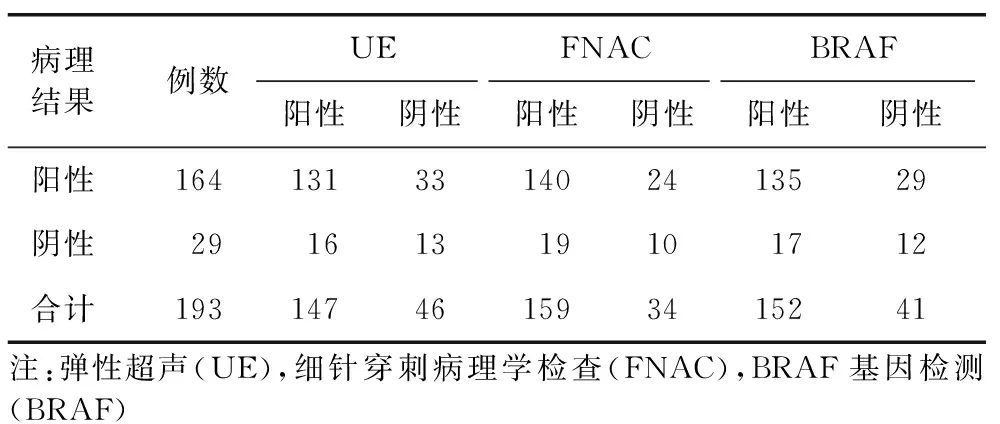
表1 UE、FNAC、BRAF与术后病理结果对比 (例)
2.2 单一诊断价值比较
UE、FNAC、BRAF三种方法在诊断甲状腺恶性结节的灵敏性方面为80.5%vs. 85.4%vs. 85.4%;特异性分别为46.4%vs. 35.7%vs. 39.3%;曲线下面积UE(0.635)高于FNAC(0.605)和BRAF(0.623), 差异有统计学意义(P<0.05),见表2及图1。
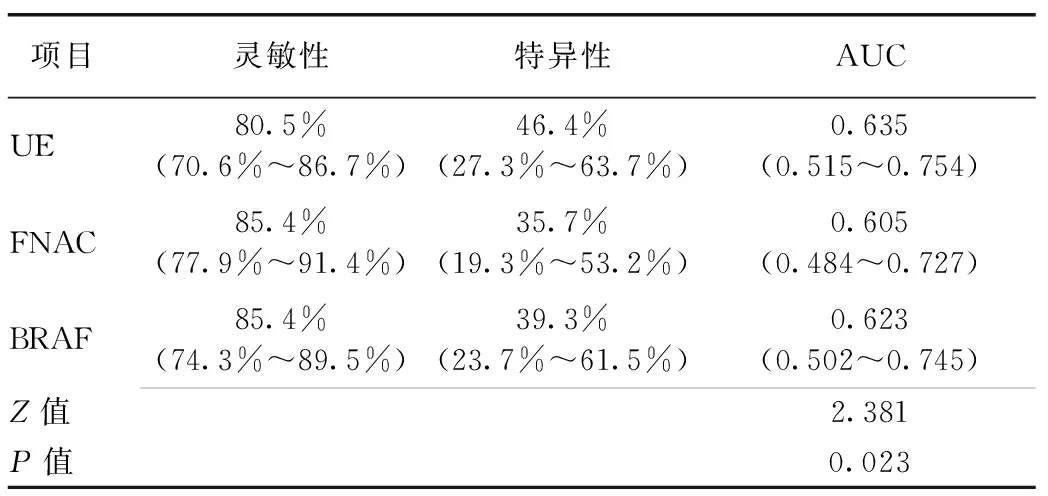
表2 UE、FNAC、BRAF三种单一方法诊断价值比较
注:弹性超声(UE),细针穿刺病理学检查(FNAC),BRAF基因检测(BRAF)
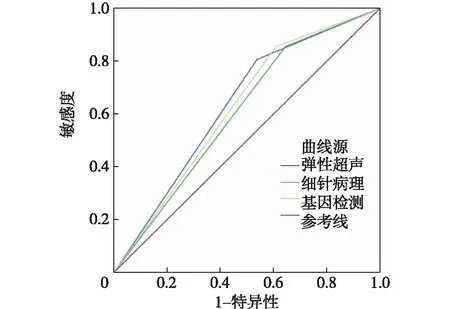
图1 弹性超声、细针穿刺病理学、BRAF基因诊断甲状腺恶性结节的ROC曲线
2.3 两两联合诊断价值比较
两两联合比较中,灵敏性从高到低依次为:FNAC+BRAF、UE+BRAF、UE+FNAC,特异性从高到低依次为:UE+FNAC、UE+BRAF、FNAC+BRAF;AUC从高到低依次为:UE+FNAC、UE+BRAF、FNAC+BRAF,差异有统计学意义(P<0.05),见表3及图2。
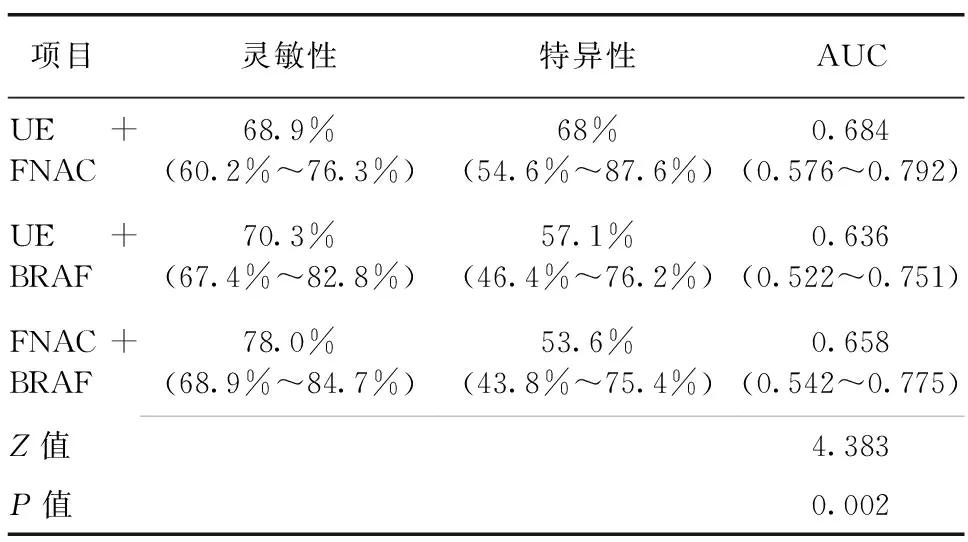
表3 UE、FNAC、BRAF任意两两联合的诊断价值比较
注:弹性超声(UE),细针穿刺病理学检查(FNAC),BRAF基因检测(BRAF)
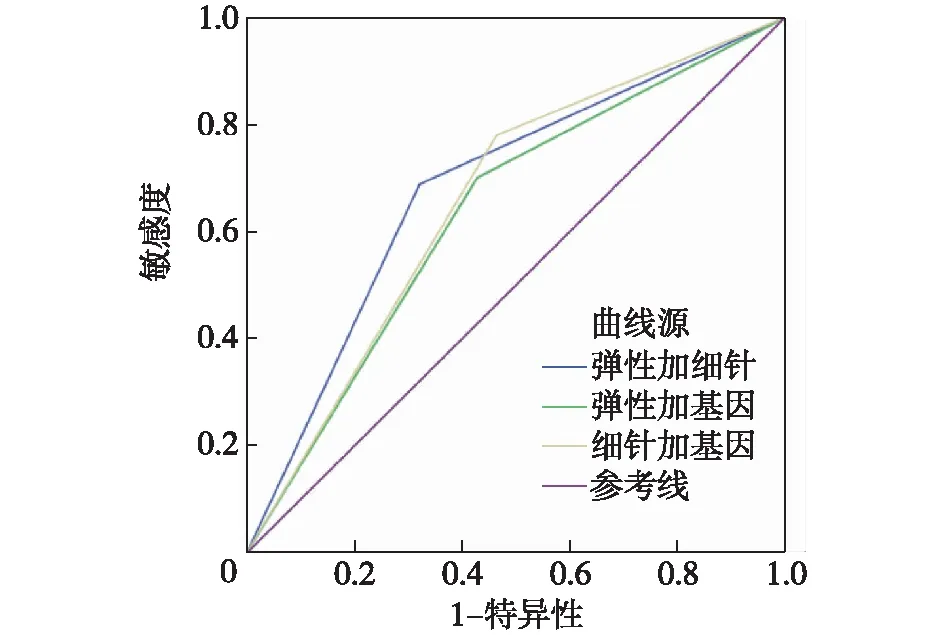
图2 两两联合诊断甲状腺结节的ROC曲线
2.4 三者联合诊断价值结果 三者联合后灵敏性虽然降低,为63.4%(52.8%~71.80%),但特异性提高到78.6%(68.9%~96.8%),且诊断效能达到0.710(0.611~0.809)。
3 讨论
常规超声中结节微钙化、形态不规则、低回声、纵横比>1及血流信号丰富是恶性结节的独立危险因素,尽管这些特征具有较高的特异性,敏感性却较低,单个可疑特征无法区分结节的良恶性,同时具备2个特征才高度提示恶性结节。有相关研究表明:采用常规超声成像有30.5%的良性甲状腺结节与恶性甲状腺结节难以诊断[5-6]。随着UE的逐渐普及,弹性评分作为一种新的诊断方法逐渐得到认可。刘丽等[7]比较常规超声检查对甲状腺结节良恶性诊断的灵敏度、特异度、阳性预测值、阴性预测值及诊断准确率分别为62.96%、69.62%、41.46%、84.61%、67.92%,明显低于UE检查的92.59%、91.14%、78.13%、97.30%、96.22%(均P<0.05),提示与常规超声成像检查比较,UE检查对甲状腺结节的诊断率高,且UE能更准确诊断甲状腺结节良恶性状态。
Nell等[8]甚至认为UE可以取代FNAC检查对甲状腺软结节进行诊断。Trimboli 等[9]筛选出8 项对FNAC 检查不确定的结节行UE检查的研究(共486枚结节)进行荟萃分析,其结果显示UE对经FNAC检查不确定的结节诊断的敏感度为69%,特异度为73%。UE优于普通超声原因可能为:UE是通过计算机技术对甲状腺结节的病灶硬度进行客观量化,大大降低操作者的主观误差,从而提高了诊断的特异性、灵敏性和准确性[10],但UE的弱点是静态应变弹性图上呈现的是病灶相对于周边组织的相对硬度,在患者脏器存在弥漫性病变(如桥本氏甲状腺炎、结节性甲状腺肿等)的情况下,UE本底硬度增加,占位病灶的硬度可能与本底相同或者比本底要软,此时极易导致恶性肿瘤的漏诊及误诊,另外,超声医师操作经验和技术与诊断的准确性也有着密切的关系[11-12],因此还要结合甲状腺FNAC或基因检测。
尽管目前FNAC是甲状腺恶性肿瘤术前诊断敏感度和特异度最高的方法,但是仍有0.7% ~15.0%的甲状腺结节无法通过其确诊[12]。因为取样量少,无法将病灶组织的全貌充分反映出来,尤其是判断转移病灶,其局限性较大,具有较高的漏诊率。
近年来BRAF基因检测成为甲状腺癌的研究热点,BRAF基因检测对甲状腺乳头状癌具有较好的特异性,在乳头状癌患者中的检出率达到29%~84%,而良性病变不表达[13],在其他病理类型中表达也很少,通过持续刺激促分裂原活化蛋白激酶(MAPK)信号通路促进肿瘤的发生和发展[14]。但BRAF基因检测对甲状腺其他类型肿瘤不敏感,容易漏诊,且价格昂贵。
本研究中单一诊断方面,UE效能显著高于FNA检查和BRAF基因检测(P<0.05);两两联合诊断方面,UE联合FNAC诊断效能最高,而三者联合后的灵敏性虽然降低,但特异性提高到78.6%,且AUC诊断效能达到0.710,提示三种方法可互相弥补缺陷,临床上合理选择,联合应用后可提高诊断特异性,避免不必要的手术,减轻患者身心痛苦和经济负担,有效节约医疗资源。
