人乳头瘤状病毒16/18型蛋白E6及P53蛋白在宫颈癌前病变中的表达及相关性分析
2020-06-26李欣李清虹
李欣, 李清虹
在世界范围内,宫颈癌发病率居于女性恶性肿瘤的第二位,原位癌高发年龄为30~35岁,浸润癌高发年龄为45~55岁,高危型人乳头状瘤病毒(HPV)持续感染被认为是宫颈癌的主要危险因素,临床研究已经证实超过90%的宫颈癌伴有高危型HPV感染[1-2],其中HPV16、18型是引起宫颈癌最多的病毒类型,超过70%[3]。对HPV进一步研究发现,E6蛋白在阻止细胞凋亡和分化,控制细胞形状和信号传导方面起重要作用[4]。P53基因在已经发现的抑癌基因中处于比较重要的地位,对细胞的生长具有负调控的作用[5]。有研究认为,HPV16型和HPV18型的早期蛋白E6与P53蛋白的相互作用是导致宫颈癌发生发展的重要机制[6]。但是宫颈癌前病变中二者的表达和相互关系的研究较少,为此我们进行了相关研究,现报道如下。
1 资料与方法
1.1 一般资料 组织标本选自沧州市人民医院2017年1月至2018年8月经手术切除且经病理确诊为不典型增生宫颈组织蜡块120例,其中轻度不典型增生(CIN Ⅰ级)组34例,中度不典型增生(CIN Ⅱ级)组44例,重度不典型增生(CIN Ⅲ级)组42例。另选择因子宫肌瘤行子宫全切或次全切除标本中正常宫颈组织蜡块40例作为对照组。
1.2 免疫组化检测HPV 16/18型E6蛋白及P53蛋白表达 LSAB Lit和P53蛋白单克隆抗体(DO-7)购自DAKO公司;HPV 16/18型E6蛋白单克隆抗体(DP-12)购自Oncogen Science公司;SP试剂盒、DAB显色试剂盒均购自北京中杉金桥公司;SABC免疫组化试剂盒购自北京中山生物技术有限公司。病理组织蜡块切片,68 ℃烤片12 h,常规二甲苯脱蜡,梯度酒精脱水,放置于98 ℃ EDTA缓冲液中煮沸3 min,自然冷却20 min,冷水冲洗高压锅至室温,PBS冲洗3次,每次2 min,以修复抗原。阻断灭活内源性过氧化物酶,滴加一抗,室温放置3 h,使用PBS冲洗3次,每次2 min,滴加二抗,37 ℃孵育30 min,PBS冲洗3次,每次2 min,给予DAB反应染色,常规脱水,透明、干燥、封片。
1.3 结果判定 E6及P53蛋白定位于细胞核上,出现棕黄色染色为阳性细胞,阳性细胞数量<10%为(-),10%~25%为(+),26%~50%为(++),>50%为(+++)。所有标本均给予免疫组化检查,每份标本分为两份,分别测定HPV16/18 E6蛋白及P53蛋白。观察4组的HPV16/18 E6蛋白、P53蛋白的表达情况。请两位资深技师分别对结果进行判定,如果结论不一致则协商确定。
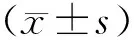
2 结果
2.1 各组间HPV16/18 E6蛋白表达情况的比较
CIN Ⅰ、Ⅱ、Ⅲ级组与对照组之间HPV16/18 E6蛋白阳性表达率差异具有统计学意义(P<0.05),其中CIN Ⅰ级组、CIN Ⅱ级组间比较差异无统计学意义(χ2=0.007,P=0.934);CIN Ⅰ级组低于CIN Ⅲ级组(χ2=3.866,P=0.049);CIN Ⅱ级组低于CIN Ⅲ级组(χ2=3.965,P=0.046),详见表1。
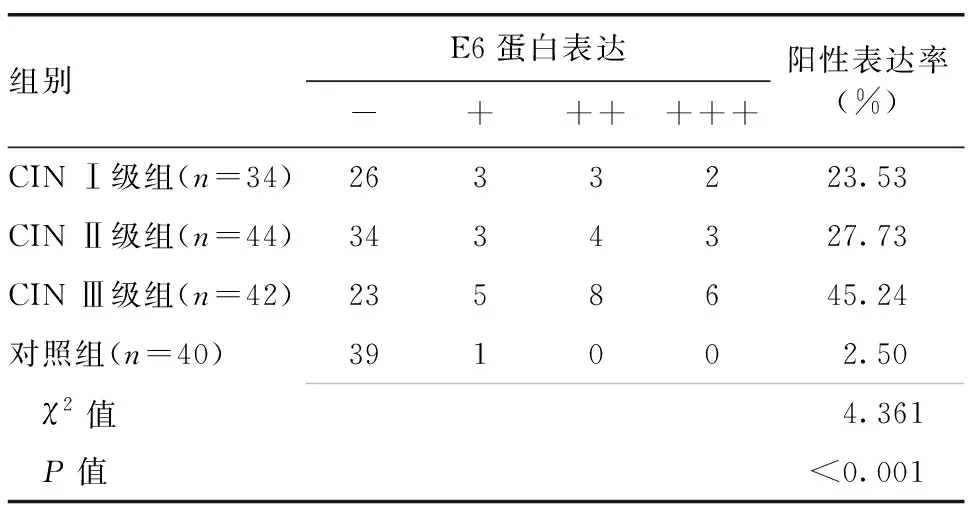
表1 CIN Ⅰ、Ⅱ、Ⅲ级组与对照组间HPV16/18 E6蛋白表达的比较
2.2 各组间P53蛋白表达情况的比较 CIN Ⅰ、Ⅱ、Ⅲ级组与对照组的P53蛋白阳性表达率差异具有统计学意义(P<0.05),其中对照组P53蛋白阳性表达率最高为72.50%,CIN Ⅲ级组P53蛋白阳性表达率最低为14.29%,详见表2。
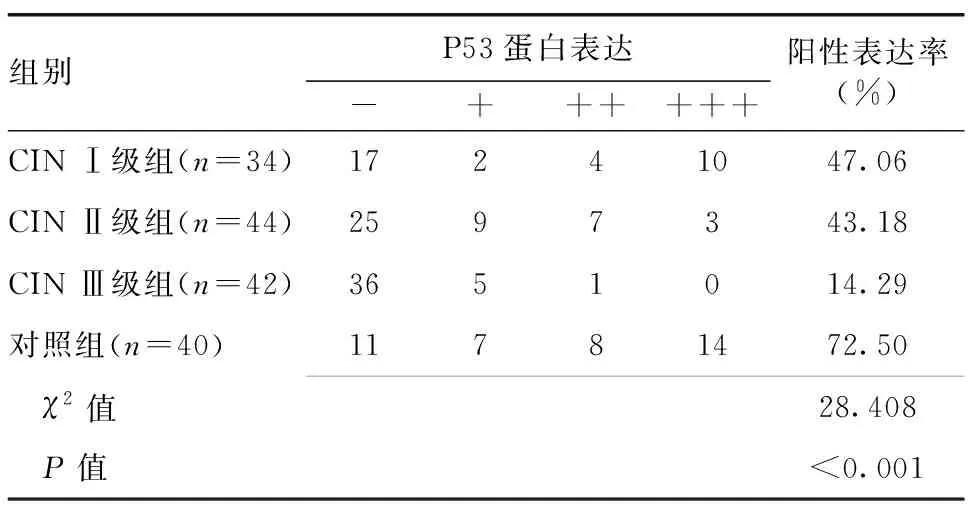
表2 CIN Ⅰ、Ⅱ、Ⅲ级组与对照组间P53蛋白表达的比较
注:CIN Ⅰ级组与CIN Ⅱ级组比较(χ2=0.117,P=0.733);CIN Ⅰ级组与CIN Ⅲ级组比较(χ2=9.812,P=0.002);CIN Ⅰ级组与对照组比较(χ2=4.992,P=0.025);CIN Ⅱ级组与CIN Ⅲ级组比较(χ2=8.702,P=0.003);CIN Ⅱ级组与对照组比较(χ2=7.354,P=0.007);CIN Ⅲ级组与对照组比较(χ2=28.380,P<0.001)
2.3 各组间HPV16/18 E6、P53阳性表达的相关性分析 CIN Ⅰ、Ⅱ、Ⅲ级组与对照组患者P53阳性表达在HPV16/18 E6的阳性表达中的占比存在组间差异,其中对照组为100.00%,高于其他组别,CIN Ⅲ级组最低为21.05%,见表3。使用Spearman等级相关分析结果显示,HPV16/18 E6阳性表达和P53阳性表达之间呈负相关(r=-0.724,P=0.037)。
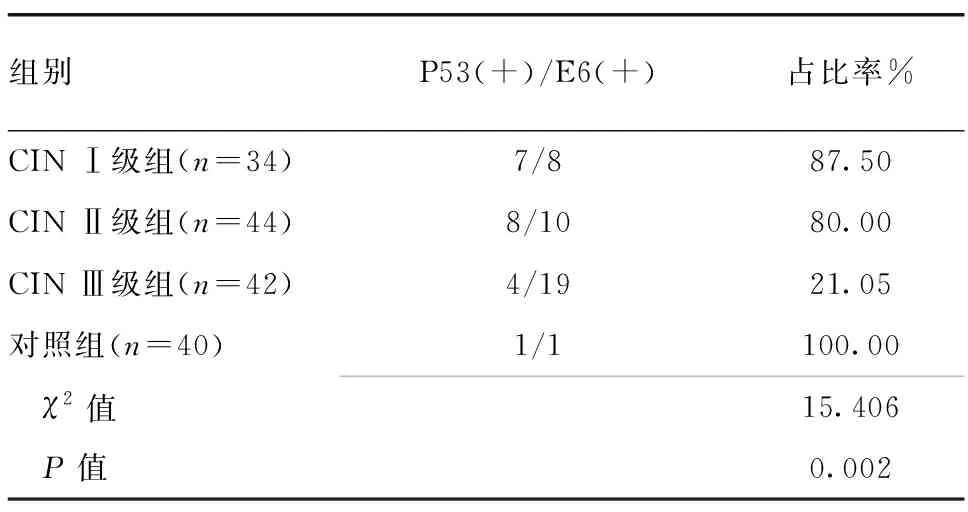
表3 CIN Ⅰ、Ⅱ、Ⅲ级组与对照组P53阳性表达在HPV16/18 E6阳性表达中的占比
注:CIN Ⅰ级组与CIN Ⅱ级组比较(χ2=0.180,P=0.671);CIN Ⅰ级组与CIN Ⅲ级组比较(χ2=10.296,P=0.001);CIN Ⅰ级组与对照组比较(χ2=1.732,P=0.189);CIN Ⅱ级组与CIN Ⅲ级组比较(χ2=9.385,P=0.002);CIN Ⅱ级组与对照组比较(χ2=0.749,P=0.387);CIN Ⅲ级组与对照组比较(χ2=3.419,P=0.047)
3 讨论
宫颈癌一直是临床研究的热点课题之一。宫颈重度上皮内瘤样变是宫颈癌的癌前病变,但具有可逆性,一部分病变能够自然消失,而另一部分病变可能发展成为宫颈癌[7-8]。轻度(CIN Ⅰ级)和中度(CIN Ⅱ级)上皮内瘤样变自然消失的概率要高于重度(CIN Ⅲ级),因此对于CIN Ⅲ级患者的早期诊断就成为改善预后的关键[9]。但是宫颈癌前病变患者通常无明显症状,或者仅有一般的宫颈炎症状,如白带增多,或白带带血、性接触后出现少量阴道流血的症状[10]。这些症状均非特异性,病理检查如果不能取到病变部位则有一定的误诊率和漏诊率。近年来基因层次研究为这一问题的解决提供了新途径[11]。
HPV是最广泛的性传播病毒,其病毒的变种超过100种,而高风险亚种主要为16、18、31、33、35、45、52、58型[12]。宫颈癌的发生与HPV感染高度相关。虽然有80%以上的经产妇有过HPV感染病史,但绝大部分能够经免疫系统将病毒清除而得以自愈,仅极少数E6、E7蛋白高表达的患者最终发展成为宫颈癌。HPV的基因已经被掌握,是无外壳的dsDNA病毒,其基因组为环状结构,共由8种蛋白组成,包括6个早期蛋白和2个晚期蛋白。早期蛋白能够调控基因组复制、转录等功能,其中E6蛋白分为5个功能区,与细胞转化和致瘤性密切相关,在病毒的复制中具有关键作用,能够阻止细胞凋亡和分化,控制细胞形状和信号传导。E6蛋白引起细胞异常的途径通常有3条,其中最显著的功能是通过与E6蛋白结合蛋白的结合而促进P53的失活和降解,其次是介导人类端粒酶,最后是通过靶向含有PDZ结构域的蛋白。P53基因是人体的抑癌基因,其中含有大量的脯氨酸,其野生型能使细胞凋亡,帮助细胞基因修复缺陷,从而防止癌变,已经证实该基因的失活对肿瘤的形成具有重要作用。
本研究发现CIN Ⅰ、Ⅱ、Ⅲ级组与对照组之间HPV16/18 E6蛋白的阳性表达率差异具有统计学意义(P<0.05),其中CIN Ⅰ、Ⅱ级组间比较差异无统计学意义(P>0.05),CIN Ⅰ、Ⅱ级组的HPV16/18 E6蛋白阳性表达率均明显低于CIN Ⅲ级组(P<0.05)。说明E6蛋白在宫颈癌前病变中起到重要作用,其变化水平在CIN Ⅲ级组中显著升高,因此可作为宫颈癌前病变的诊断指标之一。此外,CIN Ⅰ、Ⅱ、Ⅲ级组与对照组之间P53蛋白的阳性表达率也有明显差异,其中对照组的阳性表达率最高,为72.50%,CIN Ⅲ级组阳性表达率最低,为14.29%。说明p53蛋白在宫颈癌前病变的发生发展中起到抑制作用,E6蛋白结合蛋白与E6相结合能够促进p53的失活和降解,而E6蛋白的升高也可能是抑制宫颈癌前病变发展的因素。进一步的相关性分析结果显示,E6蛋白的阳性表达和P53蛋白的阳性表达呈负相关(r=-0.724,P=0.037)。
综上所述,在宫颈癌前病变中HPV16/18 E6蛋白与宫颈癌前病变的发生密切相关,或可作为宫颈癌诊断的指标之一;而P53蛋白对抑制宫颈癌的发生具有重要作用。
