特异性皮下免疫治疗变应性鼻炎的不良反应观察
2020-06-22于青青王跃建许玉霞刘美华
于青青 唐 隽 王跃建 许玉霞 刘美华
广东省佛山市第一人民医院耳鼻咽喉头颈外科,广东佛山 528000
变应性鼻炎(allergic rhinitis,AR)是常见呼吸道变应性疾病,近年来发病率明显上升[1],特异性皮下免疫治疗(subcutaneous immunotherapy,SCIT)因具有阻断和逆转疾病自然进程的优点,近期和远期疗效肯定,已被推荐为变应性鼻炎的一线治疗方案[2-3],但SCIT 治疗过程中可能发生不良反应,甚至严重过敏反应危及生命,故本研究回顾性分析了我科362 例使用阿罗格标准化尘螨变应原制剂免疫治疗患者的不良反应情况,以期探讨不良反应发生的规律及特点。
1 资料与方法
1.1 一般资料
收集2016 年6 月~2018 年9 月在佛山市第一人民医院耳鼻喉科门诊就诊诊断为AR、同意进行阿罗格标准化尘螨变应原制剂SCIT 治疗并完成连续16 周以上的362 例患者。纳入标准:(1)年龄5 ~60 岁。(2)符合变应性鼻炎诊断和治疗指南(2015,天津)[3]中的诊断标准。①症状:打喷嚏、清水样涕、鼻痒和鼻塞等症状出现两个或以上,每天症状持续或累计1h 以上,可伴有眼痒、流泪和眼红等眼部症状;②体征:常见鼻黏膜苍白、水肿,鼻腔水样分泌物;③变应原检测:皮肤点刺试验屋尘螨和粉尘螨变应原阳性2 级以上和血清屋尘螨和粉尘螨变应原特异性IgE(sIgE)≥0.70KU/L。排除标准:(1)妊娠及哺乳期妇女;(2)伴有严重的或未控制的哮喘(FEV1 <70%预计值)以及不可逆的呼吸道阻塞性疾病;(3)合并高血压、冠心病等不宜使用肾上腺素治疗的患者;(4)严重的免疫性疾病;(5)严重的心理障碍或患者无法理解治疗的风险性和局限性;(6)恶性肿瘤。
1.2 方法
1.2.1 标准化尘螨变应原制剂免疫治疗 皮下免疫治疗使用德国默克公司的阿罗格标准化尘螨变应原制剂,疗程分2 个阶段:剂量累加阶段和剂量维持阶段。在剂量累加阶段,每周注射1 次,前12 周的注射剂量分别为浓度1 级(50TU/mL)的变应原注射液0.1、 0.2、0.4、0.8mL,浓度2 级(500TU/mL)的变应原注射液0.1、 0.2、0.4、0.8mL,浓度3 级(5000TU/mL)的变应原注射液0.1、 0.2、0.4、0.6mL。13、14、16 周分别注射浓度3 级(5000TU/mL)的变应原注射液0.8、1.0、1.0mL。16 周后进入剂量维持阶段,保持浓度3 级(5000TU/mL)的变应原注射液1.0mL 剂量不变, 注射间隔时间从4 周逐渐延长至 6 周左右,总疗程3 年。
1.2.2 不良反应观察 不良反应分为局部不良反应和全身不良反应,局部反应包括轻度和严重局部反应,轻度局部反应指注射部位局部瘙痒、红晕、肿胀,局部红肿直径≤4cm,于24h 内自行消退;严重局部不良反应指局部红肿直径>4cm,红肿可出现伪足[4]。全身不良反应根据欧洲变态反应与临床免疫学会(European Academy of Allergology and Clinical Immunology,EAACI)指南进行级别评估[5],分为5 级:0级,无症状或症状免疫治疗无关;1级(轻度全身反应),局部荨麻疹、鼻炎或轻度哮喘(PEF 较基线下降<20%);2级(中度全身反应),发生缓慢(>15min),出现全身性荨麻疹和(或)中度哮喘(PEF 较基线下降<40%);3级(严重全身反应),发生迅速(<15min),出现全身性荨麻疹、血管性水肿或严重哮喘(PEF 较基线下降>40%);4级(过敏性休克),迅速出现全身瘙痒、潮红、红斑、全身性荨麻疹、喘鸣(血管性水肿)、哮喘发作、低血压休克等。
1.3 统计学处理
所有数据采用SPSS25.0 统计软件处理,计量资料用()表示。不良反应发生率用 Pearson χ2检验,检验水准α=0.05,P <0.05 表示差异有统计学意义。
2 结果
2.1 研究对象一般情况及不良反应情况
362 例AR 患者中男195 例,女167 例,男女比例约为1.2 ∶1,年龄5 ~51 岁,平均(16.2±1.0)岁,其中年龄≤14 岁213 例,年龄>14 岁149 例,合并哮喘31 例。362 例患者中轻度局部不良反应发生率为85.1%(308/362),严重局部不良反应发生率为2.2%(8/362);全身不良反应发生率为8.8%(32/362),其中轻度全身反应发生率为7.7%(28/362),中度全身反应发生率为0.6%(2/362),严重全身反应发生率为0.6%(2/362),无患者发生过敏性休克。8 例严重局部不良反应患者共发生不良反应9 次,有1 例患者在剂量累加阶段和剂量维持阶段各发生1 次,9 次不良反应中有6 次注射后30min 内出现,1 次注射后6h 出现,另外2 次出现在注射后第2 天。全身不良反应的32 例患者共发生全身不良反应 87 次,最多者发生6 次,有71次注射后30min 内出现,10 次注射后24h 内出现,4 次第2 天出现,最晚的2 次发生在2d 后。局部和全身不良反应多发生在剂量累加阶段中后期及维持阶段早期。
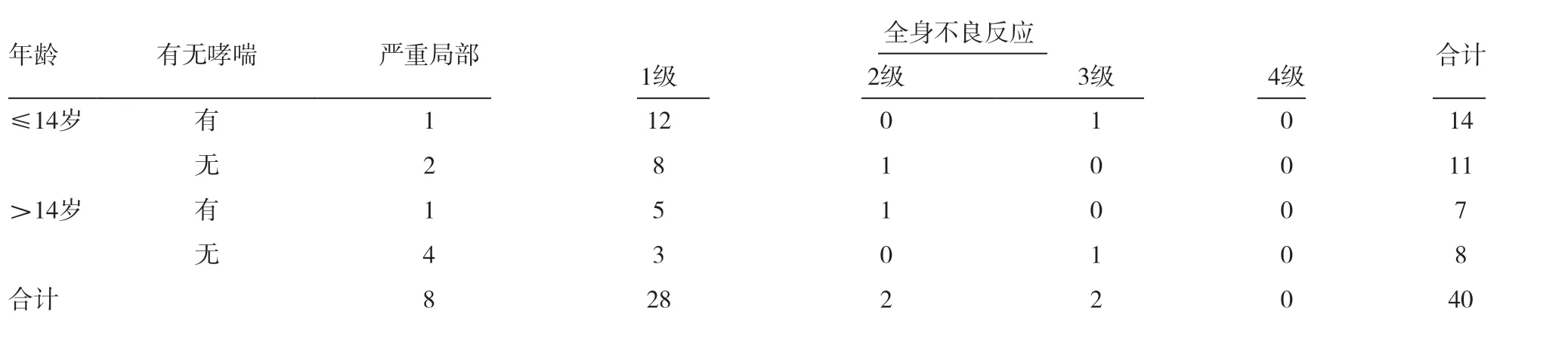
表1 不良反应发生情况(n)

表2 全身不良反应症状分布(次数)
2.2 全身不良反应的年龄、性别分布及合并哮喘情况
发生全身不良反应的32 例患者中男18 例,女14 例,男女比例约为1.5 ∶1,年龄5 ~43 岁,平均(14.2±1.2)岁,其中年龄≤14 岁22 例,合并哮喘13 例,年龄>14 岁10 例,合并哮喘6 例。全身不良反应主要发生于5 ~11 岁,共18 例,占全身不良反应总发生率的56.3%。男女全身不良反应发生率差异无统计学意义(P=0.777),合并哮喘的患者与不伴哮喘的患者全身不良反应发生率差异有统计学意义(P=0.000),两个年龄段患者全身不良反应发生率差异无统计学意义(P=0.233)。见表1。
2.3 全身不良反应的临床表现
参考世界过敏组织皮下免疫治疗全身反应分级系统[6],全身不良反应可以表现在以下7 个方面。(1)皮肤:全身瘙痒,荨麻疹,潮红;(2)上呼吸道:鼻炎发作、咽痒清嗓,上呼吸道症状引发的咳嗽或喉、悬雍垂、舌水肿;(3)结膜:充血、瘙痒、流泪;(4)下呼吸道:哮喘发作;(5)胃肠道:痉挛、呕吐或腹泻;(6)心血管:低血压伴或不伴意识丧失。
32 例患者发生的87 次全身不良反应统计结果见表2,伴有哮喘与不伴哮喘的两组患者上下呼吸道不良反应发生率差异有统计学意义(P=0.000),伴有哮喘与不伴哮喘的两组患者皮肤结膜不良反应发生率差异有统计学意义(P=0.049),两个年龄段患者上下呼吸道不良反应发生率差异有统计学意义(P=0.001),两个年龄段患者皮肤结膜不良反应发生率差异无统计学意义(P=0.289)。
3 讨论
SCIT 是对变应性疾病患者注射逐步增加剂量的变应原疫苗,使机体免疫系统逐渐适应外界环境中的变应原刺激,最终诱导免疫耐受的方法,是治疗AR、哮喘和毒液过敏的有效方法,治疗中有发生危及生命的严重过敏反应风险。除了与变应原疫苗的种类、纯度、剂量有关外,SCIT 不良反应的发生还与变应性疾病患者治疗前疾病严重程度、用药[7],患者全身状态有关[8],关于SCIT 治疗尘螨致敏的变应性疾病的不良反应国内外报道结果不尽相同,本研究中362 例患者局部不良反应发生率为87.3%,全身不良反应发生率为8.8%,这与易华容等[9]研究数据90.16%、9.3%相近,日本一篇对屋尘螨过敏的AR 和哮喘患者SCIT 治疗长期不良反应统计的多中心开放试验的文章报道,44 例患者中有4 例(9.1%)发生全身不良反应,而局部与全身不良反应总发生率只有50%[10]。统计发现局部不良反应中以瘙痒、轻微肿胀最多,红肿直径一般在5 ~20mm,严重局部不良反应只有9 次,多为速发型反应。本研究发现全身不良反应率男女间无显著性差异,而Di Bona 等[11]在一项SCIT 治疗安全性30 年的回顾研究中报道女性性别是发生不良反应的一项独立因素,本研究不良反应主要发生于5 ~11 岁,可能与儿童免疫系统不稳定有关,但≤14 岁的儿童与>14 岁的青少年和成人两个年龄段患者全身不良反应发生率差异无统计学意义,合并哮喘的患者发生率高,这与国内一项屋尘螨SCIT 治疗的多中心、大样本临床研究结果一致,其报道全身不良反应发生率多见于儿童或合并哮喘的患者,全身反应级别中1 级74.47%,2 级15.96%,3 级7.45%[12],本研究的数据与上述报道接近,1 级轻度反应最多见占全身不良反应的87.5%,2 级中度和3 级严重反应均为6.3%,无过敏性休克死亡病例。统计还发现大多数局部和全身不良反应均为速发型,但也有注射后2d 后才出现不良反应的病例,提示我们确应加强与患者的随访联系,确保患者发生不良反应后得到及时处理,防止严重后果的发生。本研究中局部和全身不良反应大多发生在剂量累加阶段中后期及维持阶段早期,考虑与个人所耐受的最大剂量有关,应遵循专家共识中的剂量调整策略,根据患者的不良反应情况适时调整注射剂量。
SCIT 治疗全身不良反应主要表现在皮肤结膜、上下呼吸道、胃肠道和心血管方面[13],本研究中合并哮喘的患者全身不良反应主要表现在下呼吸道,≤14 岁的儿童患者呼吸道不良反应发生率高于青少年和成人患者,所以建议伴有哮喘的AR 患儿家长在整个SCIT 过程中督促患儿认真做好哮喘日记,让治疗者动态掌握患儿症状、用药情况及PEF 值的变化,以利于准确的治疗前风险评估。因SCIT 治疗起效需要时间,根据我们的经验,建议哮喘患者在剂量累加阶段继续原来的哮喘治疗,至少是维持哮喘控制的最低剂量吸入激素。值得注意的是不伴哮喘的患者注射后出现的呼吸道不良反应,注射前需要排除呼吸道急性感染情况,1 周内有急性呼吸道感染病史为SCIT 注射禁忌证[3],有些患者急性感染已超过 1 周,临床症状已不明显,但仍存在气道高反应,对于大剂量的变应原刺激仍然十分敏感,注射后有诱发哮喘的危险,更有患者自诉既往时有咳嗽,但无哮喘病史,注射前无急性呼吸道感染病史及临床表现,注射后出现咳嗽、胸闷等下呼吸道速发不良反应,减量后仍连续出现速发不良反应,后完善肺功能及呼气一氧化氮(fractional exhaled nitric oxide,FeNO)检测发现轻度通气功能受限、支气管激发试验阴性、一氧化氮值明显高于正常参考值,临床上一些特殊类型的哮喘如咳嗽变异性哮喘平时可无喘息、胸闷等症状,临床诊断困难,在临床基础上可以通过支气管激发舒张试验等气道可逆性试验来帮助确诊[14],而这部分患者在无明显咳嗽症状时仍存在一定程度的气道炎症,而峰流速PEF 值无法作为评估气道炎症程度的指标,在气道炎症检测中,一氧化氮具有较好的特异性和敏感性[15]。AR 是哮喘发作的独立危险因素,40%的AR 患者可合并哮喘[16],所以在SCIT 治疗开始前应将肺功能及FeNO 检测列入常规评估检测项目中。本研究还发现不伴哮喘的AR 患儿全身不良反应主要表现在皮肤结膜,查阅文献尚未发现相似结果,有待进一步探究。
综上所述,AR 患者标准化尘螨变应原制剂SCIT 治疗全身不良反应低,多发生于伴有哮喘的儿童,哮喘控制稳定、每次注射前对患者行全面仔细的风险评估以及优化的治疗方案可以降低不良反应的发生。
