镁合金铈盐转化液配方的研究
2020-06-15粟银朱绒霞栾瑞昕
粟银,朱绒霞,栾瑞昕
(空军工程大学 基础部,陕西 西安 710051)
目前,航空ZM-5镁合金零部件均采用铬酸盐化学转化技术进行表面处理,该技术存在着Cr6+对人体及环境的危害问题,因此,镁合金表面无“铬”化学转化技术倍受相关研究人员的关注。本课题组在高锰酸盐[1]体系、高锰酸盐-铈盐[2-4]体系进行了镁合金化学转化技术的一些研究工作,虽然这些化学转化液体系中无“铬”,但仍然存在重金属(如锰)对人体和环境的危害。因此,在前期研究工作的基础上,本文就航空ZM-5镁合金在CeCl3-NaCl-H2O2转化溶液体系进行表面化学转化工艺技术的研究,旨在为镁合金表面无“铬”化学转化膜防护技术的研究及其应用提供理论依据。
1 实验部分
1.1 材料与仪器
航空ZM-5镁合金,将其加工成尺寸为20 mm×30 mm×5 mm的试样;硝酸(65%)、过氧化氢(30%)、高锰酸钾、氯化亚铈(CeCl3·7H2O)、氢氧化钠、氯化钠均为分析纯。
BS210S型电子天平(精度为0.1 mg)。
1.2 化学转化膜的制备
首先用砂纸打磨试样表面,再用50 g/L NaOH溶液碱洗10 min,最后,在CeCl3-NaCl-H2O2溶液体系中进行化学转化处理30 min[3]。从转化溶液中取出镁合金试样后,用电吹风吹干试样表面。
实验过程中温度均为室温。整个制备过程中,各步骤之间必须用去离子水冲洗试样表面,再进行下一步骤。
1.3 化学转化膜层的腐蚀实验
将0.05 g KMnO4和1 mL浓HNO3加入100 mL去离子水中,配制成腐蚀溶液备用。再将腐蚀溶液滴在镁合金表面的化学转化膜层上,观察溶液颜色变化,并记录其变化时间。该时间即为膜层的耐腐蚀时间,时间越长,膜层的耐腐蚀性能越好。
2 结果与讨论
2.1 化学转化溶液体系中NaCl浓度对膜层腐蚀性能的影响
以CeCl3-NaCl体系为化学转化溶液,固定CeCl3·7H2O浓度为3 g/dm3,NaCl浓度依次为0,5,10,15,20,25,30,35 g/dm3,分别配制成8组CeCl3-NaCl转化溶液体系,按照1.2节实验方法进行化学转化膜层的制备。制备过程中,对每组转化溶液中形成膜层的质量增量进行测定,并以Cl-浓度为横坐标,膜层质量增量为纵坐标作图,图1为膜层质量增量随Cl-浓度的变化曲线图。

图1 膜层质量增量随Cl-浓度的变化曲线Fig.1 The mass gain curve of coating mass gain with Cl-
由图1可知,随着Cl-浓度的增大,膜层质量增量随之增加,当Cl-浓度为30 g/dm3时达到最大值,之后随之减少。当Cl-浓度<10 g/dm3时,膜层质量增量较小。因此,转化溶液中Cl-最佳浓度应该在10,15,20,25,30 g/dm3中,并根据对应膜层的耐腐蚀性能进行选择。
再采用1.3节的腐蚀实验对膜层的耐蚀性能进行研究,实验得到的膜层腐蚀时间与Cl-浓度的对应关系见表1。

表1 Cl-浓度与对应膜层腐蚀时间的对应关系Table 1 The anti-corrosion of coating with NaCl
由表1可知,当Cl-浓度为10,15,20,25,30 g/dm3时,对应膜层的腐蚀时间变化不大,因此,Cl-最佳浓度选定为10 g/dm3。
2.2 化学转化溶液体系中H2O2浓度对膜层腐蚀性能的影响
首先以CeCl3-NaCl-H2O2体系为化学转化溶液,CeCl3·7H2O浓度为3 g/dm3,NaCl浓度为 10 g/dm3,H2O2浓度分别为0,2,4,6,8,10 mL/dm3,分别配制成6组CeCl3-NaCl-H2O2转化溶液体系,按照1.2节实验方法进行化学转化膜层的制备。制备过程中,对每组转化溶液中形成膜层的质量增量进行测定,并以H2O2浓度为横坐标,膜层质量增量为纵坐标作图,图2为膜层质量增量随H2O2浓度的变化曲线图。

图2 膜层质量增量随H2O2浓度的变化曲线Fig.2 The mass gain curve of coating with H2O2
由图2可知,随着H2O2浓度的增大,膜层质量增量随之增加,当H2O2浓度为6 mL/dm3时达到最大值,之后随之减少。
再采用1.3节的腐蚀实验对膜层的耐蚀性能进行研究,实验得到的腐蚀时间与H2O2浓度的对应关系见表2。
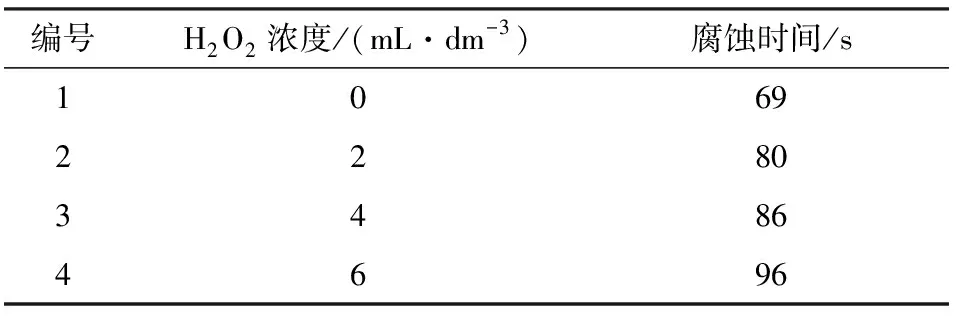
表2 H2O2浓度与对应膜层腐蚀时间的对应关系Table 2 The anti-corrosion of coating with H2O2
由表2可知,随着H2O2浓度的增大,膜层腐蚀时间随之增加,当H2O2浓度为6 mL/dm3时达到最大值,因此,H2O2最佳浓度选定为6 mL/dm3。
2.3 化学转化溶液体系中CeCl3浓度对膜层腐蚀性能的影响
以CeCl3-NaCl-H2O2体系为化学转化溶液,固定NaCl浓度为10 g/dm3,H2O2浓度为6 mL/dm3,CeCl3·7H2O浓度依次为0,3,5,10,15,20 g/dm3,分别配制成6组CeCl3-NaCl-H2O2转化溶液体系,按照1.2节实验方法进行化学转化膜层的制备。制备过程中,对每组转化溶液中形成膜层的质量增量进行测定,并以CeCl3浓度为横坐标,膜层质量增量为纵坐标作图,图3为膜层质量增量随CeCl3浓度的变化曲线。

图3 膜层质量增量随CeCl3浓度的变化曲线Fig.3 The mass gain curve of coating with CeCl3
由图3可知,随着CeCl3浓度的增大,膜层质量增量随着增加,当CeCl3浓度为5 g/dm3时达到最大值,之后随之变化不大。
采用1.3节的腐蚀实验对膜层的耐蚀性能进行测定,实验得到的腐蚀时间与CeCl3浓度对应关系见表3。

表3 CeCl3浓度与对应膜层腐蚀时间的对应关系Table 3 The anti-corrosion of coating with CeCl3
由表3可知,当CeCl3浓度为5 g/dm3时膜层的腐蚀时间最大,因此,CeCl3最佳浓度选定为 5 g/dm3。
2.4 CeCl3-NaCl-H2O2体系中化学转化膜层形成机理分析
将镁合金试样浸入CeCl3-NaCl-H2O2体系的电解质溶液时,镁合金表面α相和β相形成微电池[5],α相作为微阳极,β相作为微阴极,对应的电极反应如下:
阳极:Mg=Mg2++2e-
阴极:2H++2e-=H2或
2H2O+O2+4e-=4OH-
CeCl3-H2O2-NaCl体系中H2O2是强氧化剂,其电极反应为H2O2+2H++2e-=2H2O。此电极反应说明,H2O2作为阴极去极化剂,促进了阴极反应2H++2e-=H2的进行,加速了化学转化成膜的速率。
CeCl3-H2O2-NaCl体系中CeCl3和H2O2同时存在,有两个电极反应,电极反应Ce4++e-=Ce3+的φ(Ce4+/Ce3+)=1.44 V,电极反应H2O2+2H++2e-=2H2O的φ(H2O2/H2O)=1.776 V。根据电化学原理[6],两者发生氧化还原反应H2O2+2H++2Ce3+=2H2O+2Ce4+,导致化学转化溶液中Ce4+的存在。
随着化学转化处理时间的延长,试样表面附近的溶液碱性增强,即,OH-浓度增大。又由于Ksp[Ce(OH)3]=1.5×10-20,Ksp[Ce(OH)4]=4.1×10-51,Ksp[Mg(OH)2]=5.61×10-12溶度积[6]均很小,在试样表面发生下列反应:
Ce4++4OH-=Ce(OH)4
Ce3++3OH-=Ce(OH)3
Mg2++2OH-=Mg(OH)2
使得试样表面有Mg(OH)2、Ce(OH)3、Ce(OH)4物质沉积。随着后续对试样的干燥处理,分别发生分解反应,生成对应的氧化物,因此,经过CeCl3-H2O2-NaCl体系进行化学转化处理后,试样表面膜层的主要成分为Mg(OH)2、Ce(OH)3、Ce(OH)4、MgO、Ce2O3和CeO2的混合物。
3 结论
CeCl3-NaCl-H2O2体系镁合金化学转化技术工艺包括试样表面的机械打磨、碱洗和化学转化处理。化学转化处理溶液CeCl3-NaCl-H2O2体系的最佳配方为10 g/dm3NaCl,6 mL/dm3H2O2(30%) 和5 g/dm3CeCl3·7H2O。镁合金在该体系中形成的化学转化膜层的主要成分为CeO2、Ce2O3、MgO、Mg(OH)2、Ce(OH)3和Ce(OH)4。
