常温纤维素降解细菌的筛选及其复合系的构建
2020-06-12孟建宇冀锦华郭慧琴冯福应赵鸿彬
孟建宇, 冀锦华, 郭慧琴, 陶 羽, 冯福应, 赵鸿彬
(内蒙古农业大学 生命科学学院应用与环境微生物研究所, 呼和浩特 010011)
纤维素是一种不溶于有机溶剂与水的大分子多糖,是自然界中最丰富的碳水化合物[1-2],物理或化学手段处理纤维素普遍存在成本高、利用不充分、有害副产物多等问题[3],而高效、环保的微生物法日益被用于转化利用纤维素资源,是处理纤维素废弃物的重要手段。在降解纤维素的微生物中,真菌的降解能力较强,但因其生长缓慢、相关酶类结构复杂且热稳定性较差和不耐碱性等缺点限制了其工业化发展[4],而细菌具有来源更广、种类更多、生长快等优点,能在各种极端环境生存,易于大规模工业生产而显现了潜在的应用前景,而国内外对细菌降解纤维素的研究报道较少[5-7]。
以往研究主要针对单一的底物分离纤维素降解菌,获得的菌株普遍存在酶活较低、适应性不强等缺陷。复合微生物处理主要是利用不同菌株各自的优势特点进行组合,复合菌系中微生物间的协作关系大大提高了它们对纤维素的降解能力,达到更好的处理效果[8-9]。目前,利用复合菌系降解纤维素已受到广泛关注。分离高效降解纤维素菌的研究已有较多报道,但对细菌组成的复合菌系的研究相对较少[10-11]。
常温复合菌系能高效分解纤维素、半纤维素等成分,在寒区农业废弃物资源化利用方面有着一定的应用潜力[12]。内蒙古自治区属于温带寒冷区,秋冬季周期长,纤维素降解菌资源丰富。因此,认识和挖掘该地区纤维素降解菌资源,筛选高效的纤维素降解菌群,将为开发降解纤维素复合菌剂奠定基础。
1 材料与方法
1.1 试验样品
样品采集自内蒙古自治区呼伦贝尔森林的带腐烂落叶的表层土壤,放冰盒运回实验室,4 ℃冰箱保存备用。
1.2 培养基及试剂配方
1)富集培养基:纤维素(秸秆末、滤纸浆)5 g,蛋白胨 5 g,CaCO32 g,NaCl 5 g,K2HPO40.5 g,MgSO40.5 g,ddH2O 1000 mL,pH 自然。2)筛选培养基:羧甲基纤维素钠/微晶纤维素/D-水杨苷 5 g,酵母粉 2 g,KH2PO40.5 g,MgSO40.5 g,琼脂 20 g,ddH2O 1000 mL,pH值自然。3)鉴别培养基:(NH4)2SO42 g,MgSO40.5 g,K2HPO41 g,NaCl 0.5 g,羧甲基纤维素钠/微晶纤维素/D-水杨苷 2 g,刚果红 0.4 g,琼脂 22 g,ddH2O 1000 mL。4)滤纸培养基:滤纸条(每条1 cm×3.6 cm,约0.03 g)5 g,酵母粉 2 g,KH2PO40.5 g,MgSO40.5 g,ddH2O 1000 mL,pH值自然。5)1% 羧甲基纤维素钠/微晶纤维素/D-水杨苷溶液:10 g 羧甲基纤维素钠/微晶纤维素/D-水杨苷溶解于柠檬酸缓冲液(pH 4.8,0.2 mol/L)并定容至1000 mL。
1.3 纤维素降解菌的筛选
将采集的土样充分混匀,取适当样品接入含有富集培养基的烧杯中,置25 ℃培养箱中富集培养15 d后,转接新鲜培养基再次富集培养,共转接3次。取10 mL富集培养液加入含90 mL无菌水的三角瓶中,置于 120 r/min摇床中25 ℃振荡1 h,充分混匀,稀释成10-2、10-3和10-43个浓度梯度(每个梯度3个重复),涂布到3种含不同碳源的筛选培养基上,25 ℃培养1~2周。挑取不同形态、颜色的菌落进行分离纯化,然后将纯化的单菌落分别接种到对应的碳源-刚果红鉴别培养基上25 ℃恒温培养,进一步观察菌株生长情况,根据水解圈的大小筛选纤维素酶活性高的菌株。
1.4 菌株的鉴定及其系统发育分析
参考胡晓红等[13]的方法对细菌DNA的进行提取。选用细菌通用引物对27F和1492R进行PCR扩增,产物进行纯化后用pEASY-T1 Cloning Kit(北京全式金生物技术有限公司)将目的片段与载体连接,并将其转入EscherichiacoliDH5α中。用M13引物对阳性克隆子进行菌落PCR扩增检测,由上海生物工程有限公司进行测序。将测序结果中的载体序列删除,然后选取峰图整齐的序列利用EzTaxon数据库对各个核酸序列进行比对及相似性比较。
1.5 酶活性测定
以150 μL 1%(W/V)的微晶纤维素/CMC-Na/D-水杨苷缓冲液分别作为反应底物,加入50 μL粗酶液,于50 ℃恒温水浴锅中反应30 min,然后加入200 μL DNS终止反应,并将混合物在沸水浴中煮5 min,待反应混合物冷却,加入650 μL蒸馏水,混匀,取出200 μL加至96孔酶标板上,用酶标仪测定540 nm下的吸光值(OD540)。分别测定外切葡聚糖酶、内切葡聚糖纤维二糖水解酶和β-葡萄糖苷酶的酶活性。
以150 μL的醋酸缓冲液和1.5 mg滤纸作反应的底物,加入50 μL粗酶液,于50 ℃恒温水浴锅中反应30 min,然后加入200 μL DNS终止反应,并将混合物在沸水浴中煮5 min,待反应混合物冷却,加入650 μL蒸馏水混匀,取出200 μL加至96孔酶标板上,用酶标仪测定540 nm下的吸光值(OD540),测定总酶活(滤纸酶活)。
酶活力定义:在50 ℃的反应条件下,1 min内催化底物生成1 μmol葡萄糖所需的酶量为1 U/mL。
1.6 常温细菌降解复合系的构建
从分离纯化得到的互不拮抗菌株中,对应每种纤维素碳源分别筛选出3株酶活性较高的菌株,共9株,进行复合系构建。
1.6.1 单菌株的滤纸酶活性测定
把互不拮抗的菌株单独接种到滤纸培养基中,于25 ℃振荡培养,每隔24 h检测一次发酵液的OD540值,以测定滤纸酶活。
1.6.2 降解复合系的构建及其酶活性测定
把互不拮抗的菌株接种到对应碳源的液体培养基中,25 ℃恒温摇床振荡培养,当OD600均接近时,分别在3种不同碳源培养基中培养的菌株当中任意选择一株菌组合成复合系。各取1 mL复合系培养液分别接种到50 mL已灭菌的滤纸培养基中,25 ℃恒温培养,每隔24 h测定一次发酵液的滤纸酶活。
1.6.3 降解复合系的滤纸降解率
将烘干至恒重的滤纸加入到降解复合系的培养基中,25 ℃恒温培养,培养结束后将培养液于5400 r/min离心6 min,去除上清液后水洗,于6000 r/min离心6 min,再用盐酸和硝酸的混合溶液洗除菌体后,用清水洗涤,105 ℃烘干至恒重,称重,计算失重率,每组3个平行[14]。
2 结果与分析
2.1 常温纤维素降解细菌的分离筛选
用3种含不同碳源的培养基分离筛选常温纤维素降解细菌,共得到258株细菌。菌落颜色主要以白色、深红色、乳白色、黄色、浅黄色、橘红色为主,多为圆形或近圆形的凸起,边缘光滑,光泽不透明;无规则的菌落很少,边缘粗糙、扁平的菌落较少。
2.2 不同碳源筛选的常温纤维素降解菌群结构分析
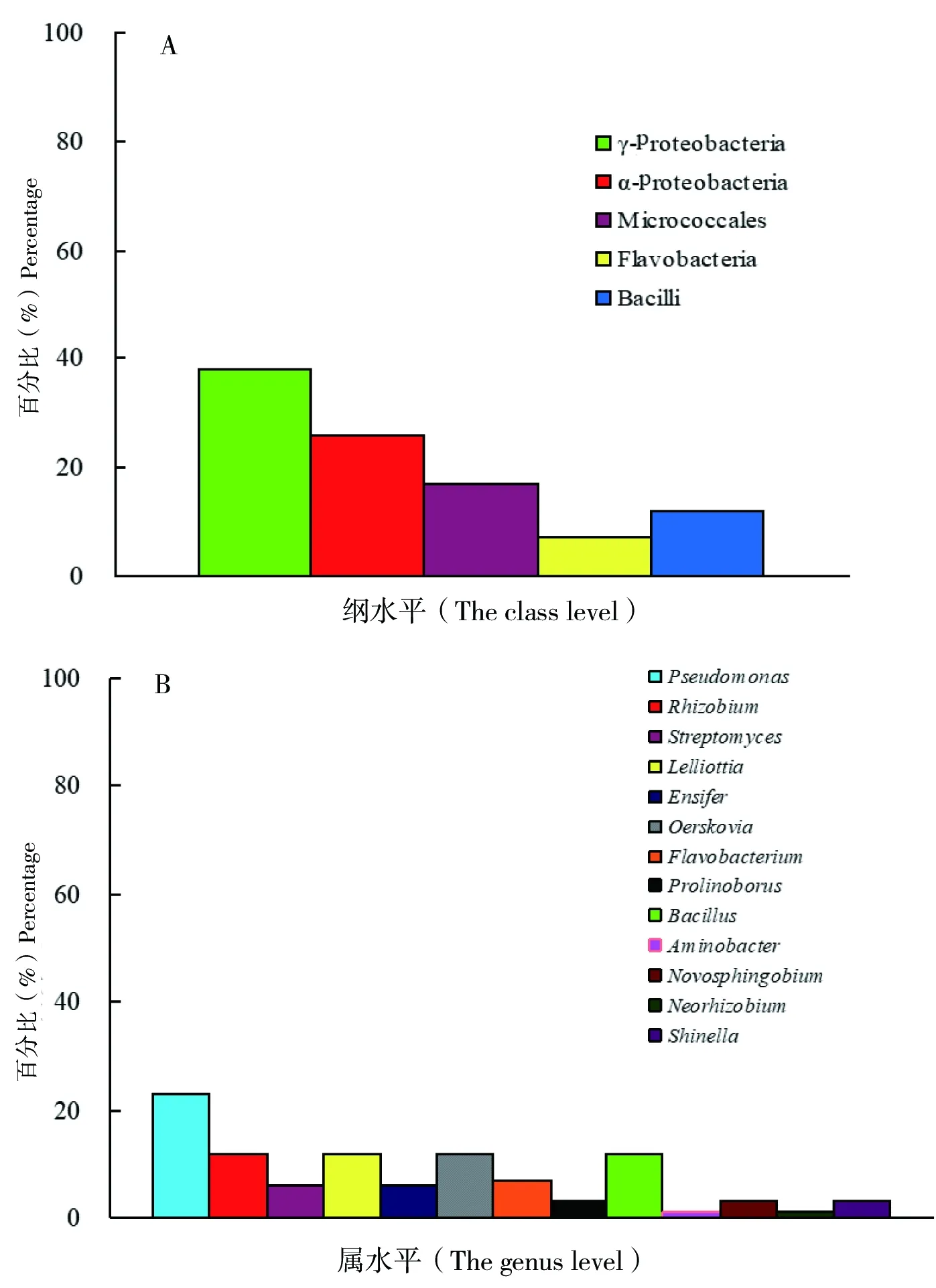
图1 以微晶纤维素为底物筛选的常温细菌群落组成
对得到的16S rDNA序列在EzTaxon数据库中进行分类及同源性分析发现,在258株常温纤维素降解细菌中,可以利用微晶纤维素(Avicel)的细菌有69株(图1),其中,18株属于变形菌门中的α-变形菌纲(α-Proteobacteria),占全部菌株的26%;26株属于变形菌门中的γ-变形菌纲(γ-Proteobacteria),占38%;12株属于放线菌门(Actinobacteria)中的Micrococcales纲,占17%;5株属于拟杆菌门(Bacteroidetes)中的Flavobacteria纲,占7%;8株属于厚壁菌门(Firmicutes)中的杆菌纲(Bacilli),占12%(图1-A)。在属分类水平上,假单胞菌属(Pseudomonas),共16株占23%为降解微晶纤维素的优势菌属。其次是根瘤菌属(Rhizobium),共8株占12%;Lelliottia,共8株占12%;厄氏菌属(Oerskovia),共8株占12%;芽孢杆菌属(Bacillus),共8株占12%,见图1-B。
能利用羧甲基纤维素(CMC)的细菌有97株(图2),其中,20株属于变形菌门中的α-变形菌纲(α-Proteobacteria),占全部菌株的21%;33株属于变形菌门中的γ-变形菌纲(γ-Proteobacteria),占34%;18株属于放线菌门(Actinobacteria)中的Micrococcales纲,占19%;8株属于拟杆菌门(Bacteroidetes)中的Flavobacteria纲,占8%;6株菌属于拟杆菌门(Bacteroidetes)中的Sphingobacteriia纲,占6%;12株属于厚壁菌门中(Firmicutes)的杆菌纲(Bacilli),占12%(图2-A)。在属水平上,假单胞菌属(Pseudomonas)共23株占24%,为降解CMC的优势菌群。其次是厄氏菌属(Oerskovia),共15株占15%、芽孢杆菌属(Bacillus),共12株占12%;根瘤菌属(Rhizobium),共10株占10%;Lelliottia,共10株占10%,见图2-B。
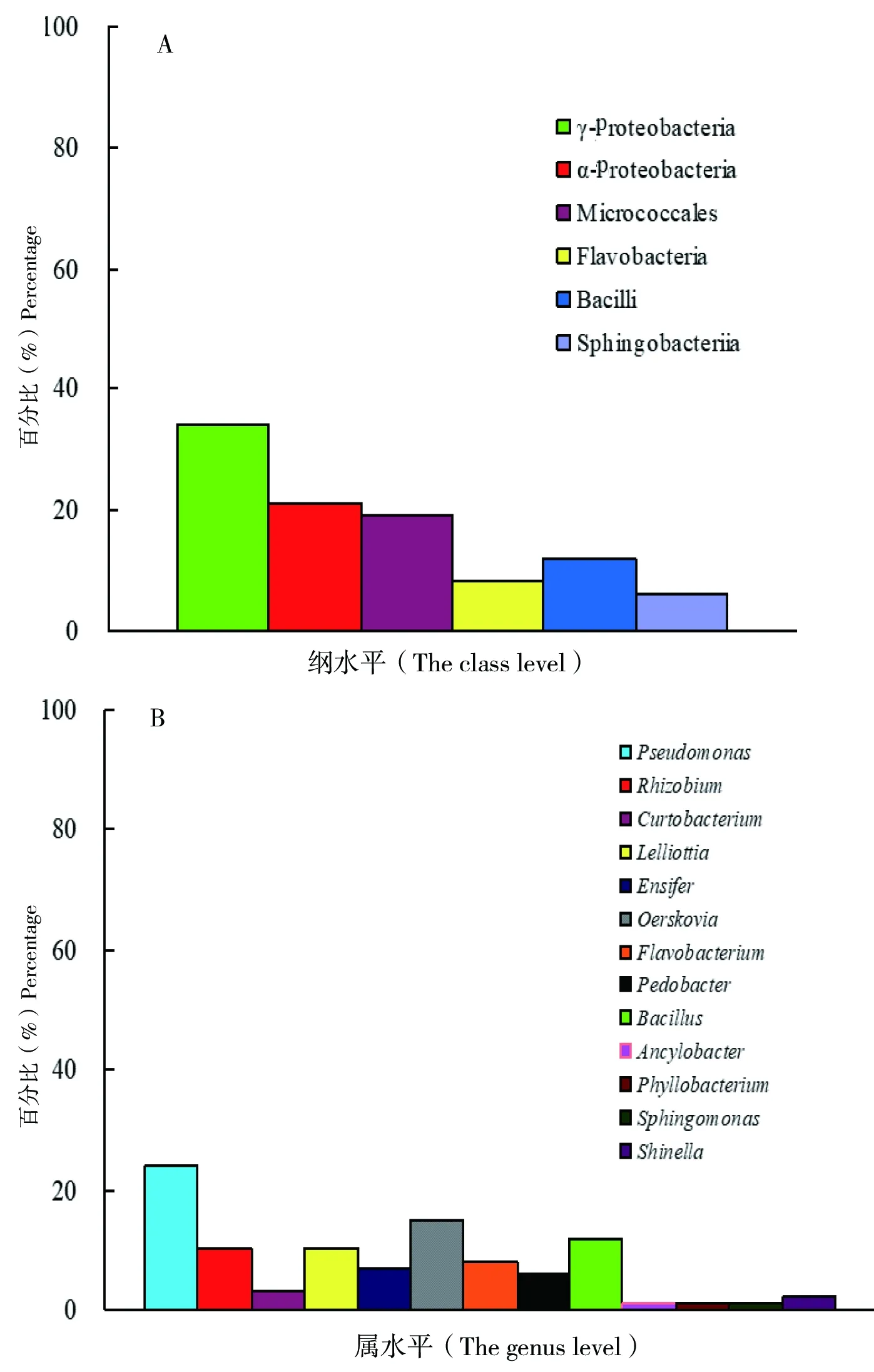
图2 以羧甲基纤维素为底物筛选的常温细菌群落组成
可以利用D-水杨苷的细菌有92株(图3),其中,21株属于变形菌门中的α-变形菌纲(α-Proteobacteria),占全部菌株的23%;35株属于变形菌门中的γ-变形菌纲(γ-Proteobacteria),占38%;有18株属于放线菌门(Actinobacteria)中的Micrococcales纲,占20%;5株属于拟杆菌门(Bacteroidetes)中的Flavobacteria纲,占5%;4株属于拟杆菌门(Bacteroidetes)中的Sphingobacteriia纲,占4%;9株属于厚壁菌门(Firmicutes)中的杆菌纲(Bacilli),占10%(图3-A)。在属的分类水平上,假单胞菌属(Pseudomonas),共24株占26%,为降解D-水杨苷的优势菌群。其次是厄氏菌属(Oerskovia),共18株占20%;芽孢杆菌属(Bacillus),共9株占10%;根瘤菌属(Rhizobium),共9株占10%,见图3-B。
2.3 常温纤维素降解菌的酶活测定
对筛选得到的258株常温纤维素降解菌在25 ℃下进行其相对酶活的测定,将其中酶活性相对较高的前10株菌列于表1。其中,以微晶纤维素为碳源筛得的菌株的酶活性大部分在50~80 U/mL之间,菌株DCXA31和DCXA5-3的酶活性分别为25.7 U/mL和33.3 U/mL,DCXA22酶活性最高,达83.0 U/mL;菌株DCXC48的CMC酶活性最低,为7.6 U/mL,菌株DCXC16酶活性最高,达37.3 U/mL,其余菌株的酶活性均在10~30 U/mL之间;菌株DCXD7和DCXD43的β-葡糖苷酶活性较低,分别为10.9 U/mL和13.7 U/mL,其余菌株均在15~30 U/mL之间。
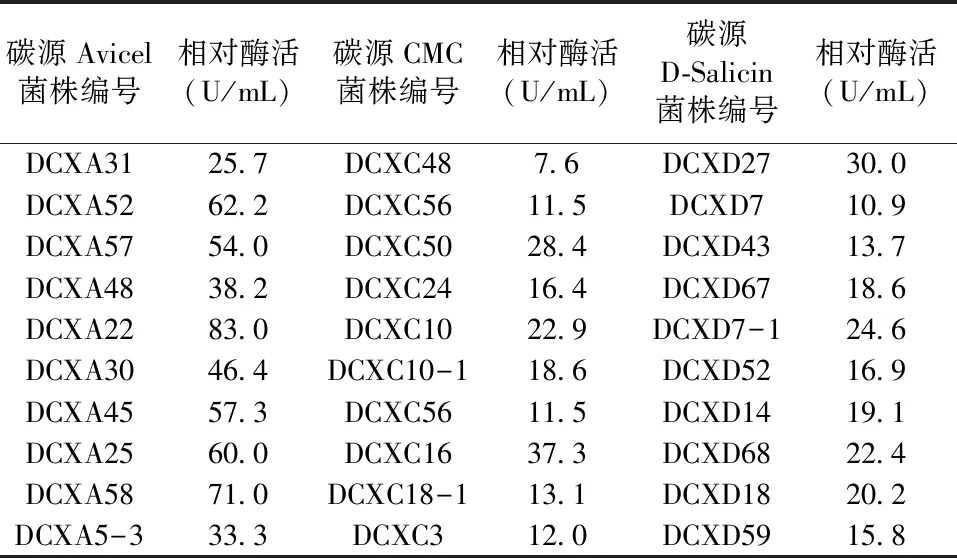
表1 3种不同碳源筛选的常温纤维素降解菌的酶活性
注:表中Avicel表示微晶纤维素;CMC表示羧甲基纤维素;D-Salicin表示D-水杨苷
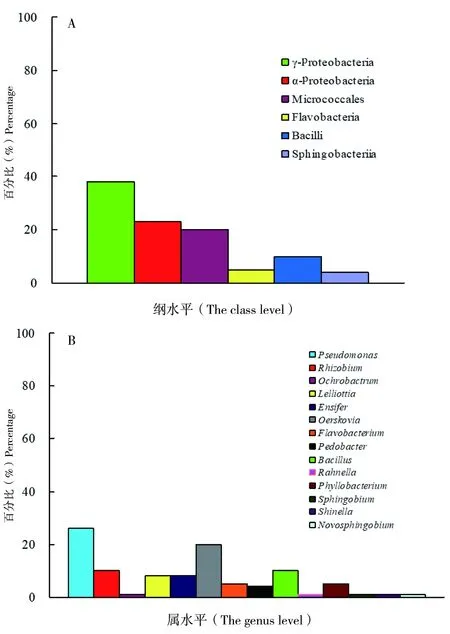
图3 以D-水杨苷为底物筛选的常温细菌群落组成
2.4 常温纤维素降解复合系的构建及其降解滤纸能力
从对应每种纤维素碳源分别筛选出3株酶活性较高的菌株,然后组合成27个复合系。降解微晶纤维素能力较强的菌株为DCXA52、DCXA22和DCXA58,分别编号为1、2、3;降解CMC能力较强的菌株为DCXC50、DCXC10和DCXC16,分别编号为1′、2′、3′;降解D-水杨苷能力较强的菌株为DCXD27、DCXD7-1和DCXD68,分别编号为1″、2″、3″。9株菌经测序得到其16S rDNA序列,经过EzTaxon数据库比对,与最近缘模式种的同源性均大于98%,其所属菌种信息如表2所示。其中,菌株DCXA52、DCXA58属于假单胞菌属(Pseudomonas),DCXA22属于根瘤菌属(Rhizobium),DCXC10属于黄杆菌属(Phyllobacterium),DCXC16属于Chitinophaga,DCXC50和DCXD7-1属于厄氏菌属(Oerskovia),DCXD68属于芽孢杆菌属(Bacillus),DCXD68属于Lelliottia。

表2 常温降解复合系所用菌株的序列同源性
2.4.1 降解复合系所用单菌株在滤纸培养基中的酶活
将构建常温降解复合系所用的单菌株分别接种到滤纸液体培养基中25 ℃恒温培养,每隔24 h测定1次酶活性,结果如图4所示。酶活均在第4天达到最大。降解微晶纤维素的菌株DCXA52、DCXA58、DCXA22的酶活分别为29.38、26.08和26.00 U/mL;降解CMC的菌株DCXC10、DCXC50、DCXC16的酶活分别为20.20、21.36和28.96 U/mL;降解D-水杨苷的菌株DCXD7-1、DCXD27、DCXD68的酶活分别为22.24、22.75和30.15 U/mL。
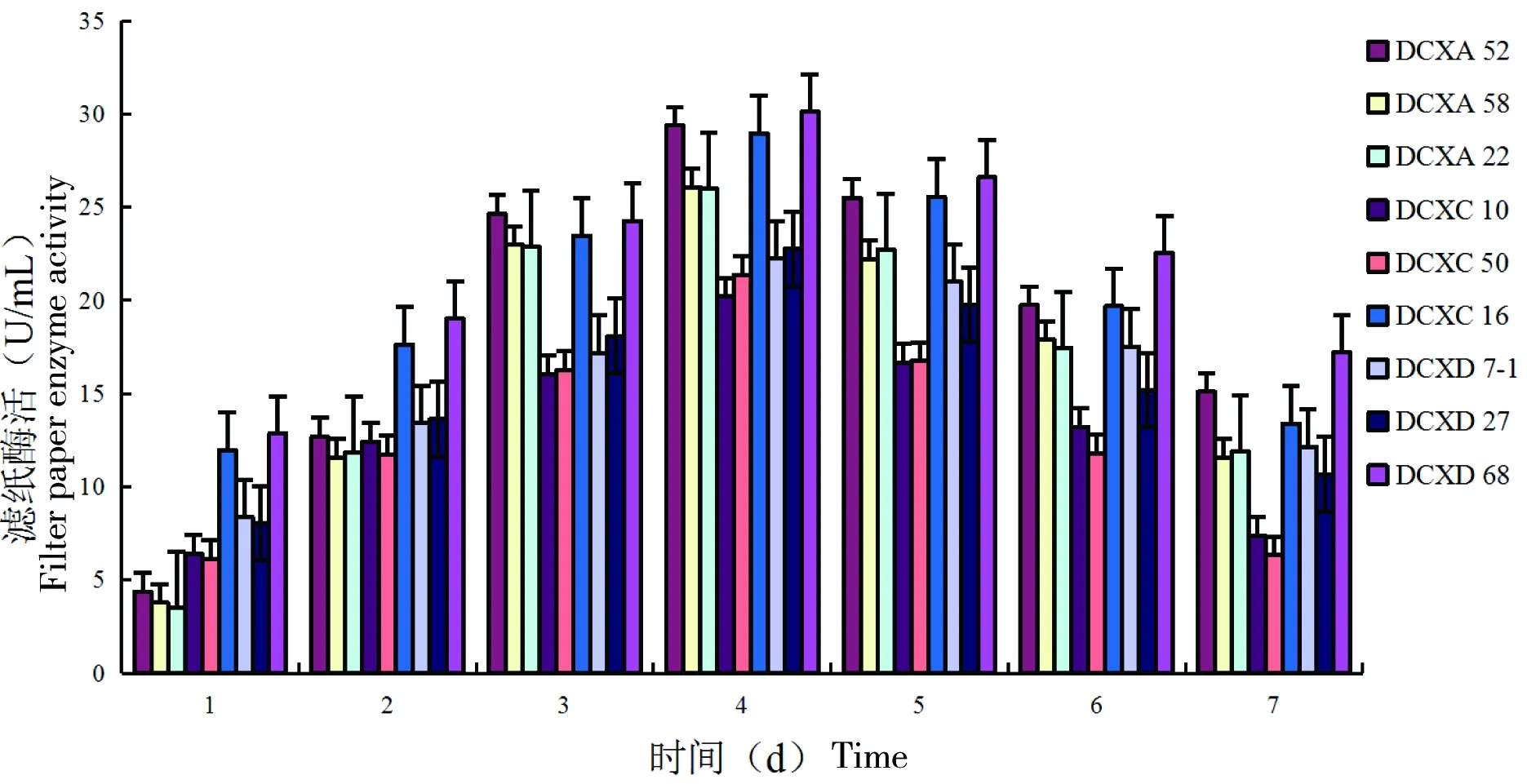
图4 构建常温降解复合系的单菌株的滤纸酶活性
2.4.2 降解复合系的滤纸酶活及滤纸降解率
把27个降解复合系组合分别接种到滤纸液体培养基中25 ℃恒温培养,每隔24 h对各个组合的滤纸酶活性进行测定,结果如图5所示。 降解复合系在发酵的过程中,14个组合的滤纸酶活性出现了两个峰值,剩余13个组合的酶活性只出现一个峰值。其中,组合C13′1″、C13′3″、C21′1″、C21′3″、C23′1″、C32′1″、C33′3″在第4天和在第6天出现两个峰值;组合C11′3″、C22′1″、C31′3″、C31′2″、C32′2″、C33′2″在第3天和第5天出现两个峰值;组合C31′2″在第2天和在第4天出现两个峰值;而组合C11′1″、C11′2″、C12′2″、C22′2″、C32′3″、C33′1″只在第5天出现一个峰值;C12′2″、C13′2″、C21′2″、C22′3″、C23′2″、C23′3″只在第4天出现一个峰值;C12′1″只在第6天出现一个峰值。
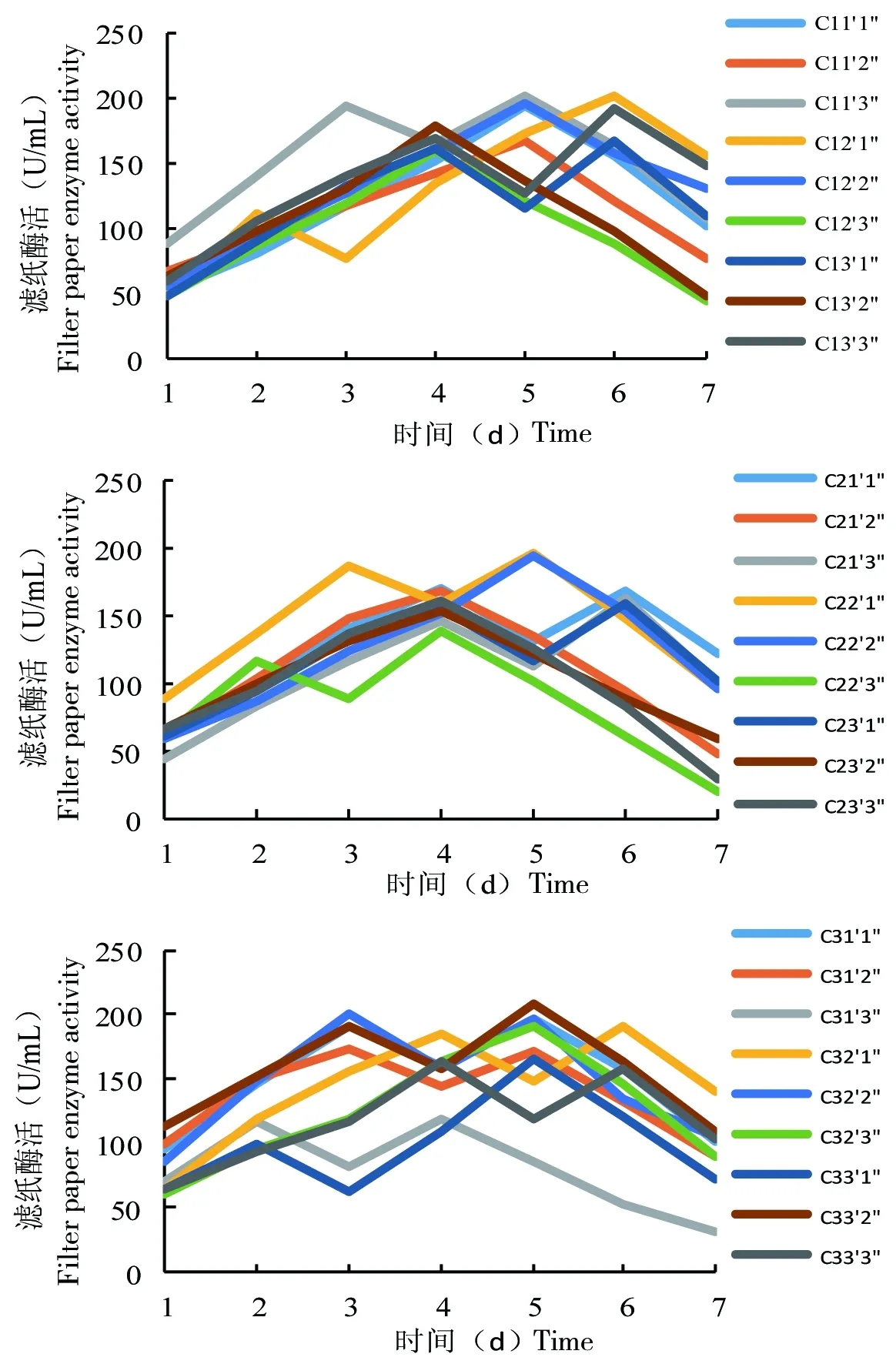
图5 常温降解复合系的滤纸酶活性
降解复合系中酶活性比较高的组合是C11′3″、C22′1″、C31′1″、C32′2″、C33′2″、C12′2″和C22′2″。这些复合系滤纸酶活性约在194~200 U/mL范围内,而其中最高的为复合系C11′3″、C32′2″和C33′2″,酶活性分别为200.60、200.05和208.79 U/mL,是复合系中单独菌株的6~10倍,滤纸降解率分别为26.8%、22%和32.4%(图6),为常温降解滤纸的优势菌群组合。
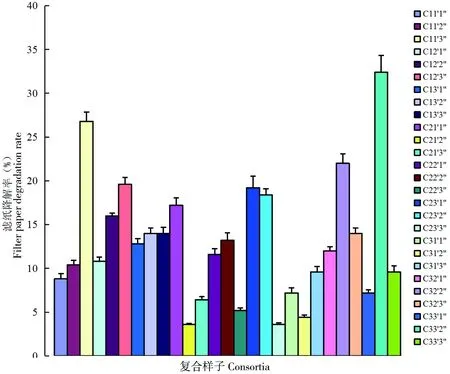
图6 常温降解复合系7 d内的滤纸降解率
3 讨论
本文分别以微晶纤维素、羧甲基纤维素和D-水杨苷为唯一碳源共筛选得到258株常温纤维素降解细菌。其中,γ-Proteobacteria为第一优势菌群,α-Proteobacteria为第二优势菌群,在所有降解纤维素细菌中占绝对的数量优势,为主要菌群,这与很多文献报道类似[15];其次为Actinobacteria。分离到的降解纤维素细菌分属于21个不同的属,其中假单胞菌属(Pseudomonas)、根瘤菌属(Rhizobium)、剑菌属(Ensifer)、芽孢杆菌属(Bacillus)和黄杆菌属(Flavobacterium)为主要的纤维素降解细菌,苍白杆菌属(Ochrobactrum)、Lelliottia、厄氏菌属(Oerskovia)、叶杆菌属(Phyllobacterium)、杆菌属(Ancylobacter)、地杆菌属(Pedobacter)、短小杆菌属(Curtobacterium)、新鞘脂菌属(Novosphingobium)、拉恩氏菌属(Rahnella)、氨基杆菌属(Aminobacter)、Prolinoborus和Shinella等属的细菌在降解纤维素方面鲜有报道。
程仕伟等[16]筛选得到菌株B29的外切葡聚糖酶活性为50 U/mL,崔海洋等[17]筛选到菌株B16的微晶纤维素酶活为16.39 U/mL,本文用于构建常温降解复合系所用的菌株中,微晶纤维素酶活性在60~85 U/mL范围内,大致处于较高水平。陈晶晶等[18]筛选到一株常温高活性降解纤维素细菌XWS-12,其CMC酶活为21.08 U/mL;黄春凯等[19]筛选到的常温高效纤维素降解菌KZ-1、KZ-2、KZ-3和KZ-4,其CMC酶活为43.52、80.38、47.24和25.61 U/mL,张云峰等[20]从堆肥和林场腐殖层土壤样品中分离到6株细菌,CMC酶活在14.75~30.58 U/mL之间,本文用于构建常温降解复合系所用的CMC降解菌中,CMC酶活在22.93~37.34 U/mL范围内,处于中等水平。方尚玲等[21]筛选到一株高β-葡萄糖苷酶活性菌株HGS-3,其活性在优化条件下为93.48 U/mL,张建芬等[22]从白蚁肠道内筛选到的菌株Z-4的β-葡萄糖苷酶活性为18.2 U/mL,本文用于构建常温降解复合系的D-水杨苷降解菌,酶活性大约在20~30 U/mL范围内,处于中等水平。
自然环境中纤维素的降解是由多种纤维素降解微生物协同完成的。单独菌株在纤维素降解过程中存在底物抑制和产物反馈抑制,使其降解效率和水平下降。微生物复合系降解纤维素的效率及活性均比单独菌株作用高。Gurdeep等[23]从堆肥中筛选出了纤维素降解菌群WSUCF1,其生长率和酶活均较高,其CMC酶活在24 h内仍能维持在89%左右。侯敏等[24]将分离到的枯草芽孢杆菌M22 与产朊假丝酵母J1、植物乳杆菌J2和地衣芽孢杆菌J3组成复合系,滤纸酶活达19.420 U/L。潘林等[25]构建的常温复合菌系在培养6 d时有最大滤纸酶活性(0.17 U/mL),滤纸降解率10.81%;潘虎等[26]筛选构建了一个高效纤维素降解菌群SYF,其培养10 d后,滤纸酶活性为126.3 U/mL,滤纸降解率为71.5%,酶活性低于本实验常温降解复合系的最高滤纸酶活性,但其滤纸降解率很高;赵听[27]构建了小麦秸秆降解复合菌群FWD1,其滤纸酶活性为75.74 U/mL,其在7 d内的滤纸降解率为10%,低于本文中的常温滤纸降解复合系的滤纸降解率。Yuan等[28]从堆肥中筛选出的复合菌系MC1 3 d内滤纸降解率为88%;Wang 等[29]从高温期堆肥中富集获得的复合菌系10 d可降解99%的滤纸,降解效率远高于同类复合菌系。本文构建的常温降解滤纸降解复合系中,滤纸酶活性最高的降解复合系为C11′3″、C32′2″和C33′2″,酶活性分别为200.60、200.05和208.79 U/mL,是复合系中单独菌株的6~10倍,25 ℃下7 d内滤纸降解率分别为26.8%、22%和32.4%,为常温降解复合系最优菌群组合,具有较高的应用潜力,值得进一步研究。
