肺癌细胞外泌体GPI-锚定蛋白组学研究
2020-06-12吴微波周大鹏
吴微波, 廖 海, 周大鹏
(1. 西南交通大学 生命科学与工程学院, 成都 610036; 2. 同济大学 医学院, 上海 200082)
肿瘤是威胁人类生命的重大疾病之一,一旦发展到晚期,病人的生存率、生活质量均明显降低。因此,肿瘤的早期诊断对于癌症的治疗、预后等都有非常大的意义。1983年,外泌体首次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”[1]。外泌体作为一种细胞外囊泡,可以运输包括蛋白质和核酸在内的许多生物活性分子,这些分子调节靶细胞的基因表达和细胞功能。因此,外泌体介导的自分泌、旁分泌和内分泌效应可用于治疗[2]。研究表明,肿瘤外泌体可以促进肿瘤的侵袭和迁移,且与肿瘤的发育和形成有关[3-5]。因此,外泌体作为肿瘤诊断标记物具有很大可行性。
GPI锚定蛋白作为一类在生长发育、信号转导等起重要作用,同时又参与肿瘤侵袭与转移的重要分子[6-8],必然与癌症息息相关。GPI-anchor的核心结构在迄今研究的所有物种中都是保守的[9-10], 其与包括肺癌在内的多种癌症的发育和形成有重要关系,且有报道称GPI锚定蛋白可以作为癌症诊断的标记物[11]。有报道指出,外泌体可以作为疾病的治疗工具和生物标记物[3],但是诊断的靶点尚不明确,目前GPC1等癌症诊断标记物并不一定适用于外泌体,所以需要找到新的GPI锚定蛋白作为外泌体标记物来诊断癌症。德国癌症研究中心的一项研究表明,CD24可以作为外泌体的标记物来检测外泌体[12]。所以我们推测,可以通过GPI锚定蛋白作为外泌体的标记物,进而诊断肿瘤。
我们从Uniprot数据库获取了人GPI锚定蛋白数据,并在肺癌病人和健康人的基因表达mRNA阵列数据中筛选出差异表达的GPI锚定蛋白。然后利用DIA定量技术对NCI-H838非小细胞肺癌细胞系膜蛋白和外泌体蛋白丰度进行定量并筛选出其中的GPI锚定蛋白。
1 材料与方法
1.1 不同类型肺癌mRNA阵列数据来源
所有肺癌类型的mRNA阵列数据均来自www.genome.wi.mit.edu/MPR/lung[13]。如之前所述,所有数据由一个简单的R包使用RLE (relative log expression) 箱线图和NUSE (normalized unscaled standard error) 箱线图计算[14]。共216例,其中4例因在过程质量控制中表现异常而丢弃。剩下的212个阵列数据包括以下患者:150个腺癌,20个支气管类癌,5个小细胞肺癌,21个鳞状肺癌,16个健康个体(表1)。
1.2 人GPI锚定蛋白来源
人GPI锚定蛋白数据来源于Uniprot数据库,搜索关键词为GPI-anchor (KW-0336), 最终得到173种GPI锚定蛋白(表2)。GPI锚定蛋白通过GPI-anchor或者GPI-like-anchor连接到膜的磷脂双分子层。GPI-anchor连接到磷脂酰肌醇基团的复合物,GPI-like-anchor连接到磷脂酰肌醇基团的GPI-anchor类似物,两者作用一样,使蛋白C端附着在膜上。
1.3 外泌体的提取和鉴定
NCI-H838细胞从ATCC (America Type Culture Collection) 购买,用含10%胎牛血清(Life Technologies,Carlsbad,CA,USA) 的RPMI-1640培养基 (Life Technologies,Carlsbad,CA,USA)在5% CO2,37 ℃条件下培养。提取外泌体前,NCI-H838细胞在10 cm培养皿中用无血清RPMI-1640培养基培养72 h,使融合度达到90%~100%。收集培养基,4 ℃条件下3000 r/min离心10 min以去除分离的细胞。随后,将培养基在4 ℃条件下10 000 r/min离心30 min以去除大的细胞外囊胞。收集上清,用0.22 μm滤管 (Millipore, Burlington, MA, USA) 过滤以去除细胞微泡和受到污染的凋亡体。在4 ℃条件下,用贝克曼L-80XP超速离心机(Beckman Coulter,Brea,CA,USA)以45Ti型固定角转子100 000 r/min离心2 h来分离上清。小心移除上清,用70 mL预冷PBS重悬,4 ℃条件下,在45Ti型固定角转子中100 000 r/min离心2 h。小心移除上清,用200 μL预冷PBS重悬收集外泌体。
用中科院细胞生物学研究所扫描电子显微镜(Quanta 250 SEM,FEI,USA)鉴定外泌体。取20 μL外泌体悬液作为样品,用不同固定液依次固定:2.5%戊二醛1.5 h、1%锇酸固定液1 h、2%单宁酸15 min和1%锇酸固定液0.5 h(每次固定后用0.1 mol/L磷酸缓冲液漂洗3次,每次10 min)。固定完成后,依次用不用浓度乙醇进行脱水处理:30%乙醇5 min,50%乙醇5 min,70%乙醇10 min,80%乙醇10 min,95%乙醇15 min,最后用100%乙醇(无水硫酸钠处理)处理2次,每次15 min。之后用临界点干燥法进行干燥,经过喷金处理后用扫描电镜进行观察。
1.4 膜蛋白和外泌体蛋白的提取
利用膜蛋白提取试剂盒(Thermo Scientific,USA,Cat:89842)来提取蛋白,按照使用说明操作。之后用Bradford法测定蛋白浓度,然后用SDS-PAGE凝胶电泳分离蛋白并用银染试剂盒(索莱宝,Cat:G7210)染色以初步鉴定蛋白。
1.5 质谱分析方法和数据分析
每个样品取135 μg,用FASP(filter-aided sample preparation)法进行蛋白质酶解。将每个样品中等量的消化多肽制成混合样品,用改良的High-pH RP法分成3个组分[14]。之后采用NanoDrop 2000测定样品肽浓度以保证上样量一致,用于质谱的起始蛋白量均为 2 μg。上述分级得到的3个多肽样本使用DDA(Date Dependent Acquisition,数据依赖采集)进行数据采集,每个样本采集一次,采集结果作为构建数据库使用。肽段混合物在EasynLC LC1200系统(San Jose,Thermo Fisher,Waltham,MA,USA)中用国产色谱柱C18(3 μm, 75 μm × 15 cm)以600 nL/min的速率进行分离。采用DIA法分析两种样品,同时加入等量索引保留时间标准(iRT,Biognosys)[15]。使用Proteome Discoverer 2.1(San Jose,Thermo Fisher,Waltham,MA,USA)针对人类uniprot蛋白质数据库(9606)搜索DDA原始文件。将利用Proteome Discoverer 2.1进行数据依赖性采集的搜索结果用Spectronaut 10 (Biognosys, Schlieren, Switzerland)转移到质谱库中。
在Spectronaut 10.0中应用以下设置:峰值检测,动态iRT,启用;矫正因子1;启用动态评分细化和MS1评分;干扰校正和归一化交叉相关(总峰面积),启用。在质谱库中确定碎片离子的数量,并且所有碎片离子都是鉴定和定量所必需的。Spectronaut利用加入的标准iRT肽进行m/z和保留时间校准。对于我们的数据集,m/z耐受性在4 mg/L的范围内,中值保留时间提取窗口为8 min。所有结果均通过Q值0.01(相当于肽水平上FDR为1%)进行筛选。所有其他设置都设置为默认值。将Spectronaut输出文件中每种蛋白的肽峰面积(由Spectronaut计算的碎片离子峰面积的总和)相加来计算蛋白质丰度。
2 结果与分析
2.1 外泌体及蛋白的提取和鉴定
如图1所示,A、B分别为放大15 000和30 000倍电镜图,外泌体在电子显微镜下清晰可见,说明成功提取到NCI-H838细胞系外泌体。 外泌体大小不一,多为盘状囊泡结构。图2为NCI-H838细胞膜和外泌体蛋白SDS-PAGE凝胶电泳图,该图表明成功提取到蛋白样品。
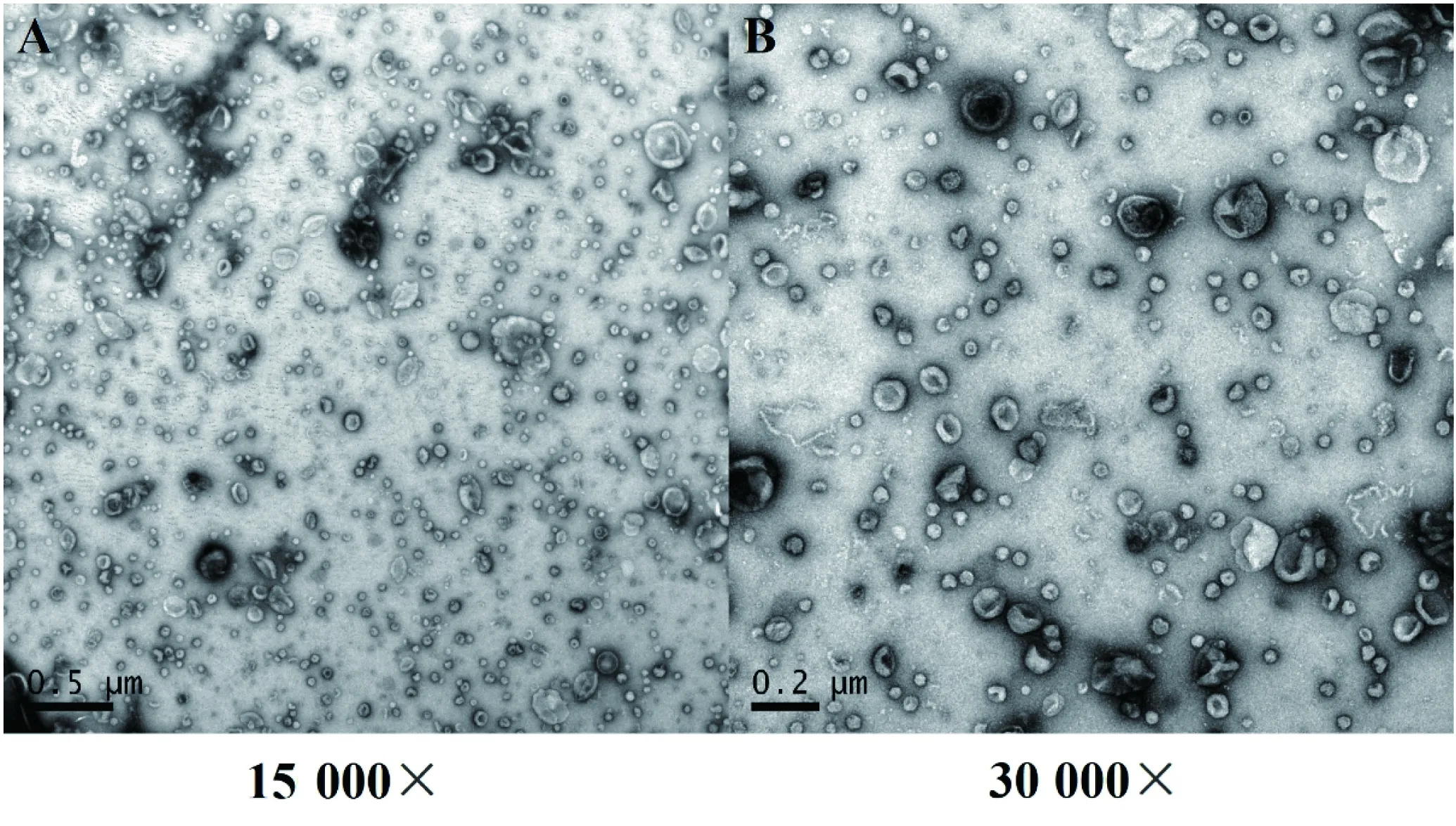
图1 NCI-H838细胞外泌体Figure 1 Exosomes from NCI-H838 cells
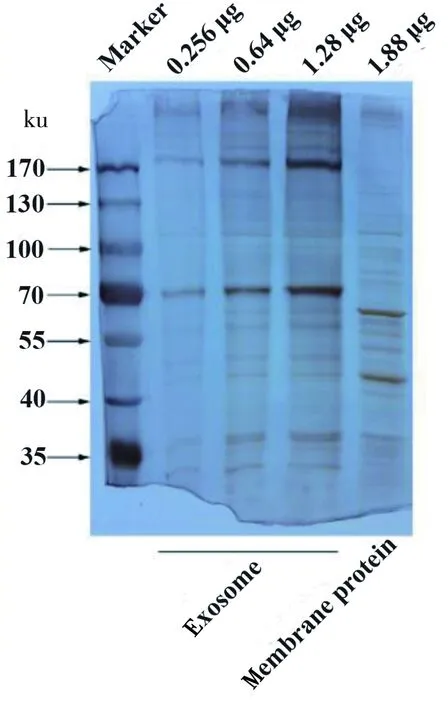
图2 NCI-838细胞膜蛋白和外泌体蛋白SDS-PAGE凝胶电泳图Figure 2 SDS-PAGE gel electrophoresis of membrane and exosome protein from NCI-838 cell line
2.2 GPI锚定蛋白数据
利用Uniprot数据库的173种人GPI锚定蛋白数据在TCGA来源的肺癌病人进行筛选,得到114种GPI锚定蛋白,其中43种有明显表达差异(P≤0.05)。在得到这些数据之后,利用质谱技术对非小细胞肺癌细胞膜蛋白和外泌体蛋白进行了DIA定量,然后在NCI-H838细胞定量结果中进行筛选。结果(表1)显示共得到19种GPI锚定蛋白,其中存在于外泌体的有15种。
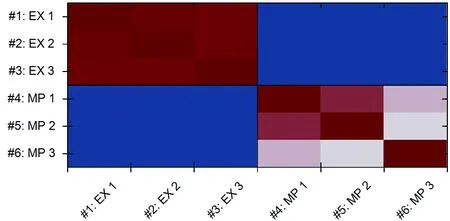
EX:Exosome;MP:Membrane protein
图3样本相互之间相关性
Figure 3 Correlation analysis between exosome and membrane proteins
利用蛋白质组学分析软件ProteomeDiscoverer 2.1对DDA采集的数据进行蛋白质鉴定分析,鉴定结果作为DIA定量数据库使用,检索数据库采用Uniprot网站下载的Human数据库(数据库编号9606),数据库中加入了11条人工合成多肽的氨基酸序列信息,搜库引擎使用Sequest HT。为了去除假阳性结果,数据检索采用正反库检索策略,检索结果在多肽层次以及蛋白层次均进行了过滤以保证鉴定结果的可靠性。使用Spectronaut软件将上述DDA采集的数据构建为定量数据库,然后将采集的DIA原始数据与该定量数据库进行比对,抽提各个蛋白质特异性肽段的定量色谱峰面积,以此作为蛋白质相对丰度表征,并对各个样本中的蛋白质丰度进行比较,筛选差异表达蛋白。
样本相互之间的相关性分析结果(图3)显示,组内样本相关性非常高,接近1,这显示了良好的重复性。图 4则进一步说明了样本组内重复性较高,此外,从聚类图中可以看出EX(exosome)与MP(membrane protein)样本的表达差异较大,EX蛋白种类明显少于MP。
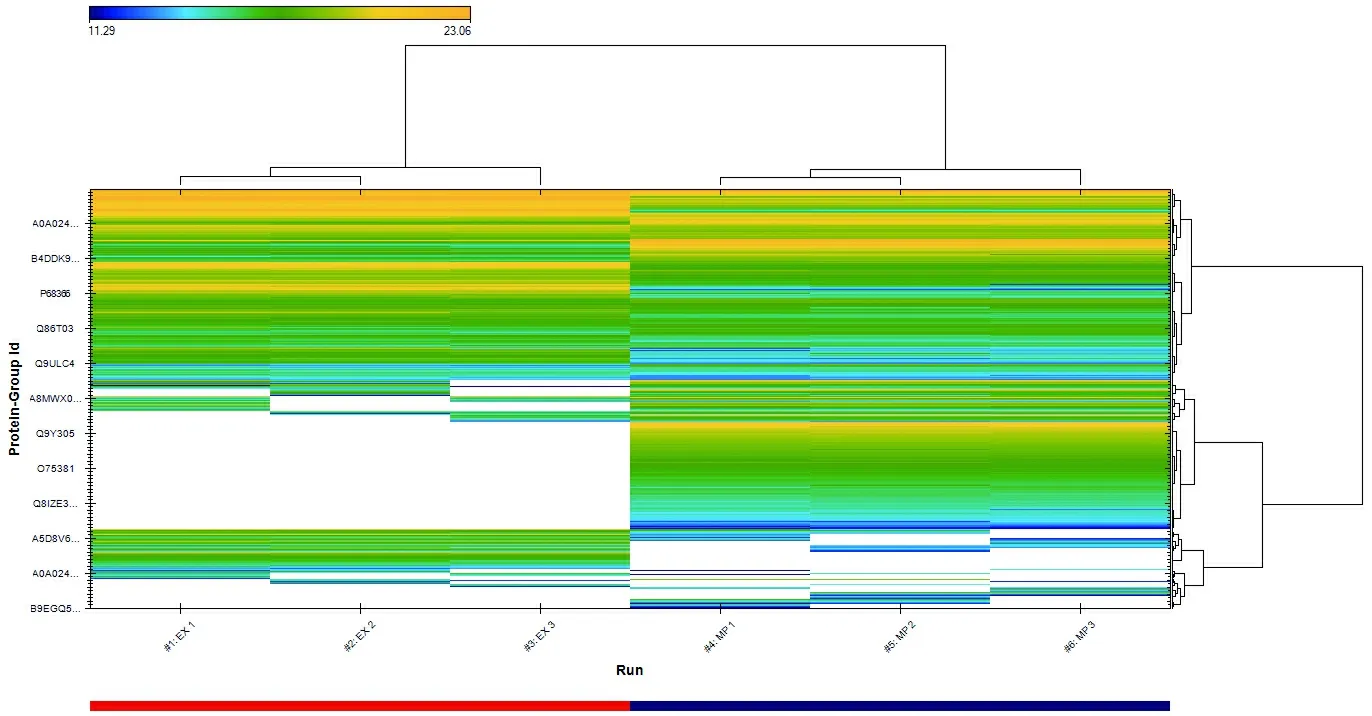
EX:Exosome;MP:Membrane protein
图4聚类分析图
Figure 4 Clustering analysis of exosome and membrane proteins
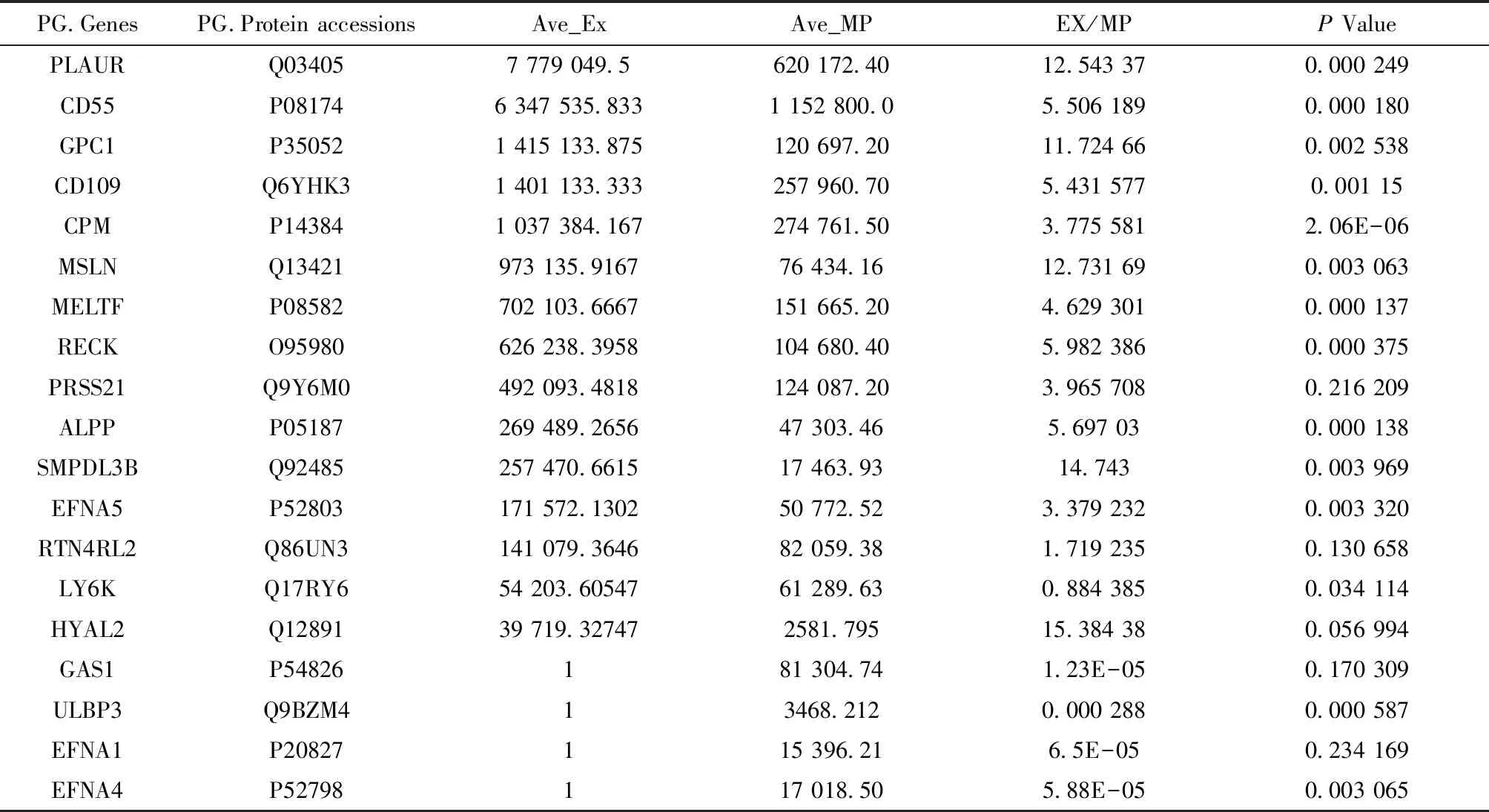
表1 NCI-H838细胞系GPI锚定蛋白定量结果
注:表中数值1表示在外泌体中未发现该蛋白或者其含量极少可以忽略不计
2.3 可作为肿瘤诊断标记物的GPI锚定蛋白
如表2所示,在NCI-H838细胞系外泌体中有定量且在TCGA数据库mRNA阵列数据中存在的GPI锚定蛋白共11种,其中在肺癌病人和健康个体之间有明显表达差异的有7种,分别是: MSLN、CPM、SMPDL3B、HYAL2、EFNA5、RECK和GPC1。由图5可以看出,上述7种蛋白在外泌体和细胞膜的表达量差异较大,另外,GPC1、CPM、MSLN、RECK、SMPDL3B、EFNA5和HYAL2在外泌体与细胞膜的含量比值分别约为11.7、3.8、12.7、6.0、14.7、3.4和15.4,蛋白丰度差异性较大,在检测相应蛋白在外泌体中含量时受到的影响可能较小。
2.4 GPI锚定蛋白的O-糖基化
糖基化是细胞内最丰富的翻译后修饰之一。在正常生理条件下,细胞外蛋白的O-糖基化对结构和功能都是至关重要的。但是恶性肿瘤会干扰O-糖基化通路和改变短O-聚糖的表达,这也是其最常见和最显著的特征[16-17]。GPI锚定蛋白作为一类在生长发育、信号转导等起重要作用,同时又参与肿瘤侵袭与转移的重要分子[6-8],其O-糖基化对于肿瘤也必然具有重要意义。如表3所示,在114种肺癌GPI锚定蛋白mRNA阵列数据中,19种有O-糖基化修饰存在,其中8种有连续O-糖基化修饰。
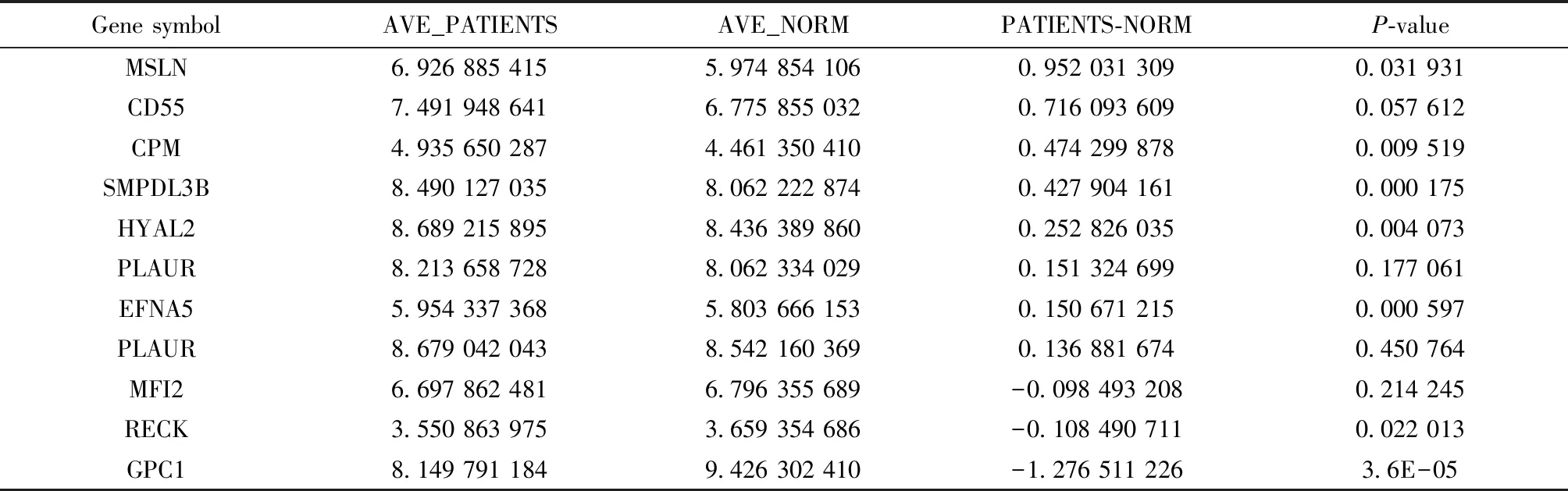
表2 NCI-H838细胞系外泌体和TCGA数据库肺癌病人共有GPI锚定蛋白
注:AVE_PATIENTS为肺癌病人mRNA阵列数据;AVE_NORM为健康个体mRNA阵列数据;PATIENTS-NORM表示基因在肺癌病人和健康个体的表达差异
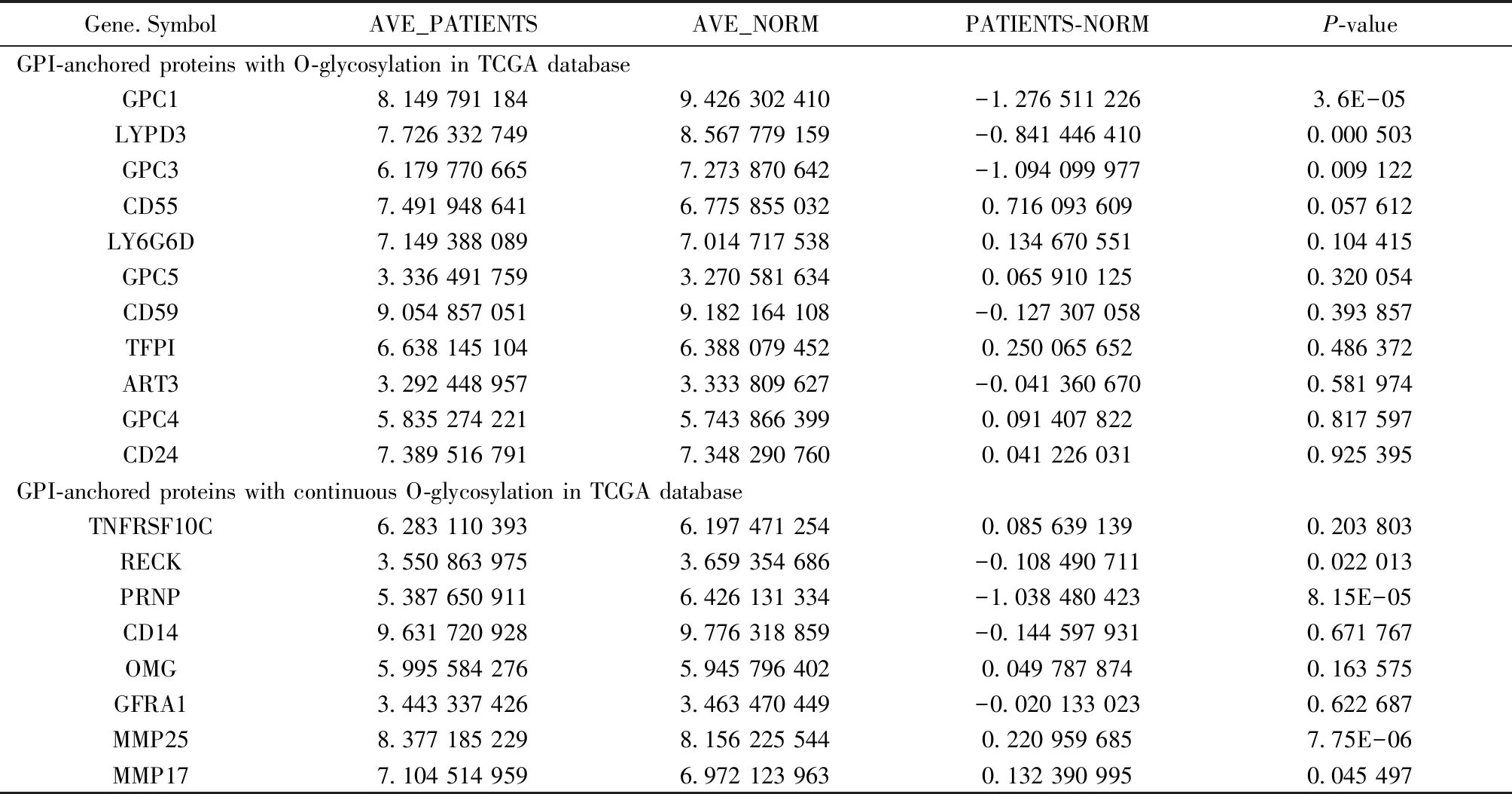
表3 TCGA数据库中有O-糖基化修饰的GPI锚定蛋白Table 3 GPI-anchored proteins with O-glycosylation modifications in TCGA database

图5筛选的7种GPI锚定蛋白在NCI-H838细胞膜和外泌体中的定量
Figure 5 Quantification of the 7 screened GPI-anchored proteins in NCI-H838 cell membranes and exosomes
在NCI-H838细胞系外泌体15种GPI锚定蛋白中,CD55、GPC1、RECK和RTN4RL2 4种有O-糖基化修饰,其中RECK和RTN4RL2有连续O-糖基化修饰。但是同时存在于肺癌病人GPI锚定蛋白mRNA阵列数据中的只有GPC1、RECK和CD55 3种。
3 讨论
肿瘤蛋白的O-糖基化修饰对肿瘤的转移有影响[18-21],通过相关糖基转移酶或分子伴侣等调节O-糖基化可影响肿瘤转移[22-24]。可能作为肺癌诊断标记物的7种GPI锚定蛋白中,只有GPC1和RECK有O-糖基化修饰,其中RECK具有连续O-糖基化修饰。RECK可以影响肿瘤的侵袭和转移[25-26],这意味着其具有作为肿瘤治疗工具的潜力。有报道称可利用RECK的小分子催化剂来抑制非小细胞肺癌的生长、发育和转移[27],我们的结果显示这一结论或许也适用于其他肺癌甚至其他癌症。GPC1可以作为外泌体标记物来进行肿瘤的早期诊断[28]。2015年,Melo及其团队利用免疫印迹、质谱、生物信息分析等方法,证明了GPC1阳性循环外泌体具有作为胰腺癌诊断标记物的潜力。GPC1在包括胰腺癌和乳腺癌在内的许多癌症中过表达[29-31],其在肺癌病人和健康个体中表达有明显差异,且大量存在于外泌体中。不过,本文数据表明GPC1在肺癌病人体内的表达是下降的,具体原因尚不明确。
RECK和GPC1一样,在肺癌病人体内的表达量下降,另外5种在肺癌病人体内的表达量则上升。值得注意的是,除了具有作为肿瘤诊断标记物的潜力之外,RECK、CPM和MSLN还具有作为肿瘤治疗工具的可能性,其中CPM和MSLN更是被大家看好[27, 32-35]。结合现有数据以及之前的研究,我们可以得出结论,筛选的7种GPI锚定蛋白有作为外泌体标记物来诊断癌症的潜力。但是,由于数据来源于肺癌病人,所以是否适用于其他癌症则需要进一步验证。另一方面,检测时外泌体的来源(血液、尿液等)同样需要进一步研究。
致谢:感谢潘登提供技术支持,同时感谢北京明德正康科技有限公司和上海透景生命科技股份有限公司在质谱分析和外泌体检测方面的帮助。
