巴斯德毕赤酵母MAPK/HOG信号通路的分子互作研究
2020-06-12王荣斌赵天宇卓俊林刘春立刘秀霞杨艳坤白仲虎
王荣斌, 赵天宇, 卓俊林, 刘春立,2,3, 刘秀霞,2,3, 杨艳坤,2,3, 白仲虎,2,3
(1. 江南大学 粮食发酵工艺与技术国家工程实验室, 无锡 214122; 2. 江南大学 工业生物技术教育部重点实验室, 无锡 214122; 3. 江南大学 糖化学与生物技术教育部重点实验室, 无锡 214122)
MAPK(Mitogen-activated protein kinase)信号通路是调控酵母生命过程重要和高度保守的信号传导途径之一,包括了4条MAPK信号途径,分别由α因子信息素、饥饿、高渗、细胞壁压力4种信号所诱导。其中,高渗透性甘油促分裂原活化蛋白激酶(High osmolarity glycerol mitogen-activated protein kinase,MAPK/HOG)信号通路在酵母适应外界渗透压变化中起着非常关键的作用,该途径在高渗应激环境下控制信号转导和基因表达,是细胞生存所必需的[1-2]。在酿酒酵母(Saccharomycescerevisiae)中,MAPK/HOG信号通路已经研究的比较清楚[3]:外界的高渗信号通过两个分支的MAPKKK蛋白激酶激活MAPKK蛋白激酶Pbs2,之后MAPK蛋白激酶Hog1被Pbs2磷酸化以激活下游Hot1、Msn2/4和Sko1等转录因子[4-5]。研究表明,Hot1、Msn2/4和Sko1负责激活88%的Hog1依赖性下游基因,从而促进甘油的转运或甘油的自身合成,以响应外界渗透压的变化[6]。其中,Hot1被Hog1活化后通过提高甘油合成基因GPD1和GPP2的表达[7-8],以及提高甘油转运相关蛋白STL1的表达两个方面提高胞内甘油的水平以保持细胞内外的渗透压平衡[9],维持细胞正常的分裂和生长,是细胞抵抗高渗十分关键的转录因子。
甘油是巴斯德毕赤酵母(Pichiapastoris)广泛应用的碳源[10],高浓度甘油形成的高渗环境,影响细胞周期和细胞代谢。而针对毕赤酵母MAPK/HOG信号通路的研究很少,因此不能很好地解决上述问题,这对此系统的应用十分不利。与酿酒酵母相比,毕赤酵母中的Hog1具有85%的同源性,然而Hot1、Msn2/4和Sko1等Hog1的主要转录因子同源性却很低。这表明,毕赤酵母MAPK/HOG信号通路可能已经发生了很大的变化,响应高渗的机制也相应改变。
本研究运用CRISPR/Cas9基因编辑系统敲除毕赤酵母MAPK/HOG信号通路中重要转录因子基因PBS2、HOG1、HOT1和HOT2[11-12],并检测了它们下游相关高渗应答基因MSN2、GT1、GPD1、DOG2、DAK1、HXT1、HSP12以及CTT1的转录水平,提出了巴斯德毕赤酵母MAPK/HOG信号通路模型。
1 材料与方法
1.1 主要材料
毕赤酵母GS115(组氨酸缺陷型)、大肠杆菌DH5α由本实验室保存;毕赤酵母GS115-Cas9菌株、sgRNA-BamH I质粒由本实验室构建;所用引物由苏州金唯智生物科技公司合成;Ultrapure RNA Kit购自北京康为世纪生物科技有限公司;其他本文所用设备、材料参照文献[13]。
1.2 sgRNA质粒的构建
将基因序列输入至网站(http://www.rgenome.net)中,选择PAM类型和菌种,选择评分高、GC含量合适的sgRNA序列,之后进行脱靶效应分析,以获得特异性高的sgRNA。sgRNA质粒构建思路如图1所示,根据sgRNA序列设计引物,并利用PCR的方法形成重组片段,将其和BamH I线性化的sgRNA-BamH I质粒重组,转化至大肠杆菌DH5α,利用菌落PCR和测序获得正确的克隆。
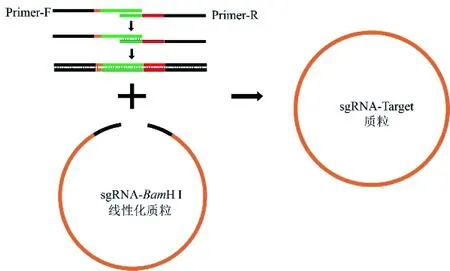
图1 sgRNA质粒构建思路
注:引物中黑色方块代表同源臂,红色方块为sgRNA序列,橙色方块代表sgRNA前6个碱基的反向互补序列,绿色方块为核锤头序列
1.3 毕赤酵母感受态的制作和转化
毕赤酵母的感受态制作和转化(电击法)实验步骤参照Invitrogen官方手册。
1.4 敲除菌株的筛选
转化后的酵母在组氨酸筛选平板上30 ℃培养2~3 d,所得单菌落挑至液体培养基中30 ℃,230 r/min过夜培养,之后提取酵母基因组DNA,提取方法参照文献[13],利用PCR方法扩增出目的片段后,进行测序验证。
1.5 高渗处理
固体培养:细胞于YPD培养基中过夜活化后,以OD600=0.3接种至新鲜YPD,至OD600=2.0时取相同菌体量进行10倍梯度稀释,3 μL接种至YPD和YPD+0.375 mol/L KCl固体平板上,30 ℃培养3 d,观察菌体生长情况。
液体培养:酵母过夜活化后,以OD600=0.1接种至新鲜YPD至OD600=1.0,取样并加入KCl溶液(终浓度0.375 mol/L),于10和30 min取样(结合前期实验和文献报道[6]确定)。
1.6 毕赤酵母RNA提取和转录水平检测
采用Ultrapure RNA Kit提取酵母总RNA,提取步骤参照试剂盒说明书;反转录及qPCR方法参照文献[13]。
2 结果与分析
2.1 sgRNA质粒的构建
毕赤酵母基因组注释中,有两个基因被注释为HOT1(Gene ID: 8196835,8200862)[14],将8196835称为HOT1,8200862称为HOT2[15]。针对PBS2、HOG1、HOT1和HOT2 4个基因,设计了评分大于70、高特异性的sgRNA,如表1所列。根据方法1.2进行重组,转化子菌落PCR所得条带与理论条带750 bp一致(图2),测序结果表明已获得正确克隆。

表1 sgRNA 序列

M: DL2000 Marker; 1~19: 待检测克隆
图2sgRNA质粒构建结果
Figure 2 The results of sgRNA plasmid construction
2.2 敲除菌株的筛选
根据方法1.4筛选阳性克隆。图3中红框区域发生了移码突变或碱基替换,证明已获得敲除菌株。
2.3 菌株在高渗下的生长
为了验证Hog1、Hot1和Hot2在细胞抵抗高渗中的作用,检测了突变菌株在高渗和正常条件下的生长情况。如图4所示,4种菌株在正常条件下的生长无显著差异,而hog1Δ、hot1Δ和hot2Δ在高渗平板的生长比对照菌株差,说明在毕赤酵母中Hog1、Hot1和Hot2对抵抗高渗有着重要作用。
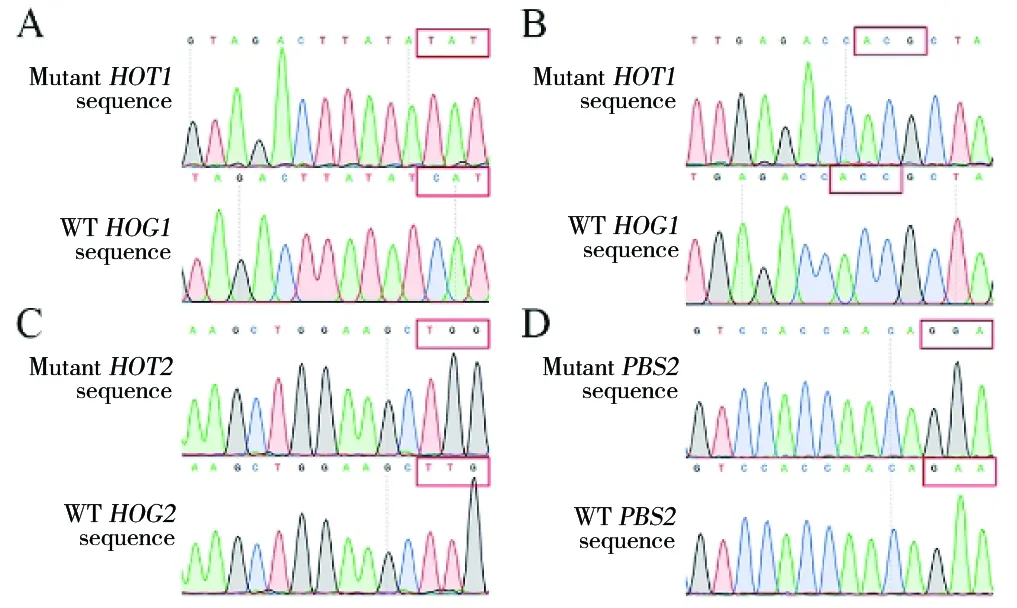
图3 敲除菌株序列比对结果
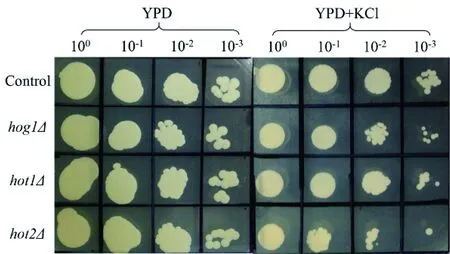
图4 菌株在高渗和正常条件下的生长
2.4 MAPK/HOG信号通路基因的检测
为了探究P.pastoris的MAPK/HOG信号通路中的基因转录水平的调控机制,在高渗和正常条件下,检测了pbs2Δ、hog1Δ、hot1Δ、hot2Δ和GS115对照菌株中相关基因的转录[6]。酿酒酵母中Pbs2仅通过蛋白水平磷酸化调控Hog1,为了确认毕赤酵母中Pbs2对Hog1的调控,首先检测了PBS2、HOG1基因的转录,如图5-A、B所示,二者在高渗和低渗情况下表达水平基本不变,且HOG1在pbs2Δ的表达与GS115一致,说明Pbs2对HOG1无转录水平调控。毕赤酵母中,Pbs2、Hog1具有很高的保守性,并都具有ATP结合位点和Ser/Thr蛋白激酶催化结构域,因此推测Pbs2可通过磷酸化调控Hog1,下文中MSN2、HOT1、CTT1、HSP12等下游基因的转录在pbs2Δ、hog1Δ中表达情况一致,近一步支持了这个推论。
之后,检测了Hog1对其下游重要转录因子MSN2、HOT1和HOT2的调控。如图5-C,在高渗和正常条件下,hog1Δ、pbs2Δ菌株中MSN2表达量均下降至GS115的1/3水平,说明Pbs2、Hog1对MSN2转录起到了重要作用。正常条件下,HOT1在pbs2Δ、hog1Δ菌株中的表达量仅为GS115的1/3(图5-D),说明Hog1参与对HOT1转录水平的调控,但HOT1在高渗条件的表达可恢复至野生型水平,表明HOT1的表达并不完全依赖于Hog1和Pbs2,可能存在其他转录因子调控HOT1的表达。Pbs2、Hog1在转录水平不调控HOT2(图5-E)。
酿酒酵母中,STL1、GPD1、DOG2、HXT1、DAK1、CTT1及HSP12均为Hog1、Hot1的下游响应基因,为了确认上述基因在毕赤酵母中所受的调控,对它们进行了转录水平的检测。由于STL1和GPD1在酿酒酵母中抵抗高渗的重要作用,先检测了3种突变株和GS115菌株中GT1(STL1在毕赤酵母中的同源基因[16-17])和GPD1的基因表达情况。酿酒酵母中STL1的表达完全依赖于Hot1和Hog1,二者缺一不可[18],而毕赤酵母中GT1在敲除菌中依然会响应高渗而高表达,不再依赖于Hog1、Hot1及Hot2的存在(图5-F)。同时,GPD1不再响应高渗而高表达,在转录水平也不再受Hog1、Hot1及Hot2的调控(图5-G)。
如图5-H、J,HOG1的缺失影响了DOG2、DAK1和HXT1在正常条件下的表达,但在高渗条件下,它们的表达水平与GS115相当,因此可能存在其他转录因子参与调控。hot2Δ菌株中HXT1表达量明显降低,说明Hot2参与对HXT1的转录调控。CTT1和HSP12对高渗的响应十分显著,PBS2、HOG1缺失时,CTT1、HSP12表达显著下降,Pbs2、Hog1对其转录是必需的(图5-K和L)。图5-H、L显示,Hot1并不参与对这些基因的调控。

A~L分别为各个基因qPCR结果,GS115、pbs2Δ、hog1Δ、hot1Δ和hot2Δ表示4种菌株的低渗条件下的转录水平,菌株后的10和30表示高渗处理时间,如GS115-10表示GS115菌株高渗处理10 min
图5高渗和正常条件下基因的表达
Figure 5 The expression of relevant genes in pre-stress and hyperosmotic stress condition
2.5 毕赤酵母MAPK/HOG信号通路模型
综合实验结果及前期研究,总结了P.pastoris的MAPK/HOG信号通路初步模型(图6)。
外界高渗信号被传导至Pbs2和Hog1后,Hog1激活Hot1、Hot2和Msn2等转录因子,使它们激活或抑制下游响应基因DOG2、DAK1、HXT1、HSP12及CTT1的表达,从而对抗外界的高渗环境。与酿酒酵母相比,调控机制已发生改变,主要体现在:1)虽然Hog1是主要的调控转录因子,但可能存在其他可激活下游基因的转录因子;2)GT1、GPD1等基因在转录水平不再受Hot1、Hot2的调控,Hot2只调控HXT1的转录;3)与酿酒酵母相比,毕赤酵母通过提高甘油相关基因GT1、GPD1表达抵抗高渗的能力有限;而CTT1和HSP12等负责修复的基因表达量却提高很多,CTT1与DNA损伤修复和细胞寿命有关[19],HSP12与细胞膜维持有关[20]。因此,推测毕赤酵母主要是通过维持细胞膜结构和DNA损伤修复等方面减少高渗对细胞的损伤,具体机制有待进一步研究。
3 结论
MAPK/HOG信号通路在酵母适应外界渗透压变化中起着非常关键的作用。P.pastoris作为一个主流的外源蛋白真核表达系统,其MAPK信号通路一直未被系统研究。毕赤酵母MAPK/HOG信号通路中Pbs2、Hog1两个重要的上游转录因子保守性非常高,但其下游的转录因子Hot1、Hot2和Msn2与酿酒酵母相比同源性却很低,因此推测毕赤酵母中MAPK/HOG信号通路可能发生了改变。本文应用CRISPR/Cas9系统敲除了关键的PBS2、HOG1、HOT1、HOT2等基因,并检测了高渗和正常条件下相关基因的转录,确定了毕赤酵母MAPK/HOG信号通路中的相关基因,并提出了毕赤酵母MAPK/HOG信号通路模型,为后续的研究奠定了基础。

图6 巴斯德毕赤酵母MAPK/HOG信号通路模型
注:红色、绿色和黑色边框分别代表在高渗下表达升高、降低和不变;箭头和T形表示上游对其调控分别是正向和反向,实线表示通过实验证实,虚线表示推测结果
在本研究的基础上,仍有很多研究工作可以开展,例如:存在未知转录因子参与高渗调控,但仍需进一步鉴定。此外,本文未涉及蛋白水平调控机制的研究,蛋白水平调控和信号转导方式磷酸化都需要在以后的实验中进一步研究。
