lncRNA DCST1-AS1靶向miR-874-3p对直肠癌细胞增殖和凋亡的影响
2020-06-12
颜王鑫,戚晓哲,林继徐,周慧珍,陈亮,温州市人民医院结直肠肛门外科 浙江省温州市 325000
孙跃胜,温州市人民医院普外科 浙江省温州市 325000
0 引言
直肠癌(rectal cancer,RC)是世界上常见的消化道恶性肿瘤,且50岁以下人群发病率呈上升趋势,且晚期患者居多[1,2].随着分子生物学的进步与发展,分子靶向治疗可能成为治疗RC的重要手段,因而探究新的诊断和治疗靶点,有助于提高治疗效果及改善患者预后.多种长链非编码RNA (long non-coding RNA,lncRNA)和miRNA在RC中表达失调,并可能作为RC诊断及治疗的潜在靶点[3].研究表明,lncRNA DCST1-AS1在肝癌和三阴性乳腺癌组织和细胞中表达上调,其表达水平与癌细胞的增殖和转移密切相关[4,5].经StarBase预测发现,miR-874-3p与lncRNA DCST1-AS1存在结合位点.miR-874-3p在食管鳞状细胞癌、上皮性卵巢癌组织及结RC组织中低表达,与癌细胞增殖、转移或凋亡有关[6-8].但lncRNA DCST1-AS1和miR-874-3p在RC组织和细胞中的表达、作用及两者的关系,目前还尚未可知.本课题研究lncRNA DCST1-AS1和miR-874-3p在RC组织中的表达,及两者对RC SW1463细胞增殖、凋亡的影响和分子机制,以期为RC的靶向治疗提供新靶点.
1 材料和方法
1.1 材料 选取2017-06/2018-12本院病理检查确诊为RC的患者手术切除的RC组织及癌旁组织(距离RC组织边缘>5 cm)各30例,将组织标本置于液氮中保存,术后转移至-80 ℃超低温冰箱内保存.男19例,女11例,年龄19-74岁(49.93岁±18.59岁),参照AJCC第八版RC pTNM分期系统进行分期:Ⅰ期4例,Ⅱ期12例,Ⅲ期9例,Ⅳ期5例.所有患者术前未接受放疗和化疗.人RC细胞株SW1463购自美国ATCC;DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;四氮唑蓝(thiazolyl blue tetrazolium bromide,MTT)、二甲基亚矾(dimethyl sulfoxide,DMSO)和胰蛋白酶购自美国Sigma-Aldrich公司;凋亡检测试剂盒购自上海碧云天生物技术有限公司;TRIzol试剂、实时定量聚合酶链式反应(real-time polymerase chain reaction,Real-time PCR)试剂盒、反转录试剂盒购自宝生物工程(大连)有限公司;lncRNA DCST1-AS1抑制物(si-DCST1-AS1)、lncRNA DCST1-AS1过表达载体pcDNA-DCST1-AS1、miR-874-3p mimics (miR-874-3p)、miR-874-3p干扰剂(anti-miR-874-3p)、阴性对照(si-NC、miR-NC、anti-miR-NC、pcDNA)和引物购自上海吉玛制药有限公司;双荧光素酶报告系统购自美国Promega公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;流式细胞仪购自美国BD公司;Real-time PCR仪购自美国Bio-Rad公司.
1.2 方法
1.2.1 细胞培养和转染:将RC SW1463细胞接种于DMEM培养液(含10%FBS+100 U/mL青霉素+100 μg/mL链霉素)中,置于37 ℃ 5% CO2培养箱中常规培养,消化传代.将对数生长期的SW1463细胞以2×l05个细胞/孔接种于6孔板中,细胞融合度达到80%时根据转染试剂盒说明书进行转染.根据转染载体分组为si-NC组、si-DCST1-AS1组、miR-NC组、miR-874-3p组、pcDNA组、pcDNA-DCST1-AS1组、si-DCST1-AS1+anti-miRNC组和si-DCST1-AS1+anti-miR-874-3p组.转染48 h后收集细胞验证后进行后续实验.
1.2.2 Real-time PCR检测lncRNA DCST1-AS1和miR-874-3p的表达:用TRIzol试剂提取RC组织、癌旁组织或细胞总RNA,保存于-80℃.然后按照反转录PCR试剂盒说明书合成cDNA,以cDNA为模板进行Real-time PCR检测miR-874-3p和lncRNA DCST1-AS1,反应程序:95 ℃ 2 min;然后95 ℃ 15 s,55 ℃1 min,共40个循环.引 物 如 下:miR-874-3p 上 游:5’-GAACTCCACTGTAGCAGAGATGGT-3’,下游:5’-CATTTTTTCCACTCCTCTTCTCTC-3’;lncRNA DCST1-AS1上游:5’-TTCGTCTGGTCCCAATGTGTGG-3’,下游:5’-AAGCAGGACGAGTAAACCAACC-3’.用2-△△Ct方法进行数据分析.
1.2.3 MTT实验测定细胞增殖:将SW1463细胞以1×103个细胞/孔(100 μL细胞/孔)接种于96微孔板中,分别在培养至24 h、48 h、72 h时进行MTT实验,每孔分别加入20 μL MTT溶液,培养4 h,弃培养上清,每孔再加入150 μL DMSO,室温震荡混匀15 min,酶标仪测定490 nm吸光度值.
1.2.4 流式细胞术检测细胞凋亡率:将转染后各组SW1463细胞接种于6孔板中,培养至对数生长期,收集细胞后用PBS缓冲液洗涤2次,胰酶消化,根据凋亡试剂盒说明书操作,上流式细胞仪检测分析细胞凋亡率.
1.2.5 Western blot检测细胞中细胞周期蛋白1(CyclinD1)、p21、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和Bcl-2相关蛋白(Bcl-2-associated X protein,Bax)蛋白:收集转染后各组SW1463细胞,提取细胞总蛋白,将蛋白样本进行SDS-PAGE,转PVDF膜,室温封闭2 h,加入稀释后的一抗,37 ℃过夜孵育,洗膜后加入稀释的酶标二抗,显影,拍照,以GAPDH为内参照,分析蛋白表达水平.
1.2.6 双荧光素酶报告系统实验:根据方法1.2.1进行转染,将构建的lncRNA DCST1-AS1的野生型(WT-DCST1-AS1)和突变型(MUT-DCST1-AS1)双荧光素酶报告载体,分别与miR-NC或miR-874-3p共转染SW1463细胞,转染48 h,收集、裂解细胞并离心收集上清,根据试剂盒说明书进行操作,以海肾荧光素酶活性为内参照,检测并计算相对萤火虫荧光素酶活性.
统计学处理数据均以mean±SD表示,数据用SPSS 19.0软件进行分析,P<0.05为差异有统计学意义.两组间采用独立样本t检验,多实验组间比较采用单因素方差进行分析.
2 结果
2.1 lncRNA DCST1-AS1和miR-874-3p在RC组织中的表达 与癌旁组织组相比,在RC组织组中lncRNA DCST1-AS1含量显著升高(P<0.05),而miR-874-3p含量显著降低(P<0.05)(表1).
2.2 抑制lncRNA DCST1-AS1表达对RC SW1463细胞增殖的影响 实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)、Western blot和MTT实验结果表明,与si-NC组相比,si-DCST1-AS1组SW1463细胞中的lncRNA DCST1-AS1含量降低,细胞活性[光密度(optical density,OD)=490 nm]在24 h、48 h、72 h均显著下降,CyclinD1含量降低,p21蛋白含量升高,均具有统计学意义(P<0.05)(图1和表2).说明抑制lncRNA DCST1-AS1表达可以抑制RC SW1463细胞增殖.
2.3 抑制lncRNA DCST1-AS1表达对RC SW1463细胞凋亡的影响 转染si-DCST1-AS1后,与对照si-NC组相比,si-DCST1-AS1组的SW1463细胞凋亡率显著增加,Bcl-2含量降低,Bax含量升高,差异具有统计学意义(P<0.05)(图2和表3).
2.4 lncRNA DCST1-AS1靶向调控miR-874-3p的表达通过StarBase预测发现,miR-874-3p与lncRNA DCST1-AS1的序列中含互补的位点(图3).双荧光素酶报告系统结果显示,与对照miR-NC组相比,miR-874-3p组野生型WT-DCST1-AS1的萤火虫荧光素酶相对活性显著下降(P<0.05),而突变型MUT-DCST1-AS1的萤火虫荧光素酶相对活性无变化(表4).qRT-PCR结果表明,上调lncRNA DCST1-AS1可下调miR-874-3p含量,下调lncRNA DCST1-AS1可显著上调miR-874-3p含量(表5).
2.5 miR-874-3p过表达对RC SW1463细胞增殖和凋亡的影响 结果表明,与miR-NC组相比,miR-874-3p组SW1463细胞中的miR-874-3p含量显著升高,细胞OD值在24 h、48 h和72 h时均显著降低,细胞凋亡率显著升高,CyclinD1和Bcl-2蛋白含量降低,p21和Bax含量升高,差异具有统计学意义(P<0.05),见图4和表6.
2.6 干扰miR-874-3p表达逆转了抑制lncRNA DCST1-AS1表达对RC SW1463细胞增殖和凋亡的作用 为确认lncRNA DCST1-AS1通过调控miR-874-3p对RC SW1463细胞增殖和凋亡发挥调控作用,在抑制lncRNA DCST1-AS1同时干扰miR-874-3p.结果表明,与si-DCST1-AS1+anti-miR-NC组相比,si-lncRNA DCST1-AS1+antimiR-874-3p组SW1463细胞OD值在24 h、48 h和72 h时显著升高,细胞凋亡率显著降低,CyclinD1和Bcl-2蛋白含量升高,p21和Bax含量降低,差异具有统计学意义(P<0.05)(图5和表7).
3 讨论
多种lncRNA、miRNA和mRNA在RC中上调或下调,通过lncRNA-miRNA等内源性RNA调控网络,参与大肠癌发生发展[3,9-13].因而本研究积极探寻新型LncRNA并探究其在RC发生及发展过程中的作用机制,为RC的靶向治疗提供新方向.
DCST1-AS1是一种lncRNA,在三阴性乳腺癌(triple negative breast cancer,TNBC)组织中表达上调,MYC激活DCST1-AS1,并与miR-873-5p结合促进TNBC细胞增殖和转移,DCST1-AS1基因敲除抑制TNBC细胞增殖和转移[5].lncRNA DCST1-AS1在肝细胞癌(hepatocellular carcinoma,HCC)组织中也高表达,并且其高表达与较大的肿瘤和较短的存活时间显著相关,敲除DCST1-AS1显著抑制HCC细胞增殖、促进细胞凋亡和周期阻滞,并抑制体内肿瘤生长,DCST1-AS1竞争性结合miR-1254,从而上调Fas凋亡抑制剂2促进HCC细胞的增殖[14].lncRNA DCST1-AS1在RC中的表达和作用尚不清楚.本研究检测30例RC组织发现,与癌旁组织相比,在RC组织中lncRNA DCST1-AS1的含量显著升高,抑制lncRNA DCST1-AS1可降低细胞中CyclinD1和Bcl-2含量,提高p21和Bax蛋白含量,抑制RC SW1463细胞增殖并促进细胞凋亡.
另外,本研究通过StarBase预测发现,miR-874-3p与lncRNA DCST1-AS1的序列间存在互补结合位点.通过双荧光素酶报告系统和qRT-PCR进一步发现,lncRNA DCST1-AS1靶向负调控miR-874-3p的表达.miR-874在多种癌症中发挥抑癌基因的作用.miR-874-3p在肝细胞癌组织下调,过表达miR-874-3p可靶向PIN1抑制肿瘤增殖并促进细胞凋亡[15].miR-874-3p在胶质瘤细胞中表达降低,过表达miR-874-3p可抑制胶质瘤细胞增殖、迁移、侵袭和管形成能力[16].miR-847在胃癌样本中表达下调,其过表达可靶向水通道蛋白-3抑制胃癌细胞的生长、迁移、侵袭和致瘤性[17].miR-874在结RC组织中表达明显下调并可抑制结RC细胞增殖及诱导细胞凋亡[18].本研究结果发现,miR-874-3p在RC组织中表达下调,过表达miR-874-3p可抑制RC SW1463细胞增殖,促进细胞凋亡,且干扰miR-874-3p表达则会逆转抑制lncRNA DCST1-AS1对SW1463细胞增殖、凋亡的作用,验证了两者在RC中存在调控关系.
综上,本研究阐述了在RC组织中,lncRNA DCST1-AS1上调,miR-874-3p下调,在RC SW1463细胞中lncRNA DCST1-AS1靶向miR-874-3p调控SW1463细胞增殖和凋亡,lncRNA DCST1-AS1可能是RC的潜在分子靶点.
文章亮点
实验背景
近年来,直肠癌(rectal cancer,RC)发病率与死亡率逐年上升,已严重威胁人类生命安全,目前RC发生及发展的分子机制尚未完全阐明.目前临床主要采用手术与放化疗结合等方式进行治疗,患者预后很差.随着生物技术的发展,分子靶向治疗逐渐成为RC等肿瘤的新型治疗手段,但关于RC靶向治疗的潜在作用靶点尚未完全阐明.
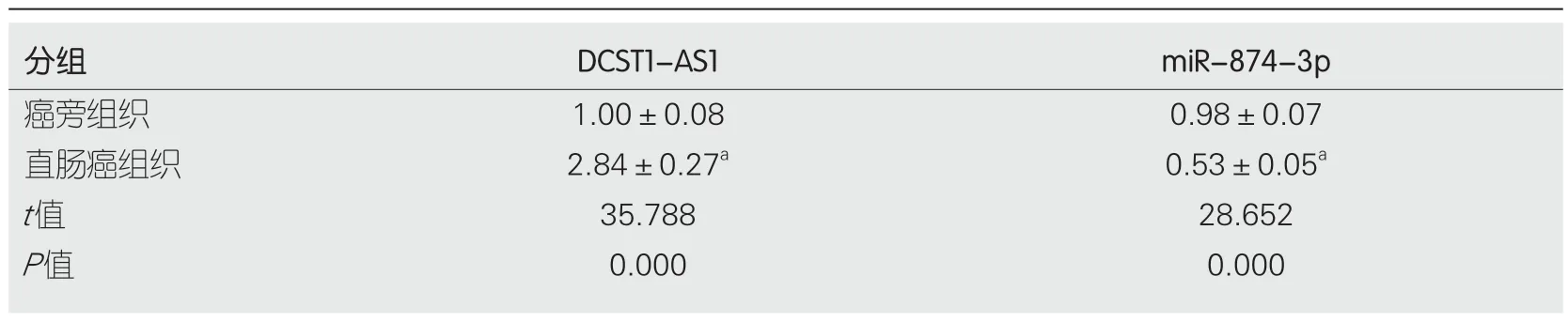
表1 lncRNA DCST1-AS1和miR-874-3p在直肠癌组织中的表达(mean±SD,n=30)
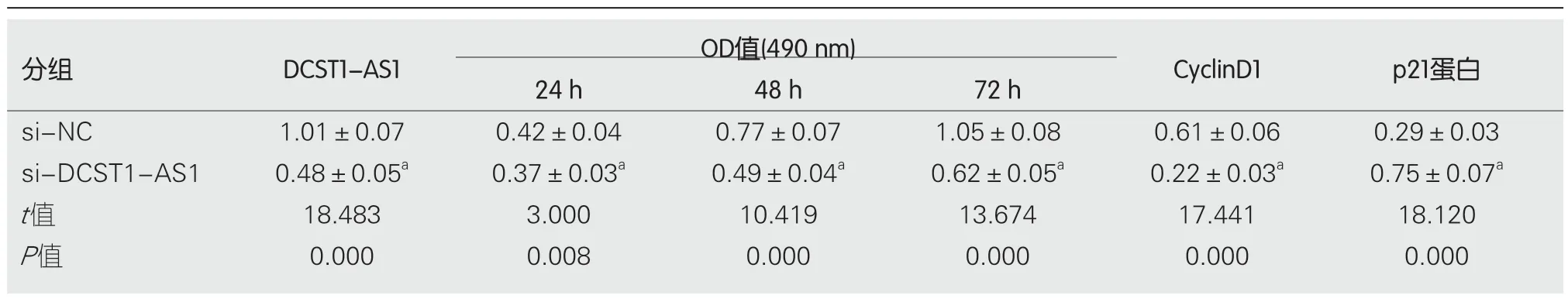
表2 抑制长链非编码RNA DCST1-AS1表达对直肠癌SW1463细胞增殖的影响(mean±SD,n=9)
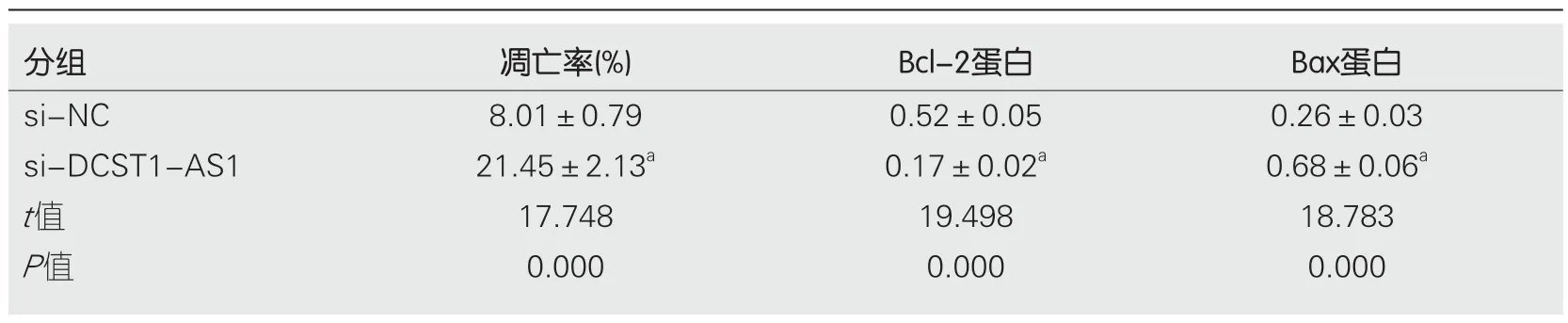
表3 抑制长链非编码RNA DCST1-AS1表达对直肠癌SW1463细胞凋亡的影响(mean±SD,n=9)
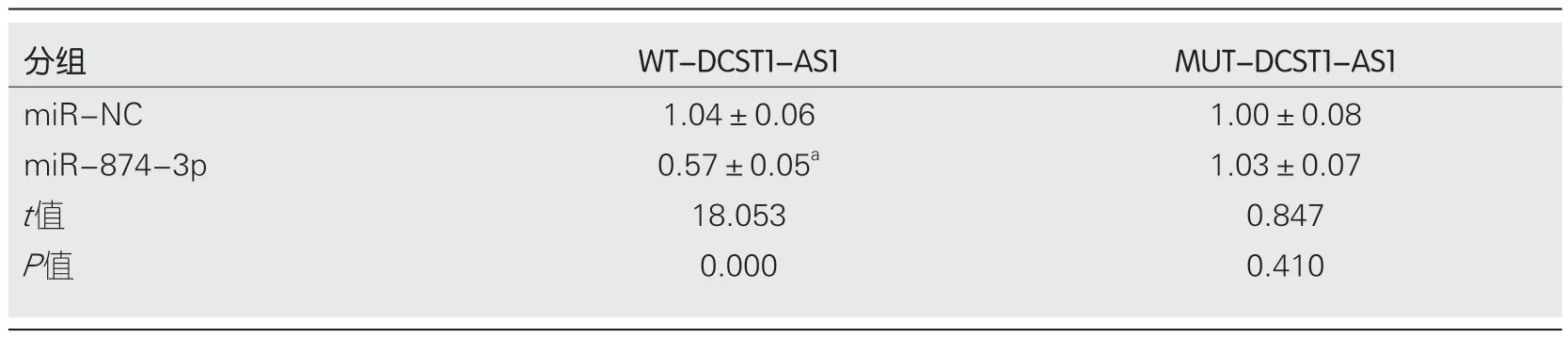
表4 双荧光素酶报告实验(mean±SD,n=9)
实验动机
长链非编码RNA (long non-coding RNA,lncRNA)在RC等肿瘤中表达异常,但关于其具体作用机制尚未完全阐明,lncRNA主要通过靶向调控miRNA表达而调控其靶基因表达从而调控肿瘤细胞增殖及凋亡等生物学过程,已有研究显示lncRNA DCST1-AS1在肿瘤发生及发展过程中发挥癌基因作用,但其在RC中的表达及其作用机制尚未阐明.
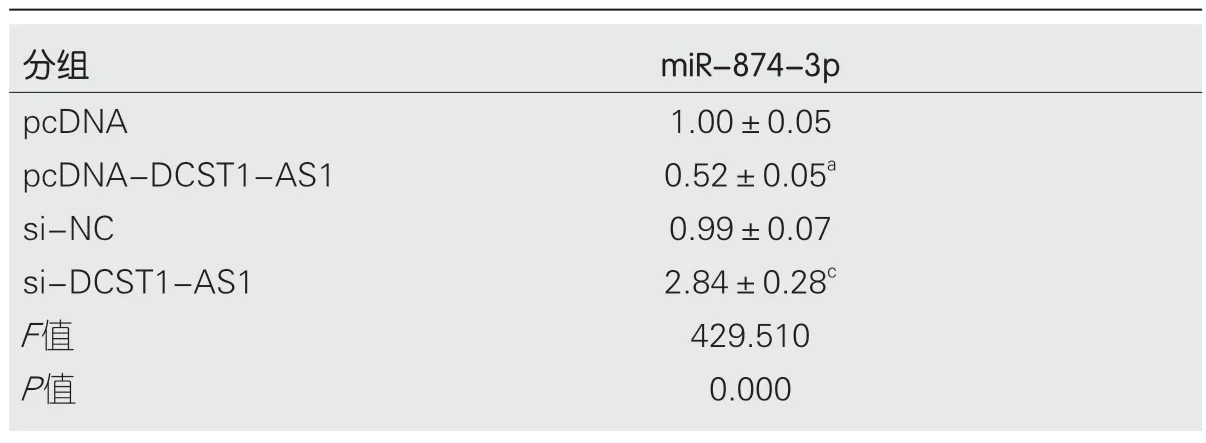
表5 长链非编码RNA DCST1-AS1调控miR-874-3p表达(mean±SD,n=9)
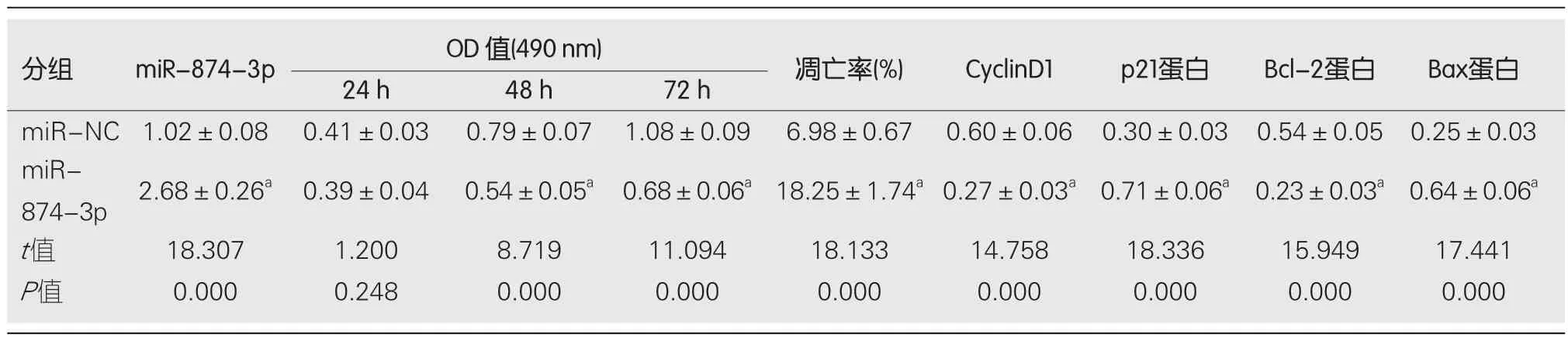
表6 miR-874-3p过表达对直肠癌SW1463细胞增殖和凋亡的影响(mean±SD,n=9)
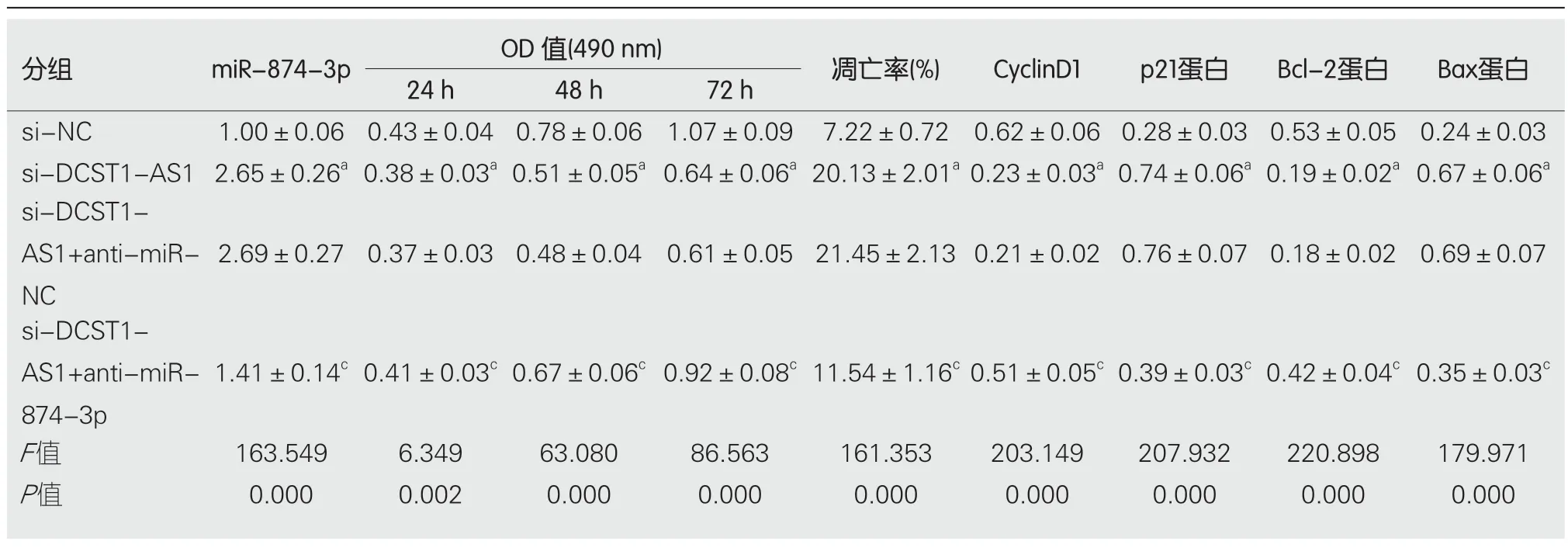
表7 干扰miR-874-3p表达逆转了抑制长链非编码RNA DCST1-AS1表达对直肠癌SW1463细胞增殖和凋亡的作用(mean±SD,n=9)
实验目标
本研究主要探究lncRNA DCST1-AS1在RC中的表达及其对miR-874-3p的靶向调控作用,为进一步揭示RC发病机制奠定实验基础,以期为RC的靶向治疗提供潜在的靶点.
实验方法
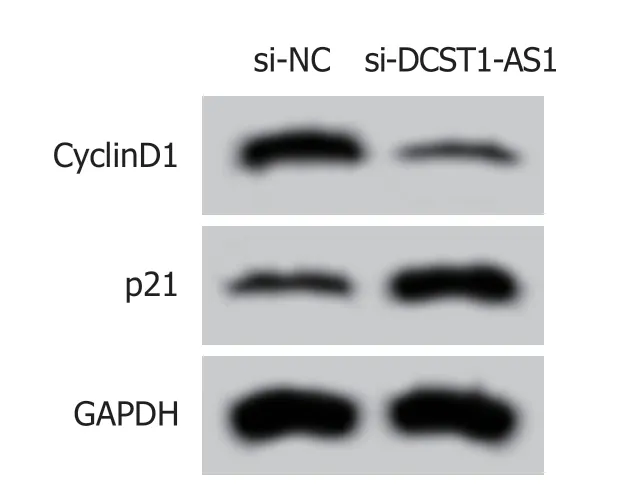
图1 增殖相关蛋白表达.CyclinD1:细胞周期蛋白1; GAPDH:甘油醛-3-磷酸脱氢酶.
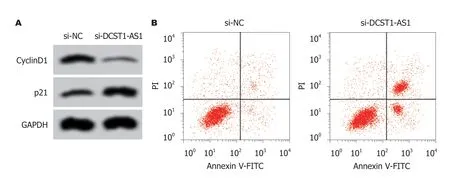
图2 抑制长链非编码RNA DCST1-AS1表达对直肠癌SW1463细胞凋亡的影响.A:凋亡相关蛋白表达; B:细胞凋亡流式图.Bcl-2:B淋巴细胞瘤-2; Bax:B淋巴细胞瘤-2相关蛋白; GAPDH:甘油醛-3-磷酸脱氢酶.
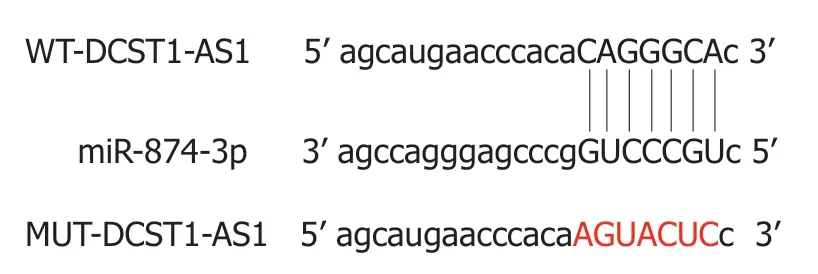
图3 lncRNA DCST1-AS1的序列中含有与miR-874-3p互补的核苷酸序列.WT-DCST1-AS1:野生型载体; MUT-DCST1-AS1:突变型载体.
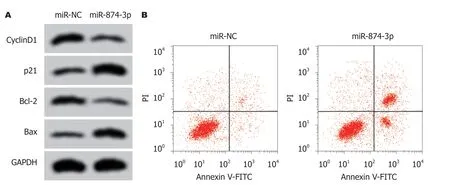
图4 miR-874-3p过表达对直肠癌SW1463细胞凋亡的影响.A:增殖、凋亡相关蛋白表达; B:细胞凋亡流式图.CyclinD1:细胞周期蛋白1;GAPDH:甘油醛-3-磷酸脱氢酶; Bcl-2:B淋巴细胞瘤-2; Bax:B淋巴细胞瘤-2相关蛋白.
采用实时荧光定量聚合酶链式反应方法检测RC组织及细胞中lncRNA DCST1-AS1与miR-874-3p的表达;采用脂质体转染技术分别将si-NC、si-DCST1-AS1、miRNC、miR-874-3p mimics、si-DCST1-AS1与anti-miRNC、si-DCST1-AS1与anti-miR-874-3p转染至RC细胞;采用MTT法检测细胞增殖;采用流式细胞术检测细胞凋亡率;采用Western blot法检测细胞增殖及凋亡相关蛋白表达;采用双荧光素酶报告实验验证lncRNA DCST1-AS1和miR-874-3p的靶向关系.
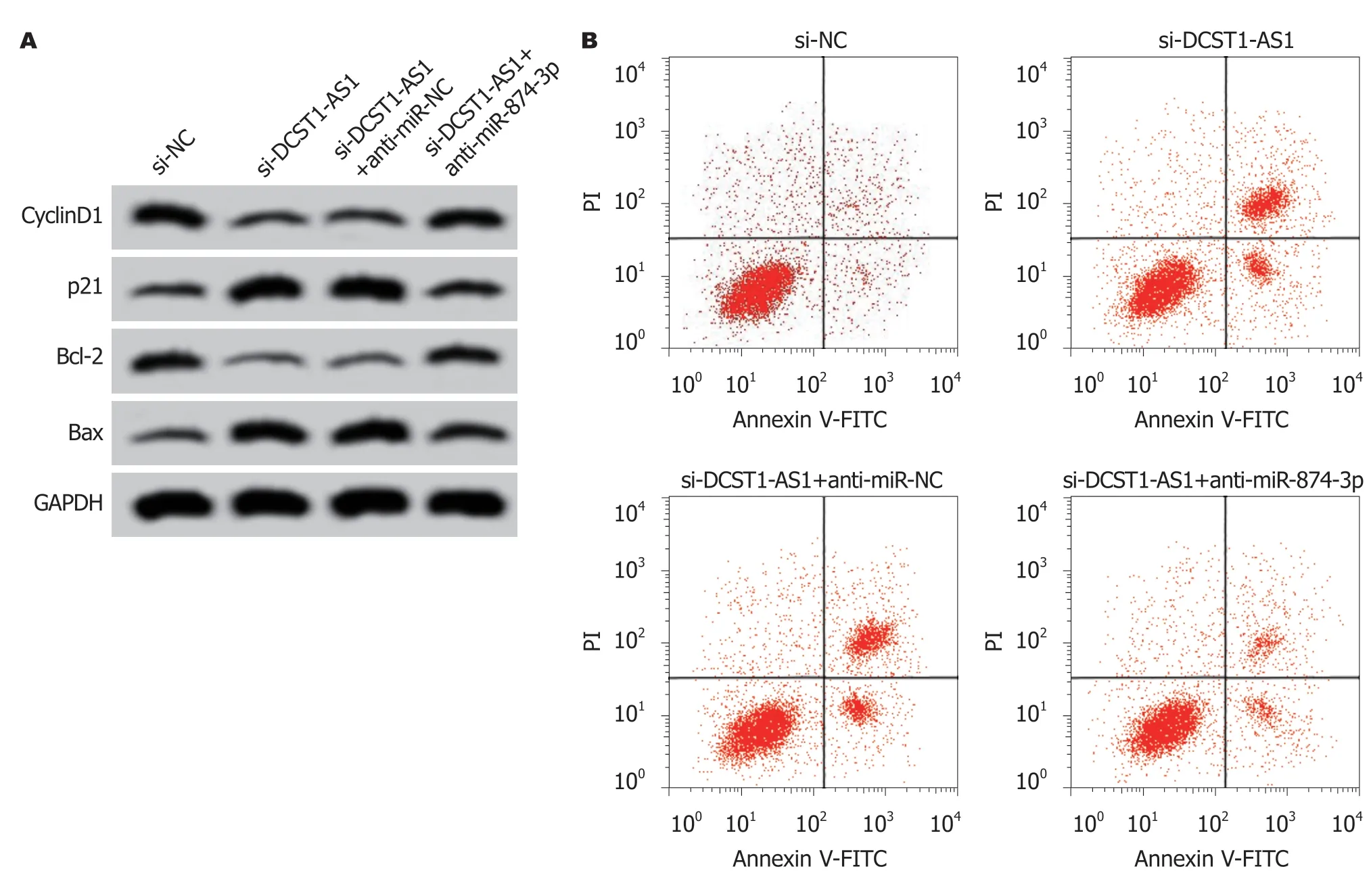
图5 干扰miR-874-3p表达逆转了抑制lncRNA DCST1-AS1对直肠癌SW1463细胞凋亡的作用.A:增殖、凋亡相关蛋白表达; B:细胞凋亡流式图.CyclinD1:细胞周期蛋白1; GAPDH:甘油醛-3-磷酸脱氢酶; Bcl-2:B淋巴细胞瘤-2; Bax:B淋巴细胞瘤-2相关蛋白.
实验结果
lncRNA DCST1-AS1在RC组织及细胞中呈高表达,而miR-874-3p呈低表达;干扰lncRNA DCST1-AS1表达或miR-874-3p过表达可显著抑制RC细胞增殖,促进细胞凋亡,并可促进p21、B淋巴细胞瘤-2相关蛋白表达及抑制细胞周期蛋白1、B淋巴细胞瘤-2表达;lncRNA DCST1-AS1可靶向结合miR-874-3p,并可负向调控miR-874-3p的表达;干扰miR-874-3p表达与干扰lncRNA DCST1-AS1表达共同处理可显著减弱干扰lncRNA DCST1-AS1表达对RC细胞增殖及凋亡的作用.
实验结论
本研究发现lncRNA DCST1-AS1在RC细胞中表达水平升高,miR-874-3p的表达水平降低;本研究提出干扰lncRNA DCST1-AS1表达可能通过靶向上调miR-874-3p的表达从而抑制RC细胞增殖及促进细胞凋亡;本研究结果可为RC的靶向治疗提供新方向,lncRNA DCST1-AS1可能作为RC治疗的潜在靶点.
展望前景
本研究将继续探究miR-874-3p下游靶基因表达,并分析lncRNA DCST1-AS1-miR-874-3p-靶mRNA分子轴在RC发生及发展过程中的作用机制;本研究将进一步采用体内动物实验验证lncRNA DCST1-AS1-miR-874-3p-靶mRNA分子轴在RC发病中的作用机制.
