甲基转移酶样蛋白家族的分子作用机制及在胃癌中的研究进展
2020-06-12
王婧,王文安,张安,甘肃中医药大学 甘肃省兰州市 730000
刘宏斌,解放军联勤保障部队第九四〇医院普外科 甘肃省兰州市 730000
0 引言
甲基化修饰广泛应用于调节RNA、DNA和蛋白质的活性,在正常机体和疾病的多种生物学行为中起重要作用,是近年来的研究前沿和热点.s-腺苷甲硫氨酸(s-adenosylmethionine,SAM)是几乎所有细胞甲基化反应的甲基供体,因此需要细胞精确地维持SAM的水平,但是目前对控制哺乳动物细胞内SAM丰度的机制却不甚了解.细菌使用核糖开关直接将细胞内SAM水平与由蛋氨酸和ATP生成SAM的SAM合成酶的生产联系起来.一些研究结果表明,人SAM合成酶的表达也受转录后调节[1-4].核苷甲基转移酶(methyltransferaselike proteins,METTL)是蛋白质的一个多样化家族,其特征是存在甲基转移酶样结构域和由中央的七链β-折叠结构形成的结构保守的SAM结合结构域.到目前为止,DNA(胞嘧啶-5)甲基转移酶蛋白质家族已经得到了很好的研究,并被鉴定为DNA (Dnmt1、3a和3b),也被鉴定为RNA (Dnmt2)甲基转移酶[5,6].METTL蛋白家族是通过调节SAM的浓度进而进行甲基化修饰.通过使用无标记定量质谱系统研究了HeLa细胞中METTL蛋白家族成员的相互作用伴侣,发现许多METTL蛋白在稳定的复合物之外发挥作用,而包括METTL3、METTL14和METTL7B在内的其他蛋白家族成员则具有高置信度的相互作用伴侣[5,7-9].下文主要介绍METTL蛋白家族的分子作用机制以及其中的几个家族成员在胃癌(gastric cancer,GC)中的研究进展.
1 METTL蛋白家族的概论
METTL蛋白家族的成员可在哺乳动物中甲基化RNA、DNA或蛋白质,家族成员主要进行RNA的甲基化修饰.
1.1 RNA甲基转移酶 METTL3和METTL14催化mRNA和主要miRNA中N6-甲基腺苷(N6-methyladenosine,m6A)的形成.有趣的是,要使METTL3具有活性,必须与METTL14一起组成一个完整的体系[10].对于METTL7B,研究鉴定了跨膜蛋白TMEM126A是高度信任的相互作用因子.TMEM126A本身是Myc原癌基因蛋白的靶标,也是功能未知的线粒体膜蛋白,该基因的缺陷可导致7型视神经萎缩.这种与线粒体膜蛋白的相互作用可能暗示了METTL7B在线粒体RNA甲基化中的潜在功能.METTL8可以在体外和人类细胞中催化RNA中3-甲基胞苷的形成.已经确定脯氨酰4-羟化酶亚单位α1是METTL8的交互因子,可以推测METTL8将RNA修饰与转录调节结合在一起.研究显示METTL1可以在与Trna[鸟嘌呤-N(7)-]-甲基转移酶非催化亚基WDR4形成复合体的情况下催化mRNA和tRNA中的7-甲基鸟苷形成[11-13].与此相反,另一种新近鉴定出的m6A RNA甲基转移酶METTL16似乎不需要其他蛋白质来发挥其甲基转移酶活性.通过对GFP-METTL16的纯化进行活性测试,在体外RNA甲基转移酶测定中,其纯化包含预期的总细胞RNA甲基转移酶活性,这表明METTL16确实没有为保持活性所需的必需伴侣[14].
1.2 DNA甲基转移酶 敲除METTL4的RNAi不仅诱导G1期细胞周期停滞,而且导致中期染色体排列缺陷,进而提出METTL4可能使DNA甲基化[15].METTL9是一种类甲基化转移酶,属于DREVl转甲基酶家族,可以与野生的P53结合,进而使DNA上的许多基因位点发生高甲基化,导致肿瘤抑制因子等重要基因失活.因此,可以通过研究DNA甲基转移酶抑制剂抑制特定位点上的核酸甲基化,进而可以纠正错误的甲基化修饰改变基因的表达,对疾病的诊治提供新的思路[16,17].
1.3 蛋白质甲基转移酶 METTL9和钙连接蛋白前体(calnexin precursor,CANX)之间的相互作用,通过进行了GFP-METTL9免疫沉淀,并按预期通过免疫印迹检测到CANX作为METTL9的相互作用因子.CANX在调节内质网腔内钙浓度中起着重要作用,并且可以作为蛋白质伴侣协助蛋白质折叠和质量控制.基于这种相互作用,我们可以推测METTL9可能是一种蛋白质而不是RNA甲基转移酶,并且可能将新生的蛋白质折叠与翻译后修饰结合在一起[7].研究表明METTL10和METTL11A是蛋白质甲基转移酶[8,17].
2 METTL3-METTL4复合体的分子作用机制及其在GC中的研究进展
m6A被发现于20世纪70年代,是腺嘌呤(A)第6位氮原子发生甲基化而形成的一种修饰,是真核生物RNA最常见的甲基化修饰[18-20].m6A是哺乳生物中mRNA和长链非编码RNA(long non-coding RNA,lncRNA)中最常见的内部修饰.M6A修饰受三种类型的酶调控:“写入程序”(甲基转移酶,包括WTAP,RBM15和METTL3/14/16等),“阅读程序”(RNA结合蛋白和异质核糖核蛋白的YTH域,包括YTHDF1/2/3等)和“橡皮擦”(脱甲基酶,包括ALKBH5和FTO),作用机制如图1所示.m6A甲基转移酶,结合蛋白和脱甲基酶可以诱导癌基因转录表达,癌细胞增殖,分化阻滞,侵袭,转移,肿瘤发生和对癌症治疗的抵抗力[21,22].
METTL3可与METTL14、WTAP形成一个稳定的异源二聚体,对哺乳动物的mRNA进行m6A甲基化修饰,这个复合体属于甲基转移酶类m6A调控蛋白[23-27].METTL3和METTL14均有甲基转移酶活性,但METTL14的催化活性要远高于METTL3.尽管单独的METTL3或METTL14在体外表现出相对较弱的催化活性,METTL3-METTL4复合体则具有更高的催化能力.METTL3-METTL4复合体的结构中只有METTL3与SAM结合,而METTL14起着底物识别的结构性作用,因此,异二聚体METTL3-METTL14复合体被认为是m6A甲基转移酶的催化结构域[28].METTL3在催化中起到核心的作用,METTL14则起到支撑METTL3的结构的作用.由METTL3-METTL4复合体介导的mRNA m6A修饰会导致mRNA衰减,降低mRNA稳定性,促进mRNA从细胞核输出到细胞质以及将5-UTR-甲基化的mRNA翻译成蛋白质.敲低METTL3或METTL14会重新调节许多转录本的表达,例如多能性因子Nanog,并损害胚胎干细胞分化[29-33].RNA甲基转移酶还通过调节miRNA表达来调节基因表达,METTL3甲基化pri-miRNA,标记它们以进行识别和加工,并以与细胞类型无关的方式增强整体miRNA的成熟度[34].
GC是消化道最多见的恶性肿瘤,早期发现较为困难,一般在偶然检查中发现,往往已处于晚期,给患者及家属带来巨大的精神和经济压力.GC的发病原因复杂,它的发生、发展是一个由多种癌基因包括原癌和抑癌基因、促凋亡和抑凋亡基因共同参与的多阶段、多途径的过程.从分子水平探讨GC发病机制是近几年来研究的热点之一,基因水平的研究可以为GC的诊断、治疗和预后的判断开辟新的途径[35-38].METTL3介导的m6A修饰存在于GC细胞中,锌指MYM型含1 (zinc finger MYM-type containing 1,ZMYM1)是METTL3的真正m6A靶标.METTL3对ZMYM1 mRNA的m6A修饰依靠“阅读器”蛋白HuR依赖性途径增强了其稳定性.此外,ZMYM1通过募集CtBP/LSD1/CoREST复合物结合并介导E-钙粘蛋白启动子的阻遏,从而促进上皮-间质转化程序和转移.揭示了METTL 3/ZMYM 1/E-钙粘蛋白信号作为抗GC转移策略中的潜在治疗靶点[39].通过shRNA转染敲低了人GC细胞系AGS和MKN45中的METTL3,RT-qPCR分析和蛋白质印迹分别验证了RNA干扰对mRNA和蛋白质水平的有效性,发现METTL3可抑制AGS和MKN45细胞中的细胞增殖,迁移和侵袭.此外,METTL3减少GC细胞中的Bcl2和增加Bax和活性Caspase-3,这表明细胞凋亡途径被激活.机制研究表明METTL3导致人GC细胞中AKT信号通路失活,包括AKT磷酸化水平降低以及下游效应子p70S6K和Cyclin D1的表达.揭示了METTL3的下调会抑制人GC细胞的增殖和迁移,并导致AKT信号通路失活,这表明METTL3可能是治疗人GC的潜在靶标[40-46].研究发现,METTL14mRNA在GC组织中与癌旁组织相比,表达水平显著降低.通过RNAi干扰内源性METTL14表达后,可显著促进GC细胞的增殖、侵袭和迁移.结果说明METTL14可能在GC发生发展过程中起到抑癌基因作用,METTL14的抑癌作用也许能为GC临床分型诊断、治疗方案选择以及衡量愈合提供一个新的生物学标志[47,48].
3 METTL9的分子作用机制及其在GC中的研究进展
METTL9是P53的一个下游基因,METTL9的染色体定位是在16p12-13,由六个外显子和五个内含子组成,METTL9mRNA的开放阅读框在282-1130 bp处,编码序列长度为849 bp.METTL9基因序列能与野生型P53蛋白结合,与突变型P53蛋白几乎不结合.METTL9蛋白为亲水性蛋白,存在一个跨膜区,大约在42-79氨基酸片段,没有信号肽[17,49].METTL9是一种类甲基化转移酶,属于DREVl转甲基酶基因家族,与DREVl基因具有高相似性,而且与野生的P53的内含子区域结合,致使发生高甲基化,导致肿瘤抑制因子等重要基因失活.在该蛋白酶的作用下,可能使DNA的SAM的甲基转移到CpG二核苷酸的胞嘧啶5位碳原子上,生成5-甲基胞嘧啶,最终导致DNA甲基化,引起癌症的发生[6,16].
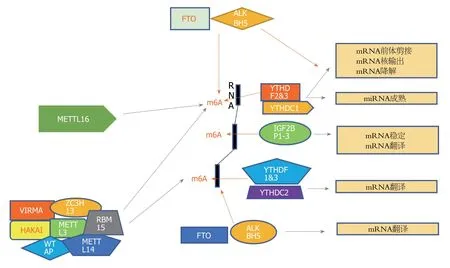
图1 N6-甲基腺苷甲基转移酶,去甲基化酶和结合蛋白的作用机制.橘色箭头表示抑制作用,灰色箭头表示促进作用.
METTL9基因作为P53的一个下游基因在GC组织中高表达,在正常组织中低表达并在GC组织中随组织分化程度减低表达成上升趋势[49].所以,我们可以把METTL9当作肿瘤标记物对肿瘤风险进行评估,进而得到预防策略,对早期诊断及手术方式提供指导.
4 METTL16的分子作用机制及其在GC中的研究进展
METTL16是鉴定出的第二种甲基腺苷(methyladenosine,mA)甲基转移酶,其已知的底物包括U6小核核糖核酸(small nuclear RNA,snRNA)和编码转移相关肺腺癌转录物1 (metastasis-associated lung adenocarcinoma transcript 1,MALAT1)的人MAT2A mRNA[49-51].METTL16在结构上与METTL3类似,但具有一些独特的元素,例如Rossmann折叠中的独特αB螺旋.与METTL3-METTL14复合体相比,全长METTL16形成同型二聚体,一种天然的凝胶位移分析表明METTL16与MALAT1 RNA三螺旋结合.此外,尽管METTL16的结晶部分具有与全长多肽相同的活性,但METTL3-METTL14复合体的催化结构域需要METTL3的N末端CCCH基序才能发挥全部活性,可能需要额外的结构域才能将RNA底物正确定位在METTL3-METTL14复合体的催化腔内,而METTL16的延伸环足以定向其RNA底物以进行mA修饰.因此,尽管METTL3和METTL16的催化活性可能具有相似的结构基础,但由于延伸环的位置和其他RNA结合结构域的存在,导致底物特异性差异很大[52-54].METTL16诱导mRNA的3-UTR以及U6小核RNA的A43中的mA修饰,该碱基在剪接过程中与前mRNA的5个剪接位点碱基配对,这表明METTL16在mRNA稳定性和剪接中起重要作用.有趣的是,一项研究提出了METTL16在mRNA前剪接过程中发挥了额外的作用,使METTL16可以作为无论是mA的“书写器”还是“阅读器”.作为mA的“书写器”,METL16在SAM存在下迅速甲基化MAT2A mRNA,导致内含子保留,然后发生核降解[55,56].当SAM水平低时,MAT2A mRNA上METTL16的长期占据会增强保留内含子的剪接.从大肠杆菌到人均发现METTL16同源物,它们均具有N端甲基转移酶结构域.作为SAM依赖性甲基转移酶,预测METTL16具有高度保守的Rossmann折叠[57].MALAT1核糖核酸三螺旋本身或邻近区域是METTL16的底物.MAT2A保留的内含子的剪接被快速诱导蛋氨酸耗竭后,此效应需要一个保守的发夹(hp1),我们进一步显示了它是METTL16 mA底物.重要的是,敲除METTL16可以消除蛋氨酸缺乏条件下对MAT2A剪接的诱导,同时将METTL16强制结合到MAT2A 3UTR足以在Met充足的条件下促进剪接.我们提出了一个模型,其中MAT2A hp1上的METTL16占用促进了保留的内含子的剪接.在高SAM含量下,METTL16迅速结合,甲基化和解离,有利于内含子保留.在SAM限制条件下,METTL16不能有效地甲基化,这会增加其在hp1上的停留时间并刺激保留的内含子的剪接.我们得出的结论是METTL16是保守的U6 snRNA甲基转移酶,它已经在脊椎动物中进化出了另一种功能,通过转录后调节SAM合成酶基因的表达来控制SAM稳态[58-61].
虽然,目前对于METTL16在GC中的研究还没有相关文献的报道,但是METTL16相关的两个癌基因MAT2A和MALAT1已经被证实与GC的发生发展相关.对癌组织及癌旁组织进行实时荧光定量 PCR与Western blot技术检测,结果显示GC组织中MAT2A mRNA相对表达量明显高于癌旁正常胃组织,表明MAT2A在GC中表达上调[59].MALAT1基因在GC组织中呈高表达,下调MALAT1基因表达可有效抑制GC细胞增殖、迁移和侵袭力,为以MALAT1为靶点的GC基因靶向治疗奠定了基础[55].
5 结论
目前,METTL蛋白家族引起了人们的极大兴趣,因为该蛋白家族被认为涵盖了许多潜在的新型甲基转移酶.但是,对于许多METTL蛋白,尚不清楚它们是否确实是活性酶,以及它们的底物是什么:RNA,DNA或蛋白质.最近发现,在我们研究的酶中,除METTL3-14复合体外,还有METTL7B,METTL8和METTL16等都是RNA甲基转移酶.在过去的几年中,由METTL家族成员催化的新发现、新类型和新的RNA修饰位点的首次功能表征,激发了对该蛋白家族的兴趣.METTL蛋白家族对GC的作用已经有一些研究进展,但调控机制尚不明确,对METTL蛋白家族的深入研究将对GC乃至所有肿瘤的诊疗有极其重要的意义.
