circRNAs在消化系恶性肿瘤中的研究进展
2020-06-12
侯钦,林洁纯,吴灵飞,汕头大学医学院第二附属医院消化内科 广东省汕头市 515041
0 引言
近年,环状RNAs(circular RNAs,circRNAs)在消化系恶性肿瘤中的作用受到广泛关注.有证据显示,circRNAs参与了细胞多种生命活动,并与肿瘤的发生与进展密切相关,本文结合国内外最新报道,对circRNAs在消化系恶性肿瘤中的表达及作用作一综述.
1 circRNAs的产生
1976年,Sanger等[1]利用电子显微镜、超速离心、热变性等方法,首先在植物感染的病毒颗粒中观察到了共价闭合环状RNA分子,并将其命名为环状RNA.它是一类新型的非编码长链RNA,由前体mRNA剪切而成,既无5’端帽子又无3’端poly A尾巴的闭合环状结构,广泛存在于多种真核生物体内,主要位于细胞质或储存于外泌体中,不受RNA外切酶影响,表达稳定且不易降解.大多数circRNAs是由外显子环化而成,也有部分circRNAs是由内含子环化而成的套索结构.Chen等[2]提出circRNAs是由真核生物中数千种基因的前体mRNA反向剪接产生的.根据其前体mRNA的不同,circRNAs可大致分为四类:全外显子型的ecRNA (exonic circRNA)[3]、套索内含子从前体mRNA切除形成的ciRNA(intronic circRNA)[4]、内含子保留的转录本反向剪切后形成的EIciRNA(exon-intron circRNA)[5]以及由病毒RNA基因组、tRNA、rRNA、snRNA等环化产生或人工合成的circRNAs.其中,ecRNA数量最多.2013年Jeck等[6]提出了两种被学术界广泛接受的circRNA环化模型.第一种是套索驱动的环化模型,它是由一个外显子3’端的剪接供体和另一个外显子的5’端剪接受体共价结合,形成含外显子的套索结构,再切除内含子而形成circRNA[7].如果保留了外显子之间的内含子,则更可能形成EIciRNA.第二种是内含子配对驱动的环化模型,它认为其合成是通过环化外显子相邻的两侧内含子的反向互补序列进行碱基配对而形成环状结构,再剪掉内含子,最终形成circRNA.而ciRNA由内含子独立环化而来,其结构的形成依赖于靠近5’剪接位点的富含7个核苷酸GU的元件和靠近分支点的富含11个核苷酸C的元件[4].在反向剪接过程中,富含GU的元件和富含C的元件首先结合在一起形成环形结构,然后通过剪接体将该区域的外显子和内含子切除.
由于circRNAs是由RNA聚合酶II转录,由剪接体产生,并且与经典剪接竞争,因此通过调节顺式剪接因子或改变RNA聚合酶II转录动力学可以改变剪接效率[8].下调剪接调节因子(如SR蛋白SF2)或核心剪接体元件(如snRNP-U1-70K、snRNP-U1-C、Prp8、Slu7、CDC40),可将产物从线性变成circRNAs[9,10].CircRNAs没有自由末端,因此并不是通用经典的RNA降解途径.理论上,circRNAs降解可能由核酸内切酶启动,随后联合外切和内切.MiRNA介导的circRNAs降解是目前研究较为充分的circRNAs降解途径.如miR-671与Cdr1as上有一段序列互补,可触发miRNA介导的Ago2剪切,将环状Cdr1as变为线性RNA,导致其稳定性降低而降解[11].最近的一项研究指出,m6A 修饰亦可促进核酸内切酶的募集并参与circRNAs的降解[12].除此之外,胞吐作用亦可促进circRNAs从细胞中清除[13].鉴于越来越多的证据表明circRNAs是功能分子,它的降解、胞外运输机制势必成为未来研究的重点.
2 circRNAs的结构和功能
circRNAs的结构为环状,它比线性结构的RNA更耐受核酸外切酶降解,且在胞内的半衰期超过48 h,因此能在复杂的细胞内外环境中稳定存在.研究发现,许多circRNAs可稳定存在于唾液和血清外泌体中,这为临床检测提供了方便[14].circRNAs数量繁多,分布广泛,其总数可达线性mRNA的10倍,其中大部分circRNAs在细胞进化过程中表现出很强的保守性.同时circRNAs还具有组织、时序特异性和疾病特异性等特点[6,15],使其有可能成为新的临床诊断和预后判断的分子靶标,为疾病的研究提供理论依据.
目前,circRNAs的作用机制包括充当miRNA海绵[16]、与RNA结合蛋白(RNA binding proteins,RBPs)相互作用[17]、翻译蛋白质[18]、调节转录或剪接[2,19]以及表观遗传学改变[20]等.目前研究最多的是circRNAs作为miRNAs功能的调节因子.研究表明某些circRNAs含有许多miRNAs结合位点,可通过选择性吸附而调节miRNAs水平和/或活性[21].另外,由于circRNAs能长时间存在且与RBPs结合,可充当这些因子的诱饵或转运子.在某些情况下,circRNAs和宿主基因蛋白还可直接或间接地进行交互作用[22].此外,还有circRNAs可被翻译的研究报道[23-25].有趣的是,可翻译的circRNAs趋向于使用与宿主基因同样的起始密码子,并有一个进化保守的终止密码子,这是环形开放阅读框架所独有的.Pamudurti等[24]还发现某些可翻译的circRNAs具有内部核糖体进入位点,能够在体内和体外以不依赖帽的方式翻译.据报道,一些circRNAs可通过与RNA聚合酶II复合体结合并翻译相关蛋白来调节基因转录[2],也参与选择性剪接的调控[19].近年研究还发现,circRNAs不仅在多种组织生理过程中发挥作用,如影响胰岛素分泌[26]及组织发育[27]等;而且在疾病病理过程中亦发挥重要作用,如在神经系统疾病[28],心血管疾病[29],退化性疾病[30]和肿瘤[31]等均出现多种circRNAs的表达异常.
3 circRNAs在消化系恶性肿瘤中的作用
随着对circRNAs结构和功能研究的深入,circRNAs在消化系恶性肿瘤中的作用越来越受到重视,下表总结了近年在消化系恶性肿瘤中一些新发现的circRNAs及其可能的调节机制(表1).
3.1 肝癌 肝癌在世界范围内的发病率和死亡率都较高[32].肝细胞癌(hepatocellular carcinoma,HCC)是常见的肝脏恶性肿瘤类型,占原发性肝癌的 90%.中国HCC患病率高,具有恶性程度高、易发生血道转移、早期诊断率低等特点.越来越多的证据表明,circRNAs在HCC发生、发展中发挥着重要的作用.
3.1.1 高表达的circRNAs:Hu等[33]研究证实,circASAP1与肝癌切除术后肺转移密切相关,它可通过竞争性内源RNA(competing endogenous RNAs,ceRNA)机制竞争性结合miR-326和miR-532-5p,一方面上调MAPK1的表达促进肿瘤的增殖和侵袭,另一方面又通过调节CSF-1的表达促进肿瘤相关巨噬细胞浸润,改变肿瘤生长、侵袭的微环境.Wei等[34]发现在HCC的早期阶段circ-CDYL明显上调,并证实circ-CDYL可分别充当miR-892a和miR-328-3p的分子海绵,通过ceRNA竞争性机制活化miR-892a/HDGF/PI3K/AKT途径及miR-328-3p/HIF1AN/NOTCH2通路抑制肿瘤的干性及增殖.此外,他们通过受试者工作特性(receiver operating characteristic,ROC)曲线分析发现,相比于单因素评估,将circ-CDYL、HDGF和HIF1AN联合应用时,曲线下面积(area under the curve,AUC)提高到0.73,其敏感性和特异性分别为75.36%、66.67%,对肝癌的早期诊断效率优于AFP (AUC=0.59).Xiao等[35]研究发现,雌激素受体α (estrogen receptor α,ERα)在HCC组织中表达下调,其表达与circ-SMG1.72呈负相关,进一步研究发现,ERα可与宿主基因SMG的启动子直接结合,通过转录调控来抑制circ-SMG1.72的表达.高表达的circ-SMG1.72通过竞争性结合miR-141-3p来上调GSN,从而促进HCC细胞侵袭.因此,靶向ERα可以通过改变ERα/circRNA-SMG1.72/miR-141-3p/GSN信号转导来抑制HCC侵袭转移.
另有报道,一些circRNAs可通过与特定蛋白质相互作用而影响肿瘤生长.circRHOT1主要定位于细胞核,在HCC组织中高表达,可通过激活Tip60上调NR2F6表达而促进HCC细胞增殖、侵袭和迁移,并与HCC预后不良相关,因而circRHOT1可能成为评估HCC患者预后的潜在指标.值得注意的是,在HCC患者中抑制circRHOT1较为困难,作者认为药理学上将抑制NR2F6作为治疗靶点可能更有前景[36].虽然大多数circRNAs被归类为非编码RNA,但有些仍具有编码能力.Liang等[37]筛选出源自β-catenin基因位点的circ-0004194 (称为circβ-catenin)进行研究,发现它在大多数肝癌细胞系中高表达,它可翻译出新型β-catenin异构体,该异构体通过拮抗GSK3β而诱导β-catenin磷酸化和降解,导致Wnt/β-catenin信号通路激活,从而促进肿瘤细胞的增殖、侵袭及迁移.
3.1.2 低表达的circRNAs:Yu等[38]对5对肝癌组织以及相应的癌旁组织进行RNA测序,发现HCC组织中cSMARCA5的表达明显下调,其低表达预示着侵袭性临床病理特征和预后不良.cSMARCA5的表达受DHX9的调控,它可通过海绵样吸附miR-17-3p和miR-181b-5p来调节TIMP3的表达,从而抑制HCC的生长和转移.Zhang等[39]研究发现circTRIM33-12在肝癌组织和细胞系中的表达明显下调,其低表达与患者不良预后呈负相关.circTRIM33-12可通过ceRNA机制竞争性结合miR-191来调控TET1诱导的DNA去甲基化,从而抑制HCC细胞的增殖、侵袭和免疫逃逸.因此,circTRIM33-12/miR-191/TET1联合检测作为HCC潜在的预后生物标志物可能具有实用价值.Xu等[40]通过微阵列分析及qRTPCR检测发现circSETD3是HCC的抑制因子,它通过靶向作用miR-421/MAPK14信号通路抑制HCC细胞的增
殖、侵袭及迁移,并可作为HCC根治性肝切除术后判断预后的“Biomarker”.也有一些研究报道了circRNAs通过与RBPs相互作用来发挥作用.Zhu等[41]通过HCC组织微阵列分析发现circZKSCAN1在HCC中表达下调,其表达受QKI5的调控.作者还揭示了circZKSCAN1在HCC肿瘤干细胞中的作用机制.他们利用生物信息学分析预测出可能与其结合的10个RBPs,进一步实验证实circZKSCAN1可竞争性结合其中的FMRP,通过阻断FMRP与靶基因CCAR1的结合,使Wnt/β-catenin信号通路失活,进而抑制HCC肿瘤干细胞的恶性特征.有趣的是,Li等[42]研究发现,肝癌中circRNAs的下调与RNA剪接因子NUDT21的下调有关,NUDT21的缺失阻止了含有UGUA序列的circRNAs环化,使circRNAs无法竞争性结合miRNAs,从而下调了抑癌基因的表达,导致肿瘤细胞增殖失控.
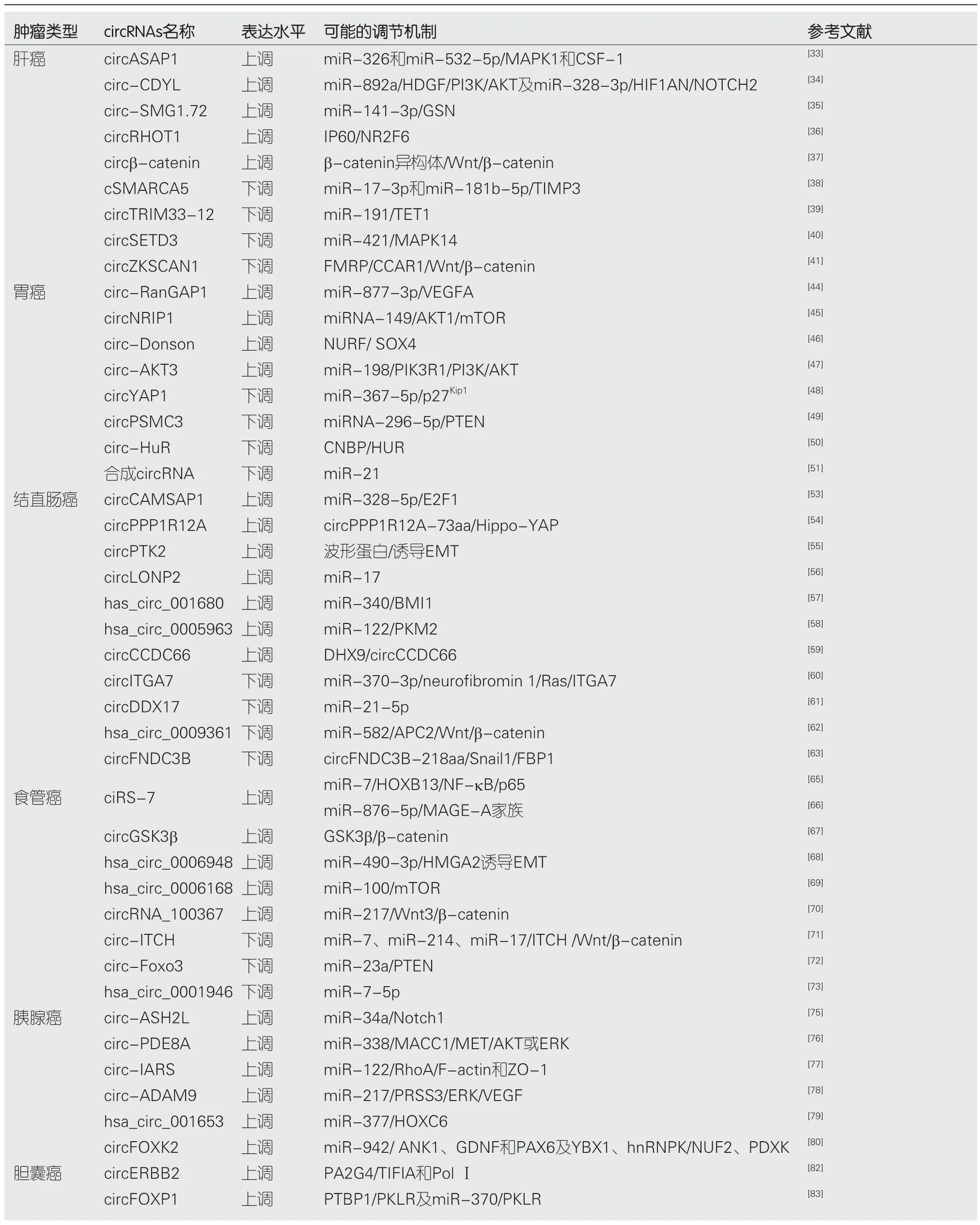
表1 circRNAs在消化系恶性肿瘤中的表达水平及可能的调节机制
3.2 胃癌 胃癌(gastric cancer,GC)在全球的发病率居高不下,尽管在诊断方法和治疗方面已取得了许多进步,但在大多数国家进展期GC的5年总生存率仍不到30%[43].而早期GC治疗后5年生存率可超过90%,甚至达到治愈效果.目前我国早期GC的诊治率低于10%,远低于日本(70%)和韩国(50%).因此,在自然人群中推行早期GC筛查措施和高危人群进行内镜精查策略,是改变我国目前GC诊治严峻现状的有效途径.
3.2.1 高表达的circRNAs:Lu等[44]发现在GC组织中circ-RanGAP1表达显著上调,过表达的circ-RanGAP1可促进体外GC细胞的侵袭、迁移和体内肿瘤的生长,且与TNM分期、淋巴结转移及生存率密切相关.作者进一步探究发现circ-RanGAP1可通过充当miR-877-3p的海绵来上调VEGFA的表达,从而促进GC细胞的侵袭和迁移.此外,他们还发现术前GC患者血浆外泌体中circ-RanGAP1表达上调,这些外泌体中的circ-RanGAP1可增强GC细胞的迁移和侵袭能力.Zhang等[45]研究发现,在GC组织中circNRIP1的表达明显上调,其表达受到RNA结合蛋白QKI的调控.他们通过实验证实敲低circNRIP1可抑制GC细胞的增殖、迁移、侵袭和AKT1的表达水平.circNRIP1可竞争性吸附miR-149-5p,活化下游的AKT1/mTOR通路而促进GC的进展.circNRIP1还可通过GC细胞之间的外泌体进行信号传播,并在体内促进上皮-间充质转化(epithelial mesenchymal transition,EMT)及肿瘤转移.Ding等[46]发现circ-Donson在GC组织及细胞系中表达上调,其高表达与TNM分期和淋巴结转移正相关.进一步研究发现,circ-Donson位于细胞核,可通过与NURF复合体的SNF2L亚基直接作用,将NURF复合体募集到SOX4启动子并启动其转录,最终促进GC细胞生长.新近一些报道指出,circRNAs还参与了GC化疗耐药的调控,Huang等[47]发现在顺铂耐药的GC组织和细胞中,circAKT3的表达均高于顺铂敏感组.在基于顺铂的标准方案治疗的GC患者中,circAKT3的上调与肿瘤大小、组织学分级、临床TNM分期和顺铂耐药呈正相关,并且是无病生存期(disease-free survival,DFS)的独立危险因素.在体及离体实验均证实circAKT3通过ceRNA机制海绵样吸附miR-198来促进PIK3R1表达,激活GC细胞中的PI3K/AKT信号通路,从而促进DNA损伤修复并抑制GC细胞的凋亡,表明circAKT3可能成为顺铂耐药GC患者的潜在治疗靶标.
3.2.2 低表达的circRNAs:Liu等[48]通过qRT-PCR检测17例GC组织和相应的癌旁正常组织中circYAP1表达水平,结果表明circYAP1在GC组织中表达水平显著低于癌旁正常组织.进一步研究发现circYAP1可与miR-367-5p结合,拮抗miR-367-5p对p27Kip1的下调,从而抑制GC细胞的增殖和侵袭.此外,他们还发现circYAP1高表达的GC患者生存期更长且对化疗更敏感,表明circYAP1亦可作为GC的“Biomarker”来判断患者的预后.Rong等[49]通过基因芯片技术对10例GC患者的血浆样品进行了circRNA微阵列分析,发现circPSMC3在GC患者血浆中显著下调且与不良预后相关.同时他们通过生物信息学分析及荧光素酶报告实验证实circPSMC3通过ceRNA机制吸附miR-296-5p来上调PTEN的表达,从而抑制GC的增殖和侵袭,裸鼠实验亦证实circ-PSMC3可抑制GC的生长和转移.Yang等[50]发现circ-HuR在GC组织和细胞系中表达下调.过表达circ-HuR在体外和体内均抑制GC细胞的生长.作者观察到circ-HuR可与CNBP相互作用,抑制其与HUR启动子结合,下调HUR的表达并抑制GC细胞生长和侵袭.有趣的是,不仅天然存在的circRNAs影响肿瘤的生长,某些人工合成的circRNAs也被证明可参与肿瘤生长的调控.miR-21是一种抗凋亡因子,在多种肿瘤中高表达,可促进肿瘤细胞增殖并抑制凋亡.Liu等[51]在体外巧妙设计出一种包含多个凸起miR-21结合位点的合成circRNA,通过荧光素酶报告基因实验等方法,证实这种合成的circRNA同样可以海绵样方式吸附miR-21并抑制其活性,阻止癌蛋白DAXX表达从而达到抑制GC细胞增殖的目的,这种采用人工合成或载体表达的外源性“miRNA海绵”的治疗策略为circRNAs的临床应用开辟了一条新途径.
3.3 结直肠癌 结直肠癌(colorectal cancer,CRC)是世界上最常见的恶性肿瘤之一,近年来,尽管内镜诊疗技术有所进步,但我国结直肠癌发病率仍呈上升趋势,特别是伴有转移的中晚期患者,预后仍差[52].
3.3.1 高表达的circRNAs:Zhou等[53]研究发现,在CRC组织中circCAMSAP1的表达显著上调,并且与患者的生存率呈负相关.circCAMSAP1可作为竞争性内源RNA,与miR-328-5p结合,上调E2F1的表达,从而促进CRC细胞的增殖、侵袭和迁移.在CRC患者术前血清中亦检测到circCAMSAP1表达水平升高,提示CRC细胞很有可能通过外泌体将其转运至血清中,参与肿瘤的进展.据报道,circPPP1R12A是第一个在结肠癌(colon cancer,CC)中发现的编码小蛋白质的真核生物circRNA[54].circPPP1R12A在CC组织中的表达明显上调,在促进CC细胞的增殖、迁移和侵袭方面发挥了关键作用.circPPP1R12A带有一个开放阅读框,可编码一种功能蛋白circPPP1R12A-73aa,该蛋白通过激活Hippo-YAP信号通路在体内外均能促进肿瘤的生长和转移.Yang等[55]通过使用circRNA微阵列分析证实circPTK2在CRC组织中高表达,并与CRC细胞的增殖、侵袭和迁移呈正相关.进一步研究发现,circPTK2通过与波形蛋白磷酸化位点Ser38、Ser55和Ser82物理结合,促进波形蛋白表达,从而介导EMT,促进CRC进展和转移.因此,circPTK2可作为CRC转移的潜在治疗靶点及判断肿瘤转移的潜在生物标志物.Han等[56]观察到circLONP2 (hsa_circ_0008558)在转移性的原发CRC组织中以及沿转移部位的浸润边缘呈异常高表达,并且与患者不良预后相关.研究表明,circLONP2可增强体外CRC细胞的侵袭性,而靶向circLONP2的反义寡核苷酸则可降低其体内移植瘤的侵袭.circLONP2定位于细胞核,其表达受原癌基因FUS的正性调控,以DDX1依赖性的方式募集DGCR8和Drosha复合物,与pri-miR-17直接相互作用并促进其加工生产,成熟的miR-17-5p组装到外泌体中被邻近肿瘤细胞摄取而增强其侵袭性.作者认为,circLONP2通过调节miR-17的细胞内成熟和细胞间转移,在CRC发展过程中充当了关键的转移起始分子,在肿瘤侵袭及转移过程中发挥了重要作用.CircLONP2可作为CRC治疗的有效预后指标或新型抗转移治疗靶标.
CircRNAs不仅影响CRC的生长及进展,在调控化疗耐药方面也发挥重要作用.Jian等[57]研究发现,has_circ_001680可通过ceRNA机制竞争性结合miR-340,上调BMI1的表达,从而促进肿瘤干细胞增殖,并诱导伊立替康耐药.另一项研究报道,hsa_circ_0005963 (亦称ciRS-122)在奥沙利铂耐药细胞的外泌体中明显上调[58].外泌体将ciRS-122传递至周边敏感细胞,通过竞争性结合miR-122而促进PKM2表达,加速糖酵解并诱发奥沙利铂耐药.这种通过外泌体进行细胞间分子信号传递的机制为研究肿瘤耐药提供了新思路.Lin等[59]研究发现,在奥沙利铂耐药的CRC细胞中circCCDC66表达上调,其机制与奥沙利铂通过PI3KK介导的DHX9磷酸化有关.上调的circCCDC66可促进肿瘤细胞增殖并抑制凋亡,从而增强化疗耐药.
3.3.2 低表达的circRNAs:Li等[60]发现circITGA7及其线性宿主基因ITGA7在CRC组织和细胞系中均显著下调.作者证实敲除circITGA7或ITGA7可促进CRC细胞在体外的增殖和迁移,并促进肿瘤在体内的生长.他们发现circITGA7可与miR-370-3p通过竞争性结合,使neurofibromin 1的表达上调,通过抑制Ras信号通路和促进ITGA7的转录来发挥抑癌作用.Li等[61]通过高通量测序技术和qRT-PCR检测发现circDDX17在CRC组织中表达明显下调,其低表达与淋巴血管浸润、淋巴结转移、远处转移、TNM分期密切相关.生物信息学分析表明它可能通过与miR-21-5p结合来发挥抑癌作用.Geng等[62]发现hsa_circ_0009361在CRC组织和细胞中显著下调,其低表达可促进CRC细胞增殖、迁移及侵袭,并诱导EMT.同时研究还发现hsa_circ_0009361可通过与miR-582竞争性结合促进APC2表达,阻滞Wnt/β-catenin信号通路并最终抑制CRC的恶性表型.有趣的是,Pan等[63]研究发现,circFNDC3B在结肠癌肿瘤组织中表达下调,它可编码一种新型蛋白质circFNDC3B-218aa,该蛋白可通过下调Snail1而促进FBP1的表达,进而抑制EMT,阻止肿瘤细胞增殖、侵袭和生长.
3.4 食管癌 食管癌是全世界癌症死亡的第六大主要原因,包括食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌二大类,其中ESCC是我国最常见的食管癌类型,占全球食管癌病例的70%[64].食管癌发病率具有明显的地理分布差异,在东亚、东非、南非以及南欧等地区的发病率较高.大部分食管癌早期临床症状不明显,就诊时多已进展为中晚期.目前临床上治疗以手术、放化疗为主,但效果不尽人意,进展期食管癌5年生存率不足30%.研究报道circRNAs在ESCC中扮演着十分重要的角色.
3.4.1 高表达的circRNAs:ciRS-7作为一种经典的circRNA,在多种肿瘤中均发挥重要作用.Li等[65]发现在ESCC组织和细胞系中ciRS-7均明显上调,其高表达与ESCC患者的TNM分期呈正相关.Kaplan-Meier分析表明高表达ciRS-7的ESCC患者的总生存期(overall survival,OS)和DFS更短.作者通过实验证明ciRS-7的过表达可减弱miR-7的肿瘤抑制作用,促进ESCC恶性进程,进一步研究揭示了ciRS-7/miR-7/HOXB13/NF-κB轴在ESCC中的关键作用.有趣的是,在另一项研究中,Sang等[66]发现ciRS-7具有19个miR-876-5p结合位点,ciRS-7通过海绵样吸附miR-876-5p,来上调MAGE-A家族表达,以促进ESCC细胞的增殖、迁移和侵袭.Hu等[67]对50例ESCC组织及其邻近的正常组织进qRT-PCR测定,发现circGSK3β在ESCC的各阶段均表达上调.circGSK3β通过与GSK3β直接作用,保护β-catenin免受GSK3β磷酸化,从而激活β-catenin,并促进ESCC细胞的转移和侵袭.有趣的是,作者研究证实:与CEA相比,circGSK3β的特异性虽低,但敏感性更高,而二者的联合检测在ESCC早期可大大提高诊断的灵敏性.Pan等[68]通过circRNA微阵列分析,发现在ESCC组织和细胞中hsa_circ_0006948表达上调,其过表达在体内外均可诱导肿瘤生长,同时还与淋巴转移和不良预后呈正相关.进一步研究表明,hsa_circ_0006948可通过海绵样吸附miR-490-3p,增强靶基因HMGA2的表达并诱导EMT.Shi等[69]发现hsa_circ_0006168在ESCC组织及细胞系中均显著增加,其高表达与ESCC患者的淋巴结转移和TNM分期正相关.机制研究表明,hsa_circ_0006168可作为诱饵吸附miR-100导致mTOR表达上调,从而促进ESCC增殖、迁移和侵袭.
研究表明circRNAs的异常表达还与肿瘤的放射敏感性相关.Su等[70]通过circRNA芯片技术在不同的食管癌细胞系中选择了74种差异表达的circRNAs并进行分析,发现具有放射抗性的KYSE-150/KYSE-150R细胞中circRNA_100367表达上调幅度最大.进一步研究发现circRNA_100367可通过ceRNA 机制与miR-217竞争结合以上调Wnt3的表达,并激活Wnt/β-catenin通路,从而降低了食管癌KYSE-150R细胞的放射敏感性.
3.4.2 低表达的circRNAs:Li等[71]通过qRT-PCR对684例ESCC组织及其对应的癌旁组织进行检测,发现circ-ITCH在癌组织中表达显著低于癌旁组织.进一步研究表明,circ-ITCH可竞争性吸附miR-7、miR-214、miR-17致使ITCH基因表达上调,促进Dv12蛋白的泛素化与降解,调控Wnt/β-catenin信号通路而抑制ESCC的发生、发展.Xing等[72]发现circ-Foxo3在ESCC组织和细胞系中均呈低表达,过表达circ-Foxo3可抑制癌细胞的增殖,使细胞阻滞在G1期并诱导凋亡.机制研究表明,circ-Foxo3可通过调节miR-23a/PTEN轴来发挥抑癌作用.Fan等[73]通过对3例ESCC组织和对应的正常组织进行circRNA微阵列分析,发现1045个上调和1032个下调的circRNAs,其中6个circRNAs经临床标本qRT-PCR验证,结果证实与组织芯片结果相一致;另外3个circRNAs可在血浆中检测到.作者通过对50例ESCC患者术前血浆与50例健康人血浆进行分析及比对,发现hsa_circ_0001946在ESCC患者血浆中表达下调.他们通过ROC曲线评估得出其AUC=0.894,敏感度为92%,特异度为80%,表明血液检测hsa_circ_0001946可作为诊断ESCC的分子“Biomarker”.Kaplan-Meier分析结果表明,低表达hsa_circ_0001946的ESCC患者OS更短、预后更差.作者还通过生物信息学分析技术预测了hsa_circ_0001946可能通过靶向结合miRNA-7-5p参与食管癌细胞增殖和侵袭的调控,但具体机制仍需进一步研究.
3.5 胰腺癌 胰腺癌(pancreatic carcinoma,PC)是一种相对罕见的消化系恶性肿瘤,其发病率和死亡率呈逐年上升趋势[74].PC恶性程度极高,其5年生存率不到5%.
Chen等[75]通过实验证实circ-ASH2L在胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)细胞及肿瘤组织中呈高表达,其表达与淋巴管浸润和TNM分期有关.多因素分析表明circ-ASH2L高表达是影响PDAC患者OS的独立危险因素.作者还通过qRT-PCR和双荧光素酶报告基因实验证实circ-ASH2L可通过ceRNA机制竞争性结合miR-34a以上调Notch1表达,从而促进肿瘤的侵袭、增殖和血管生成.Li等[76]通过微阵列分析及qRT-PCR检测发现circ-PDE8A在PC组织中表达上调,其高表达与淋巴结浸润、TNM分期及低生存率密切相关.作者进一步研究发现circ-PDE8A可通过ceRNA机制竞争性结合miR-338,上调MACC1的表达,并激活MET/AKT或ERK信号通路而促进PC细胞的增殖、侵袭和EMT.此外,他们还发现高度恶性的肿瘤细胞可分泌含有circ-PDE8A的外泌体进入低度恶性的细胞以及血液循环,从而促进肿瘤的侵袭与进展.Li等[77]通过qRTPCR检测证实circ-IARS在PC组织及血浆外泌体中均呈高表达,其表达水平与血管浸润、肝转移和TNM分期呈正相关.作者进一步研究发现circ-IARS通过外泌体转运进入人微血管内皮细胞,通过海绵样吸附miR-122以增强RhoA活性,从而上调F-actin表达以促进内皮细胞收缩,并下调ZO-1表达以破坏内皮细胞间的紧密连接,最终增加了毛细血管的通透性,促进肿瘤的侵袭与转移.Xing等[78]发现在PC组织和细胞系中circ-ADAM9表达升高,而miR-217表达降低,二者均与TNM分期和淋巴结转移密切相关.作者通过裸鼠实验发现沉默circ-ADAM9或过表达miR-217均可明显抑制肿瘤生长,并且二者共同作用具有累加效应.进一步研究表明,circ-ADAM9能够通过ceRNA机制吸附miR-217,减少其对PRSS3的抑制作用,从而激活ERK/VEGF信号通路,促进PC进展.Zhang等[79]发现hsa_circ_001653在PDAC组织中高表达,它可竞争性结合miR-377,上调HOXC6的表达,从而促进PDAC细胞增殖.有趣的是,新近的一项研究表明,circRNAs可通过多种途径起作用.Wong等[80]发现circFOXK2在PDAC中高表达.CircFOXK2一方面作为分子诱饵吸附miR-942,解除其对下游靶标的抑制,促进ANK1、GDNF和PAX6表达;另一方面又与RNA结合蛋白YBX1和hnRNPK相互作用,增强癌基因NUF2和PDXK的表达,二者共同作用的结果促进了PC细胞的生长、侵袭和转移.3.6 胆囊癌 胆囊癌(gallbladder cancer,GBC)是最常见的胆道上皮恶性肿瘤,其恶性程度高,且较晚出现临床症状[81].手术切除可以使早期患者获得根治,但对晚期GBC患者仍缺乏有效的治疗方法.目前关于GBC与circRNAs的研究不多,但意义不容忽视.
Huang等[82]研究证实发现,circERBB2在GBC组织中的表达上调,其高表达与GBC患者预后差密切相关.他们还发现,不同于miRNA海绵,过表达的circERBB2在核仁中富集,通过调控PA2G4的核仁定位,增强TIFIA与PolI之间相互作用来调控核糖体DNA的转录和GBC细胞增殖.Wang等[83]通过对GBC组织和相应的癌旁组织进行RNA序列分析,发现circFOXP1(hsa_circ_0008234)在GBC组织中表达明显上调,其高表达与淋巴结转移、TNM分期及预后不良呈正相关.研究表明circFOXP1通过促进RNA结合蛋白PTBP1从细胞核到细胞质的易位,上调PKLR的表达并增强其稳定性,从而促进Warburg效应,导致GBC细胞恶性增生.此外,他们还证实circFOXP1可通过海绵样吸附miR-370上调PKLR的表达,促进肿瘤的发生与发展.
4 结论
circRNAs具有种类丰富、结构稳定、高度保守性、组织特异性及时序特异性等特征,近年来,作为非编码RNA家族中的一个新研究热点,其在消化系恶性肿瘤中的作用已得到越来越多研究的证实.但目前circRNAs仅有通过ceRNA机制充当miRNA海绵发挥作用这一功能相对明确,其它的直接作用及间接调控机制我们仍知之甚少,对其具体的生物学功能及作用我们的认识仍十分有限,相信在未来,随着高通量测序技术和生物信息学技术的进步,circRNAs作为消化系恶性肿瘤诊断及预后的“Biomarker”和新治疗靶点将发挥越来越重要的作用.
