生存素对3T3-L1脂肪细胞中载脂蛋白E表达和分泌的影响
2020-06-11陈树青米日阿依阿里木江白宁宁杨颖马晓静
陈树青, 米日阿依·阿里木江, 白宁宁, 杨颖, 马晓静
(上海交通大学附属第六人民医院内分泌代谢科, 上海 200233)
生存素(Survivin)是凋亡抑制蛋白家族成员,特异且大量表达于胚胎组织及人类肿瘤细胞,在终末分化的细胞中几乎不表达[1-2]。我们前期研究[3]结果表明高脂饮食可诱导Survivin在内脏脂肪组织脂肪细胞中重新表达,同时细胞研究表明Survivin参与调节3T3-L1脂肪细胞脂质代谢,并且不影响脂肪细胞分化。载脂蛋白E(ApoE)是与肥胖密切相关的重要脂质转运蛋白,广泛表达于多种组织细胞。血浆内的ApoE主要由肝脏合成,同时它在脂肪组织中也高度表达,并且大量研究证明脂肪产生的内源性ApoE同样发挥调节脂肪细胞脂质储存的重要作用[4-7]。但现阶段有关脂肪细胞来源的ApoE表达调控方面的研究尚不多见。本研究采用携带Survivin载体及对照空载体的慢病毒感染3T3-L1脂肪细胞株,探讨Survivin在脂肪细胞中的功能以及对ApoE的调节作用,为改善脂质代谢及肥胖提供一种新的研究思路。
1 材料与方法
1.1 主要材料
小鼠3T3-L1细胞系(ATCC细胞库);Survivin过表达慢病毒(上海吉玛公司);DMEM高糖培养基、胎牛血清(美国Gibco公司);重组人胰岛素(美国Lilly公司);地塞米松、3-异丁基-1-甲基黄嘌呤(IBMX)、二甲基亚砜(DMSO)为美国Sigma 公司产品; Trizol试剂(美国Invitrogen公司);PCR引物(上海生物工程有限公司);逆转录、qRT-PCR试剂盒(日本TaKaRa公司);细胞蛋白裂解液(RIPA)、苯甲基磺酰氟(PMSF)、BCA法蛋白定量试剂盒(上海碧云天公司);APOE抗体(美国Santa公司);Survivin抗体,抗兔、抗鼠荧光二抗(美国CST公司); ECL化学发光显影液(美国Milipore公司)。
1.2 3T3-L1脂肪细胞的培养及诱导分化
将3T3-L1前脂肪细胞均匀接种于12孔板,用含10%胎牛血清的高糖DMEM培养液,在37℃、5%CO2的条件下培养。待细胞生长融合后,先以10 μg/mL重组人胰岛素、0.5 mmol/L IBMX、1 μmol/L地塞米松、含10%胎牛血清的高糖DMEM培养液诱导2 d,再单独以10 μg/mL胰岛素诱导2 d后,换用含10%胎牛血清的高糖DMEM 培养基,每2 d换1次培养液。诱导分化8~10 d后,3T3-L1脂肪细胞分化率达到90%以上可用于实验。
1.3 慢病毒感染
3T3-L1前脂肪细胞接种于12孔板,当每孔密度达到30%~40%时, 含小鼠源Survivin表达载体的慢病毒或对照病毒以感染复数(MOI)为20用于感染细胞,感染48 h后进行细胞换液。感染效率由48 h后绿色荧光蛋白阳性细胞的数目决定,并以带有绿色荧光蛋白的慢病毒作对照。将细胞传代向白色脂肪细胞方向分化,用于随后的实验。通过qRT-PCR和蛋白质印迹检测Survivin表达。
1.4 3T3-L1脂肪细胞的转录组分析
对感染Survivin过表达慢病毒以及对照病毒的3T3-L1前脂肪细胞进行培养,并分化至第8天。使用TruSeq RNA样品制备试剂盒(美国Illumina公司),按照提供的指南合成配对末端文库。在上海伯豪生物技术有限公司进行文库构建以及高通量测序工作。测序得到的数据序列中除去冗余数据,在上海烈冰信息科技有限公司进行数列分析以及生物信息数据分析。
1.5 qPT-PCR检测ApoE、Survivin等基因的mRNA表达水平
使用Trizol试剂抽提脂肪细胞mRNA,逆转录合成cDNA,10倍稀释后作为模板,采用qPT-PCR检测基因mRNA表达。ApoE引物序列:上游5′-CTGACAGGATGCCTAGCCG-3′ ,下游5′-CGCAGGTAATCCCAGAAGC-3′;Survivin引物序列:上游5′-GAGGCTGGCTTCATCCACTG-3′,下游5′-CTTTTTGCTTGTTGTTGGTCTCC-3′; 核糖体蛋白基因(36B4)引物序列:上游5′-AAGCGCGTCCTGGCATTGTCT-3′,下游5′-CCGCAGGGGCAGCAGTGGT-3′; 脂肪酸结合蛋白4(Fabp4)引物序列:上游5′ -AAGGTGAAGAGCATCATAACCCT-3′,下游5′-TCACGCCTTTCATAACACATTCC-3′。以36B4作为内参基因,计算2-ΔΔCt值比较基因相对表达量。
1.6 蛋白质印迹检测3T3-L1细胞及培养上清液中APOE的蛋白表达
在脂肪细胞分化第8天经换液24 h后收取细胞培养上清液并收取细胞,分别提取蛋白,避免冻融循环,冻存于-80 ℃冰箱。按每泳道加20 μg蛋白或者30 μL细胞培养上清液样品进行SDS-PAGE,100 V、50 min恒压湿转至硝酸纤维素膜(0.2 μm),室温封闭1 h,一抗(内参β-肌动蛋白1 ∶1 000,APOE 1 ∶500,Survivin 1 ∶500稀释)4℃孵育过夜,二抗(1 ∶2 000稀释)室温孵育l h并洗脱,经Image Quant凝胶成像系统曝光显像并拍照。
1.7 定量和统计分析
使用Image J图像分析软件测定凝胶电泳条带的灰度,比较蛋白相对表达量。应用SPSS 19.0软件进行数据处理,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Survivin过表达对3T3-L1脂肪细胞载脂蛋白家族分泌的影响
慢病毒感染3T3-L1前脂肪细胞进行分化培养至第8天时,qRT-PCR和蛋白质印迹结果显示,与对照组相比,过表达组3T3-L1脂肪细胞中Survivin的mRNA(t=11.71,P<0.01)及蛋白表达明显增高,见图1。同时脂肪分化标志物Fabp4 mRNA相对表达水平在过表达组和对照组间的差异无统计学意义(t=1.064,P>0.05),说明Survivin过表达对3T3-L1脂肪细胞分化没有影响,见图2。在细胞分化第8天时进行RNA测序,对RNA转录组分析数据库中载脂蛋白家族30个蛋白进行分析,选取其中较高表达量(基因表达丰度FPKM>1)的10个基因作热图,热图显示Survivin过表达能够在转录水平特异性下调3T3-L1脂肪细胞ApoE表达,同时其他载脂蛋白表达没有发生明显变化,见图3。
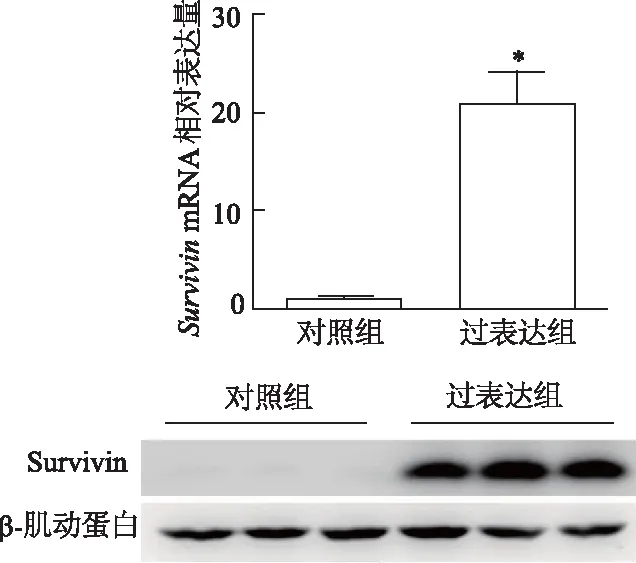
*:P<0.01,与对照组比较图1 两组3T3-L1脂肪细胞Survivin mRNA和蛋白相对表达量

图2 两组3T3-L1脂肪细胞脂肪分化标志基因Fabp4 mRNA相对表达量

*:P<0.05,与对照组比较图3 转录组分析数据库两组间各载脂蛋白相对表达量
2.2 Survivin对3T3-L1脂肪细胞ApoE mRNA表达水平的影响
qRT-PCR结果显示,过表达组ApoEmRNA较对照组明显下调,降低了32%(t=9.676,P<0.01),见图4。结果表明Survivin能够在转录水平下调3T3-L1脂肪细胞ApoE的表达。
2.3 Survivin对3T3-L1脂肪细胞APOE蛋白表达的影响
蛋白质印迹结果显示,在3T3-L1脂肪细胞胞内,过表达组APOE蛋白表达较对照组明显下调(t=4.183,P<0.05),见图5。收集分化至第8天的3T3-L1脂肪细胞培养上清液,检测到细胞分泌的APOE蛋白同样明显下调(t=5.683,P<0.01),见图6。结果表明过表达Survivin能够抑制3T3-L1脂肪细胞中APOE蛋白的表达及分泌。

*:P<0.01,与对照组比较图4 两组3T3-L1脂肪细胞ApoE mRNA相对表达量
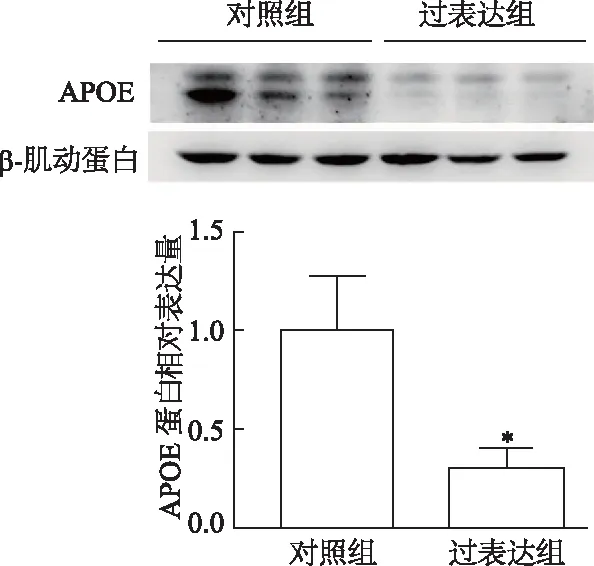
*:P<0.05,与对照组比较图5 两组3T3-L1脂肪细胞胞内APOE蛋白表达
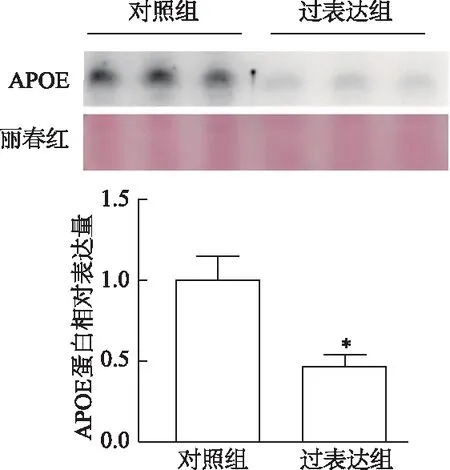
*:P<0.01,与对照组比较图6 两组3T3-L1脂肪细胞培养上清液中APOE蛋白表达
3 讨论
在营养过剩的条件下,脂肪组织可以通过脂肪细胞肥大及增生进行能量储存,从而防止脂毒性等代谢异常[8]。近年来脂肪组织被定义为一种代谢活跃的内分泌器官,调节营养代谢的稳态。包括载脂蛋白家族在内的多种脂肪细胞分泌的蛋白,能通过介导一系列的信号转导通路,广泛参与机体复杂的代谢平衡网络的调节[9]。脂肪分泌蛋白的表达失衡会引起机体代谢紊乱等一系列反应,进而在肥胖等多种病理过程中产生影响。ApoE是脂质及脂蛋白转运系统的主要蛋白质,它是极低密度脂蛋白、残留脂蛋白和高密度脂蛋白的主要成分,主要参与膳食脂质的代谢及体内平衡,并从循环中去除动脉粥样硬化相关脂蛋白。我们前期研究表明高脂饮食可诱导Survivin在内脏脂肪重新表达,Survivin参与调节3T3-L1脂肪细胞脂质代谢[3]。为研究Survivin是否对载脂蛋白家族具有调控作用,我们对脂肪细胞过表达Survivin后载脂蛋白的变化做了进一步检测。
Survivin是癌症进展中的关键因子,目前已经明确Survivin能够与胱天蛋白酶-3、7、9相互作用,从而抑制肿瘤细胞凋亡[10]。近期有研究发现肥胖情况下Survivin在皮下脂肪组织中表达上调,并降低脂肪组织干细胞对于缺氧和瘦素诱导凋亡的敏感性,是脂肪与肿瘤细胞交流的潜在分子[11]。目前大量研究已证实,在肥胖、缺氧、炎症的条件下Survivin的表达均明显上调[3,11-12]。而在饮食诱导的肥胖时,脂肪组织中ApoE的表达降低[13]。肥胖状态下,脂肪细胞能够通过氧化应激作用,在转录水平及蛋白水平抑制ApoE的表达,并且这种抑制取决于脂肪组织间质血管细胞与脂肪细胞之间的相互作用[14]。鉴于肥胖与体内Survivin和ApoE的调节均有相关性,我们推测机体内Survivin与ApoE的调控机制可能存在联系。本研究结果证实,Survivin对脂肪细胞ApoE的表达及分泌具有下调作用,同时不影响其他载脂蛋白表达及脂肪细胞的分化,但其中的调节机制尚不完全清楚,脂肪细胞ApoE的表达和分泌的下调是否为Survivin的直接作用,尚需进一步研究。
血浆内ApoE有90%来源于肝脏,尽管仅有小部分来自脂肪细胞合成,ApoE作为低密度脂蛋白受体的配体,参与了肝脏乳糜微粒以及极低密度脂蛋白的清除。Chen等[15]研究结果显示ApoE基因敲除后的小鼠具有较高的基础氧化应激,会自发造成高血脂和动脉粥样硬化。近年来许多研究表明,脂肪细胞合成的ApoE可能存在不同于肝脏来源的ApoE的新功能。ApoE在小鼠脂肪细胞中的表达量与体脂量呈正相关[16]。Huang等[4]研究表明小鼠异体移植的脂肪细胞产生的ApoE有助于获取循环三酰甘油,进行脂质积累。进一步研究表明[5],在选择性敲除小鼠脂肪组织ApoE后,肝脏中ApoE的合成并不受影响,循环ApoE仍保持在正常值,小鼠脂肪脂质积累减少、糖耐量改善。最近研究证明[7],增加的铁能抑制人脂肪细胞释放ApoE,此过程与氧化应激有关,可能对改善胰岛素抵抗以及肝损伤存在重要作用。关于Survivin下调ApoE表达对糖脂代谢的影响,我们还需在动物水平上作进一步研究。
综上所述,本研究结果表明,Survivin过表达能在转录和蛋白水平下调脂肪细胞ApoE的表达和分泌,揭示了Survivin在脂肪细胞脂代谢中的重要作用。然而本研究仅在体外进行了3T3-L1脂肪细胞诱导分化,在体内脂肪细胞中Survivin能否调控ApoE的表达尚需进一步研究。
