高效液相色谱法测定红曲发酵食品中洛伐他汀的研究
2020-06-08张星星毛清黎周念波钟小丹吴季勤
张星星 ,毛清黎*,孙 俊,周念波,钟小丹,吴季勤,颜 泽,陶 鑫,张 洁
(1.武汉生物工程学院校企共建功能米酒研发中心,湖北武汉 430415;2.武汉生物工程学院食品科技学院,湖北武汉 430415;3.湖北米婆婆生物科技股份有限公司,湖北孝感 432000;4.武汉生物工程学院生命科学与技术学院,湖北武汉 430415)
红曲霉(Monascus)又名红曲菌,主要采用大米为原料,接种红曲霉进而发酵生产得到的一种红色米曲,为我国一种较传统的药用真菌[1-3]。红曲霉在发酵代谢过程中可产生红曲色素、多糖、γ-氨基丁酸、麦角固醇、不饱和脂肪酸以及洛伐他汀等多种生理活性物质,既可用于食品着色、腐乳制作、酿酒和疾病治疗等,又有抗菌、降血脂、降血压等作用[4],在食品和医药行业中有着非常广泛的应用。目前国内市场上已有多种以红曲为主要成分的中成药,如“圣曲红曲胶囊”和“血脂康”等,且疗效显著[3]。
洛伐他汀(lovastatin)为红曲发酵中产生的一种生理活性物质,有闭环的内酯式和开环的β-羟基酸式两种结构[5-6]。研究表明,洛伐他汀不仅可有效阻断内源性胆固醇的合成,还具有保护肾脏、抗动脉粥样硬化、抗癌、抗炎等作用[7-8],因而日渐受到国内外研究者的关注。市场上利用红曲已开发出各类保健食品,如程亚运[9]利用丝苗米、红曲米和枣汁按一定比例混合,接种红曲霉预发酵48 h,然后接种酵母,按比例调节料水比发酵得到红曲枣酒;李燚[10]通过添加红曲,分别制作出了红曲酸奶和红曲米酒,并考察了红曲菌丝体添加量对产品品质的影响,类似文献报道较多[11],但大多集中在产品工艺研究;另一方面,洛伐他的汀含量分析则主要为药物产品,如谢静等[6]采用高效液相色谱(high performance liquid chromatography,HPLC)法对血脂康胶囊中洛伐他汀的含量进行了检测,程杰等[12]建立了一种测定脂必妥胶囊中洛伐他汀含量的HPLC法,而关于红曲发酵食品中洛伐他汀的检测分析也有一些报道,如李涛等[13]优化了洛伐他汀有关物质的HPLC分析方法,莫永川等[14]建立了以红曲为原料的保健食品中洛伐他汀含量测定的方法。
本研究根据洛伐他汀的结构特点,运用反相液相色谱系统[16-20],以常见的紫外检测器建立了一种红曲发酵食品中的洛伐他汀类物质的高效液相色谱分析方法,并对该方法的准确度、精密度和重现性等问题进行了较为深入、系统地研究,同时将其应用于红曲发酵食品的检测中,为功能性红曲发酵食品的质量评价提供参考依据。
1 材料与方法
1.1 材料与试剂
洛伐他汀标样(色谱纯):上海源叶生物科技有限公司;磷酸、乙醇(均为分析纯):国药控股股份有限公司;甲醇(色谱纯):天津科密欧试剂有限公司;实验用水为超纯水;红曲:广州市威伦食品有限公司;红曲米酒、红曲米:校企共建功能米酒研发中心实验室自制。
1.2 仪器与设备
CH-4数显恒温水浴锅:江苏省金坛市宏华仪器厂;Waters1525高效液相色谱仪:美国Waters公司;DHG-9055A实验室数显干燥箱:上海一恒科学仪器有限公司;BQS超声波清洗仪:杭州宝珀超声波科技有限公司;ME204T/02电子分析天平:梅特勒-托利多国际有限公司;TDZ5-WS台式离心机:上海向帆仪器有限公司。
1.3 实验方法
1.3.1 洛伐他汀标准溶液配制
内酯式洛伐他汀标准溶液的配制:精确称取内酯式洛伐他汀20.0 mg,以色谱甲醇溶解后,定容至10 mL,即得2.0 mg/mL的内酯式洛伐他汀标准溶液。将其依次以甲醇稀释至1.00 mg/mL、0.50 mg/mL、0.25 mg/mL、0.10 mg/mL、0.05 mg/mL等系列浓度。
酸式洛伐他汀标准溶液配制:准确移取上述2.0 mg/mL的内酯式洛伐他汀标准母液1 mL,加入0.2 mol/L氢氧化钠-乙醇溶液至10 mL,充分混匀后,置于50 ℃下超声清洗仪中,超声转化1 h,冷却后静置1 h,即为0.2 mg/mL的酸式洛伐他汀标准贮备液,后稀释至相应质量浓度。
内酯式/酸式洛伐他汀混标的配制:取0.1 mg/mL内酯式洛伐他汀标准溶液1 mL和0.05 mg/mL酸式洛伐他汀标准溶液1 mL,进行混合,混匀后,运用高效液相色谱(HPLC)法进行测试分析。
1.3.2 洛伐他汀的HPLC分析条件
1.3.3 洛伐他汀标准工作曲线的绘制
将上述系列浓度的内酯式洛伐他汀标准溶液,按1.3.2的HPLC条件进行分析,记录各质量浓度下的峰面积,以内酯式洛伐他汀标准溶液进样质量浓度为横坐标,峰面积为纵坐标绘制标准工作曲线。
1.3.4 精密度实验
取0.05 mg/mL、0.10 mg/mL、1.00 mg/mL三种不同浓度的内酯式洛伐他汀标准溶液,对每种质量浓度下的标液进行一天测定5次及连续5 d的HPLC分析。根据记录的峰面积计算其质量浓度,并得出分析结果的相对标准偏差(relative standard deviation,RSD),以评价上述方法的精密度。
1.3.5 加标回收率实验
分别取洛伐他汀含量为0.25 mg/mL、0.50 mg/mL的两种红曲发酵食品样品,向每种样品中添加0.10 mL质量浓度依次为0(空白对照)、0.25 mg/mL、0.50 mg/mL的内酯式洛伐他汀标准溶液,混合均匀,按照1.3.2进行HPLC分析,记录目标峰的峰面积,并计算出实际样品浓度和样品的加标回收率。
1.3.6 食品中洛伐他汀含量的检测
固体食品:取10 g食品样品,研磨过40目筛,称取混匀后的筛下物2 g于20 mL具塞试管中,向其中加入20 mL 75%的乙醇溶液,于40 ℃水浴中超声提取1 h,冷却后,分装至离心管中离心10 min,转速为5 000 r/min,合并上清液过滤膜,进行HPLC分析。
液体食品:摇匀后取样,准确移取1mL液体食品于20mL具塞试管中,向其中加入10 mL体积分数75%的乙醇水溶液,于40 ℃水浴中超声提取1 h,冷却后,分装至离心管中离心10 min,转速为5 000 r/min,合并上清液过滤膜,进行HPLC分析。
2 结果与分析
2.1 洛伐他汀标准液HPLC分析
取1.3.1中配制的洛伐他汀混标溶液1 mL,按照方法1.3.2液相色谱方法进行分析,其色谱结果见图1。由图1可知,酸式和内酯式两种洛伐他汀的保留时间依次为22.54 min和27.21 min,两目标峰峰形对称性好,柱效较高,且分离度>1.5,达到了基线分离的效果,效果非常显著,这表明该色谱条件可作为两种洛伐他汀的定性分析依据。

图1 洛伐他汀标准品HPLC色谱图Fig.1 HPLC chromatogram of the lovastatin standard
2.2 洛伐他汀标准工作曲线的绘制
将方法1.3.1所配制的0.05~1.00 mg/mL系列浓度的内酯式洛伐他汀标准溶液按照方法1.3.2的色谱条件分别进行色谱分析,记录各质量浓度色谱峰面积,以内酯式洛伐他汀的质量浓度(X)为横坐标,峰面积(Y)为纵坐标绘制标准工作曲线,结果见图2。由图2可知,线性回归方程为Y=3.03×107X+263 113(R2=0.999 8),表明在0.05~1.00 mg/mL质量浓度区间内,线性关系良好,灵敏度高,完全满足定量分析要求。

图2 内酯式洛伐他汀标准工作曲线Fig.2 Standard curve of lactone lovastatin
2.3 精密度实验结果
为考察方法的精密度,取0.05 mg/mL、0.10 mg/mL、1.00 mg/mL 3种不同质量浓度的内酯式洛伐他汀标准溶液,对每种质量浓度下的标液进行1 d内测定5次以及连续5 d的HPLC分析,实验结果见表1。由表1可知,日内5次重复测样结果的相对标准偏差为1.25%~2.56%,回收率为96.12%~101.32%;连续日间5 d测样结果的相对标准偏差为1.25%~2.64%,回收率为96.18%~102.01%。表明该方法具有较高的重现性、精密度和准确度。同时表1结果也反映了该方法处理的样品具有很好的稳定性,标准样品短时期的存放基本不会改变测定结果。然而该方法与测定药品中的洛伐他丁的主要区别就在样品的处理上,食品样品组成复杂,因此对测定方法的要求则更高。
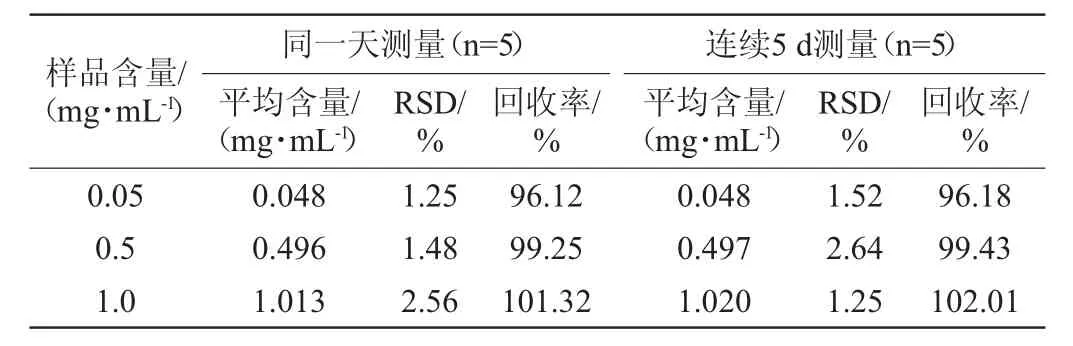
表1 精密度实验结果Table 1 Results of precision experiments
2.4 加标回收率实验结果
取已知洛伐他汀含量的红曲发酵食品样品,向其中添加一定量的内酯式洛伐他汀对照品,充分混匀后,按照方法1.3.2进行HPLC分析,记录目标峰的峰面积,并计算出实际样品中洛伐他汀浓度和样品的加标回收率,结果见表2。由表2可知,所有食品样品的加标回收率均在99.01%~102.40%范围内,回收率结果相对标准偏差在1.53%~3.54%范围内,表明该方法具备良好的精确度,可满足分析要求。
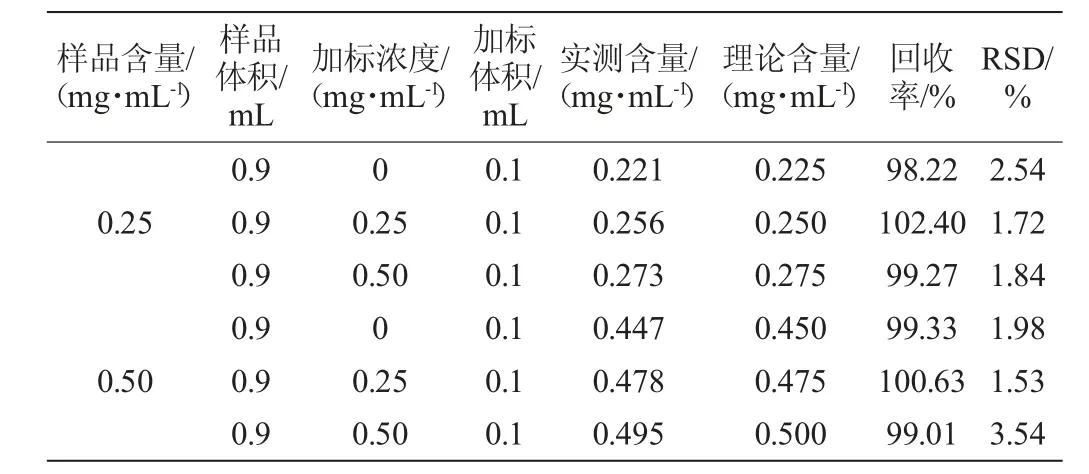
表2 加标回收率实验结果Table 2 Result of standard recovery rate experiments
2.5 红曲发酵食品中内酯式洛伐他汀含量的检测
为了考察本方法对实际红曲发酵食品样品的分析效果,实验选取了红曲、红曲霉发酵的红曲米酒以及红曲米三种样品,按实验方法的步骤进行处理、分析,测试的结果见图3。

图3 几种不同红曲发酵食品样品HPLC色谱图Fig.3 HPLC chromatogram of different Monascus fermented food samples
由图3可知,红曲样品谱图干扰峰较少,对测定基本上没产生影响,红曲米酒样品谱图中在12~18 min出现了少量的干扰峰,但相比于目标物,其含量可忽略,红曲米样品谱图中分别在8 min、16 min及20 min左右出现了干扰峰,且其含量较高,上述样品谱图的差异可能与红曲发酵食品在制作过程中红曲发酵所利用的底物及发酵条件不同,使得发酵食品产物成分较为复杂,此外,洛伐他汀与食品中其他各成分之间的结合能力也不同,导致溶剂提取时洛伐他汀的富集效果存在差异。虽然上述实际食品样品成分比较复杂,但使用该方法测定时,谱图中干扰峰较少,对测定基本上没产生影响,说明该方法的选择性很好,非常适合食品中洛伐他汀的测定。
从食品样品中测得洛伐他汀平行3次结果见表3。由表3可知,检测结果的RSD范围在1.67%~4.85%,可知通过该方法检测的食品中洛伐他汀含量重现性较好。比较3种食品中目标峰的大小可知,红曲样中洛伐他汀含量最高,平均含量为1.559 mg/g,而由其发酵的食品产品红曲米和红曲米酒中洛伐他汀含量则较低,充分说明了红曲食品在发酵过程中,洛伐他汀有所损失,如何在食品发酵过程中更好的保留洛伐他汀对食品发酵工艺提出了新的要求。

表3 不同红曲发酵食品样品中内酯式洛伐他汀的含量Table 3 Lactone lovastatin content in different Monascus fermented food samples
3 结论
本文建立了一种HPLC法对红曲发酵食品中的洛伐他汀类物质进行测定的方法。发酵红曲食品样品经体积分数75%乙醇溶解,在40 ℃水浴下超声提取1 h后离心,使用InertSustainC1(8250 mm×10 mm,5 μm)色谱柱,采用甲醇/0.3%磷酸溶液75∶25(V/V)为流动相,等度洗脱,保持柱温30 ℃,流速1 mL/min,UV波长λ=238 nm的色谱条件下分析35 min。结果显示该法在0.05~1.0 mg/mL的质量浓度范围内,线性关系良好,且日间和日内相对标准偏差分别为1.25%~2.64%、1.25%~2.56%,样品的加标回收率为99.01%~102.40%,该法不仅操作简便、测试成本低廉,对仪器设备要求也较低,同时具备良好的稳定性、准确度和精密度。在实际红曲发酵食品样品测试中干扰峰少,目标峰形对称,非常适合食品样品中洛伐他汀类物质的测定,可为功能性红曲发酵食品的质量评价提供参考依据。
