新疆传统乳品中产胞外多糖乳酸菌的筛选及益生特性的研究
2020-06-08高云云李宝坤卢士玲蒋彩虹王庆玲
高云云,李宝坤,卢士玲,蒋彩虹,王庆玲,董 娟
(石河子大学食品学院,新疆石河子 832000)
乳酸菌(lactic acid bacteria,LAB)是指发酵碳水化合物产生乳酸的一类细菌的总称,广泛存在于自然界中,一般被认为是安全的(generally regards as safe,GRAS)[1]。乳酸菌胞外多糖(ex-polysaccharides,EPS)是微生物在生长代谢过程中分泌到细胞外的粘液或黏附在细胞表面的荚膜多糖[2],乳酸菌胞外多糖已被证明具有增强免疫调节[3]、抗肿瘤[4]、降胆固醇[5]、抗氧化[6]、改变发酵乳流变学特性[7]等作用。目前对与乳酸菌胞外多糖各种性质的研究方法较为成熟,所以将其应用于乳制品中来改变发酵乳品质和制作功能性乳品方面有广阔的前景。
乳酸菌作为益生菌应具备多种对人体健康有益的生理功能,包括抑制有害菌的生长、延缓机体衰老、降低胆固醇、缓解乳糖不耐症、调节肠道菌群平衡等[8]。乳酸菌发挥益生功效的前提是必须克服宿主体内的各种不利条件,能够耐受胃液的低pH和肠液环境中的高浓度的胆盐及具有附着在宿主肠壁细胞的能力等,这是乳酸菌发挥作用尤为重要的条件[9-10]。近年来,乳酸菌胞外多糖由于良好的功能特在食品和医药行业中广泛应用,这使得乳酸菌受到更多的关注[11],乳酸菌胞外多糖作为增稠剂应用在酸奶生产中能够起到改善酸奶质地、提高产品稳定性增强口感等作用[12]然而,国内对于乳酸菌EPS的研究起步较晚,但近年来已取得很大的进展[13]。关于如何准确筛选产EPS菌株和提高产量是目前国内学者研究的热点。
新疆牧区少数民族在制作传统乳品方面有着丰富的经验,这为新疆传统乳制品中优良乳酸菌菌种的开发利用提供了丰富的资源。本研究分析新疆传统乳品中微生物多样性,并筛选出了3株高产胞外多糖的植物乳杆菌,对菌株的潜在益生特性进行分析,以期为进一步利用此种菌株开发功能性食品提供良好的科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
10份样品均来自塔地区不同牧场。其中酸奶来源于二支河牧场四队2份、二道桥乡1份;酸马奶来自霍吉尔特乡和二道桥乡2份;鲜马奶来源于喀拉也木勒乡1份、二道桥固牧场2份。样品采集后装入50 mL无菌离心管内旋紧盖并做标记。将采集到的样品至于低温采样箱中迅速运回实验室,放置在-4 ℃冰箱中,为防止微生物损失,尽快对其中的微生物进行分离。
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus):石河子大学畜产品加工实验室;鼠李糖乳杆菌(Lactobacillus rhamnosus):衡阳师范学院。
1.1.2 化学试剂
苯酚、浓硫酸、无水乙醇、三氯化铁、牛胆盐、胆固醇、葡萄糖、铁氰化钾、磷酸等均为国产分析纯:国药集团化学试剂有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化科技限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)(分析纯):美国Sigma公司。
1.1.3 培养基
脱脂乳培养基(EMS)[14]:90 g/L脱脂乳,3.5 g/L酵母提取物,3.5 g/L蛋白胨,10 g/L葡萄糖。MRS肉汤培养基、MRS固体培养基、BHI培养基、Mueller Hinton Agar(MHA)培养基[15]:青岛高科技工业园海博生物技术有限公司。
1.2 仪器与设备
DNP-9272电热恒温培养箱:上海精宏实验设备公司;T100TTMhermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国BIO-RAD公司;Universal Hood II凝胶成像仪:美国BIO-RAD公国药集团化学试剂有限公司司;Nedfuge 15R台式高速冷冻离心机:赛默飞世尔科技(中国)有限公司;EONC酶标仪:美国伯腾仪器有限公司;LDZX-30KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂。
1.3 实验方法
1.3.1 乳酸菌的分离纯化
取酸奶、酸马奶、鲜马奶样品各1 mL,用无菌生理盐水10倍稀释至10-5、10-6、10-7。取各浓度稀释液100 μL涂布于MRS固体培养基上,37 ℃培养36 h后根据菌株在固体平板上的生长情况,挑选菌落形态不同的菌株进行革兰氏染色及过氧化氢酶实验。选择革兰氏染色阳性过氧化氢酶阴性结果的菌株进一步在MRS培养基中纯化培养后,取适量菌液接入终浓度为30%甘油中,-80 ℃保藏。
1.3.2 菌株的生物学鉴定
使用试剂盒提取菌株DNA。采用通用引物27f(5'-AGAGTTTGATCCTGGCTCAG-3')和1492r:(5'-CTACGGCTACCTTGTTACGA-3'),PCR扩增程序参照文献[16]。PCR产物经1.0%琼脂糖凝胶电泳检测后,送往上海生工生物科技有限公司进行测序,测序结果提交至GenBank数据库中进行序列同源性比对,并用MAGE 5.0软件构建系统发育树。
1.3.3 产胞外多糖乳酸菌的筛选
用无菌接种环蘸取一定菌液四区划线于MRS固体培养基上。另取200 μL接种于ESM培养基中。置于37 ℃培养箱中培养24 h后。观察MRS琼脂培养基上菌落形态和EMS培养基中的拉丝情况并做适当记录。
1.3.4 胞外多糖的提取及含量测定
参考LIU A等[17]的方法并做适当修改,将活化好的菌株接3%(V/V)于MRS肉汤中,37 ℃培养24 h得到发酵液,发酵液于4 ℃条件下8 000 r/min 离心20 min后收集上清液。加入3倍体积的冰乙醇4 ℃过夜放置。4 ℃条件下8 000 r/min离心20 min后,将沉淀物溶解在一定体积的去离子水中,加入终浓度为8%的三氯乙酸在4 ℃保持过夜去除蛋白质。再次离心除去沉淀,上清液置于4 ℃纯水中透析48 h,每8 h换一次水。
多糖含量的测定采用苯酚-硫酸法,参照王辑等[8]的方法配制不同浓度的葡萄糖标准溶液,测定各个浓度的葡萄糖溶液在波长490 nm的吸光度值,分别以葡萄糖溶液浓度(x)和吸光度值(y)为横坐标和纵坐标绘制葡萄糖标准曲线,得标准曲线回归方程y=0.008x+0.004,相关系数R2=0.998 7,按照回归方程计算样品中胞外多糖的含量。
1.3.5 产糖菌株的耐受性
(1)耐酸能力评价
调节MRS培养基的pH值为3,接种3%(V/V)活化好的乳酸菌,37 ℃培养4 h后将所得菌液适当稀释进行平板菌落计数[18]。
(2)胆盐耐受性
参照DELGADO S等[19-20]的方法做部分调整。将活化好的菌液接种3%(V/V)于0、0.1%、0.2%、0.3%牛胆盐的MRS培养基中,37 ℃培养,每小时测吸光度值(OD620nm值),直至OD620nm值上升0.3个单位,确定乳酸菌在不同浓度牛胆盐中的生长滞后期,其计算公式如下:
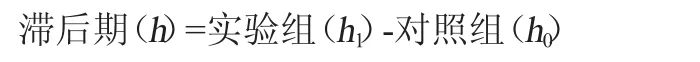
式中:h1为实验组OD620nm值上升0.3个单位需要的时间;h0为对照组OD620nm值上升0.3个单位需要的时间。
(3)人工胃液耐受性
将活化好的菌液4 000 r/min离心10 min,吸取上清液,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤沉淀两次后重悬于等体积生理盐水中混匀制得菌液,采用稀释涂布平板法计算此时的菌液浓度(CFU/mL)。取1 mL菌悬液于9 mL pH值为3的模拟人工胃液中(MRS肉汤中按3 g/L添加胃蛋白酶),37 ℃厌氧培养3 h后进行平板菌落计数[21],菌株存活率计算公式如下:
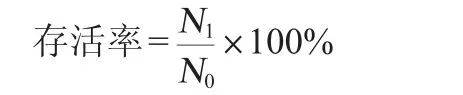
式中:N1为3h后的菌落数,CFU/mL;N0为0h的活菌数,CFU/mL。
(4)人工肠液耐受性
取1 mL菌悬液于9 mL模拟肠液中(在MRS肉汤里添加1 g/L胰蛋白酶和3 g/L牛胆盐),37 ℃培养厌氧培养3 h后进行平板菌落计数。
1.3.6 产糖菌株DPPH自由基清除率测定
取入2 mL菌液于1 mL 0.2 mmol/L DPPH中,用无水乙醇补足2 mL,立刻涡旋摇匀,避光反应30 min,测定混合液在波长517nm处的吸光度值(OD517nm值)。以未加样品为对照,无水乙醇作为空白[22]。DPPH自由基清除率计算公式如下:
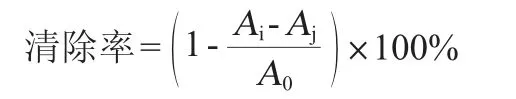
式中:Ai为1 mL的DPPH+1 mL样品的吸光度值;Aj为1 mL溶剂+1 mL样品的吸光度值;A0为1 mL DPPH+1 mL溶剂的吸光度值。
1.3.7 产糖菌株自凝聚率的测定
参考SON S H等[23]的方法作适当修改:将活化好菌液在4 000 r/min离心20 min,用PBS洗涤细胞两次并重悬于相同的缓冲液中,调节OD600nm值=0.3±0.05。将细菌细胞悬浮液37 ℃孵育2 h,取样测波长600 nm处吸光度值,自凝聚率计算公式如下:
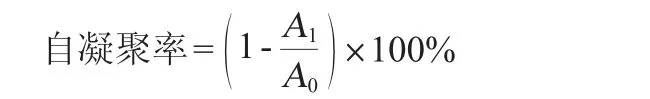
式中:A0为0 h的吸光度值;A1为2 h的吸光度值。
1.3.8 产糖菌株表面疏水性的测定
调节菌液的初始OD600nm值=0.5±0.02。将3 mL菌悬液和1 mL二甲苯于室温条件下混匀混合。将混合物37 ℃静置20 min后取水相,测定其在波长600 nm处的吸光度值(OD600nm值),表面疏水性计算公式如下:
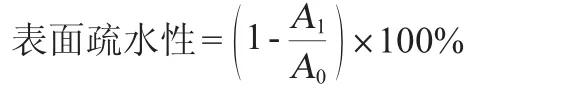
式中:A0为0 h的吸光度值;A1为加入二甲苯后的吸光度值。
1.3.9 产糖菌株胆固醇去除能力
参考吴云[24]的方法做适当修改。将活化好的菌液接3%(V/V)于胆盐含量为0、0.1%、0.2%、0.3%且胆固醇终体积为100 μg/mL的MRS液体培养基中,摇床培养24 h后,取1 mL发酵液加入4 mL无水乙醇混合均匀静置20 min,4 ℃、5 000 r/min离心10 min,取2.5 mL 上清液加入2.5 mL磷铁硫试剂用漩涡混合器混匀冷却后,测定波长560 nm处的吸光度值(OD560nm值),分别以胆固醇质量浓度(x)和吸光度值(y)为横坐标和纵坐标绘制胆固醇标准曲线。得标准曲线回归方程y=0.007 1x-0.009 4(相关系数R2=0.995 5),发酵液的胆固醇含量和菌株的胆固醇去除率计算公式如下:
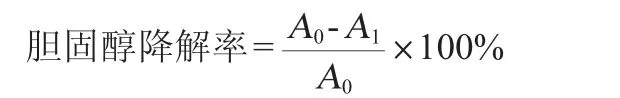
式中:A0为培养前胆固醇含量,mg/mL;A1为培养后胆固醇含量,mg/mL。
1.3.10 产糖菌株抑菌能力评价
将-80 ℃保藏金黄色葡萄球菌、大肠杆菌,在BHI液体培养基中培养24 h,Muelller-Hinton琼脂培养基纯化后,使其达到对数期备用。
采用牛津杯法测定乳酸菌的抑菌活性,指示菌使用Muelller-Hinton琼脂培养基调整至106~107CFU/mL倒平板待其凝固后,将已灭菌的牛津杯放于琼脂表面上。取200 μL乳酸菌菌液于牛津杯中,37 ℃培养24 h,观察并测量抑菌圈直径。通过探究菌株对大肠杆菌、金黄色葡萄球菌的抑制作用所形成的抑菌圈直径大小来评估益生菌对体内致病菌感染的预防和抑制能力。
1.3.11 数据处理
使用Origin 2016进行图表的制作;利用SPSS25.0进行差异性分析;实验数据均进行3次重复,以平均值±标准偏差表示。
2 结果与分析
2.1 乳酸菌的分离及鉴定
从样品中共分离得到153株纯培养物,经过革兰氏染色和过氧化氢酶实验初步鉴定147株为疑似乳酸菌。通过16S rDNA基因检测分析,确定145株乳酸菌。部分乳酸菌系统发育进化关系如图1所示。

图1 部分乳酸菌的系统发育树Fig.1 Phylogenetic tree of some lactic acid bacteria
其中优势菌种为屎肠球菌(Enterococcus)41株约占27.8%,发酵乳杆菌(Lactobacillus fermentum)36株约占24.5%,植物乳杆菌(Lactobacillusplantarum)23株约占15.6%,其余分别为短乳杆菌(Lactobacillus brevis)10株,戊糖片球菌(Pediococcus pentosaceus)9株,保加利亚乳杆菌(Lactobacillus bulgaricus)8株,食窦魏斯氏菌(Weissella cibaria)6株,瑞士乳杆菌(Lactobacillus helveticus)4株,副干酪乳杆菌(Lactobacillus paracasei)4株,耐久肠球菌(Enterococcus durans)3株,罗伊氏乳杆菌(Lactobacillus reuteri)1株。
2.2 产胞外多糖乳酸菌的筛选
由图2可知,在优势菌种屎肠球菌、发酵乳杆菌和植物乳杆菌中初筛出22株在MRS固体培养基和EMS培养基中有明显产粘拉丝情况的菌株。由表1可知,用苯酚硫酸法对其所产多糖进行定量,实验结果显示出3株产胞外多糖含量较高的菌株1-3、1-6、4-1,均为植物乳杆菌。

图2 产胞外多糖菌株的菌落形态Fig.2 Colony morphology of exopolysaccharides-producing strains
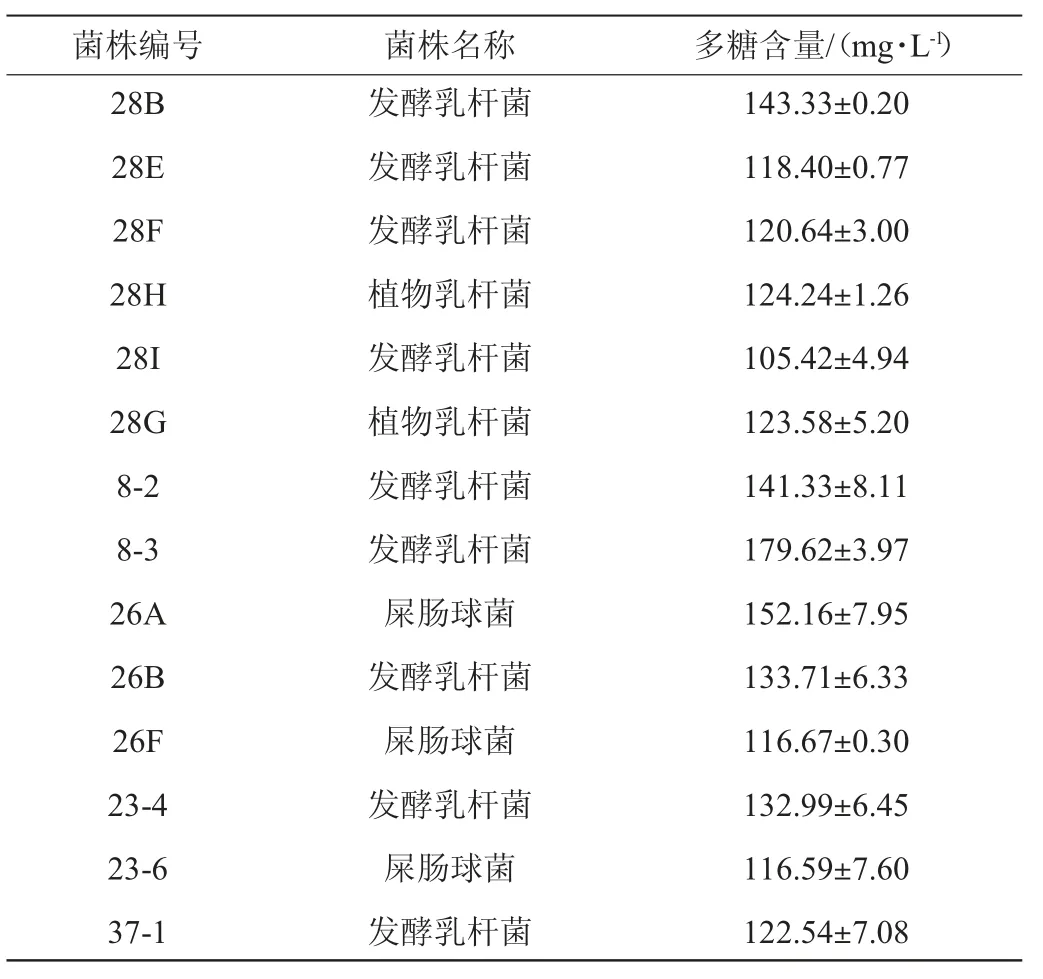
表1 菌株产胞外多糖的产量Table 1 Yield of exopolysaccharides produced by strains
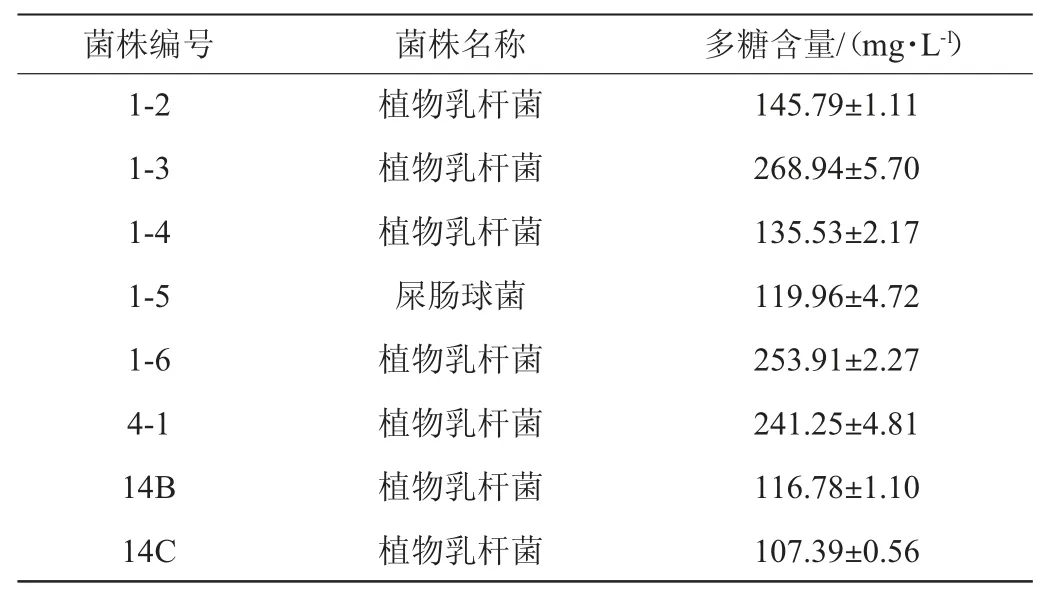
续表
2.3 产EPS植物乳杆菌的耐受性
2.3.1 耐酸能力评价
益生乳酸菌在pH值为3的环境中消化3 h后菌株的存活是作为评价菌株耐酸性的标准[25]。本实验中用菌株在pH值为3的环境中消化4 h来进一步保证其在3 h的活菌数。如图3所示,3株植物乳杆菌对低pH的生长环境都有一定的耐受能力,在pH值为3的条件下处理4 h后,菌株4-1活菌数最多显著高于鼠李糖乳杆菌(P<0.05),但菌株1-3和1-6也表现出一定的耐酸能力,预示该菌株进入消化道后具有对胃液中低pH的不利条件有较强的抵抗能力。
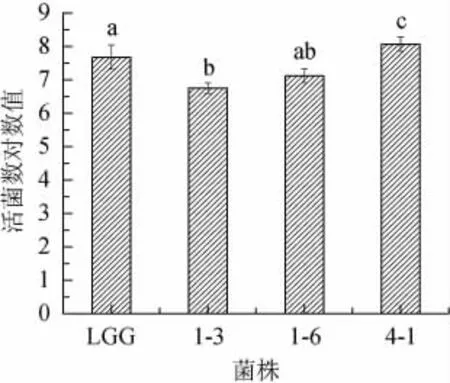
图3 菌株耐酸能力评价Fig.3 Evaluation of acid resistance of strains
2.3.2 胆盐耐受性
微生物在有胆盐的环境中生长会受到强烈抑制。因此,只有那些对高浓度胆盐有较强耐受性的菌株才能在人体肠道内存活下来并发挥作用[26]。如图4所示,植物乳杆菌1-3相对于其他两株菌有较强的胆盐耐受性,在含量为0.1%、0.2%、0.3%的胆盐环境中生长滞后时间约为1 h、2 h、4 h。菌株4-1的生长滞后时间约为2 h、4 h、7 h。菌株1-6的生长滞后时间分别为2 h、6 h在胆盐含量为0.3%的环境中生长10 h后OD620nm值仍然没有达到上升0.3,说明菌株浓度为0.3%的胆盐对菌株1-6的生长产生强烈的抑制作用。
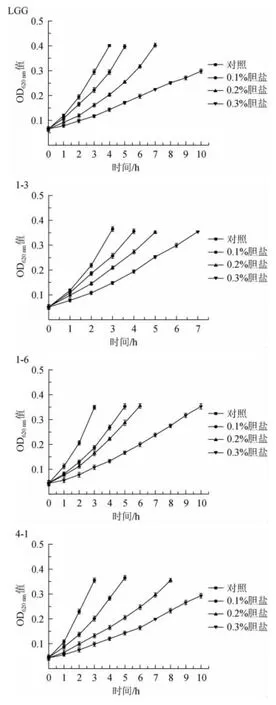
图4 菌株胆盐耐受性评价Fig.4 Evaluation of bile salt tolerance of strains
2.3.3 菌株模拟肠胃耐受性
人体胃液酸性一般在pH 3左右,但由于受到饮食等因素的影响。pH值在1.5~5.0之间波动,胃液的酸性会激活胃蛋白酶原,杀死进入胃中的微生物。所以益生菌对胃液中的酸性环境和胃蛋白酶有一定的耐受性是其在人体内发挥益生作用的前提[27]。人体小肠是益生菌发挥作用的场所,但小肠的高胆盐环境会抑制益生菌的活性,所以益生菌对肠液也要有一定的耐受性才能发挥其益生作用[28]。3株菌的胃肠液耐受性结果如图5所示。由图5可知,菌株4-1在人工胃液中的存活率最高达到68.74%,菌株1-6存活率最低53.07%。但菌株1-3在人工肠液中有最大的存活率达到69.97%,菌株4-1存活率最低50.01%。3株植物乳杆菌在人工胃肠液中的存活率均>50%,说明3株植物乳杆菌对模拟人工胃肠均有较高的耐受性。
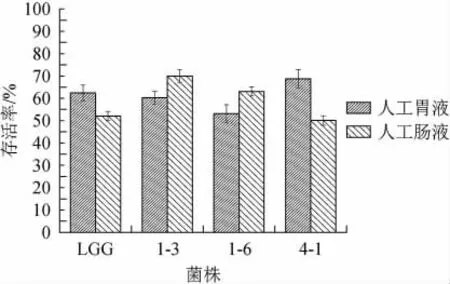
图5 菌株的人工胃肠液耐受性评价Fig.5 Evaluation of artificial gastrointestinal tolerance of strains
2.3.4 菌株DPPH自由基清除率
DPPH在有机溶剂中是一种稳定的自由基,对DPPH自由基的清除可反应出菌株具有降低过氧化自由基、烷自由基或脂质自由基连锁反应的特性[29]。三株菌对DPPH自由基清除能力如图6所示。由图6可知,菌株1-3对DPPH自由基清除率(50.03%)明显高于对照菌株LGG(32.77%)和菌株1-6、菌株4-1(P<0.05),菌株4-1的DPPH自由基清除率基本与参考菌株LGG相同。目前已有研究表明植物乳杆菌DPPH自由基清除率为(8.39%~45.97%)这与目前的研究结果相类似[30-31]。XU Y等[32]研究发现L.plantarumKX041产生的EPS具有较好的清除DPPH自由基和羟基自由基的能力。本研究中3株产胞外多糖EPS的植物乳杆菌对DPPH自由基有较强的清除能力,推测其抗氧化活性与EPS活性有一定的关系,但还需进行实验验证。
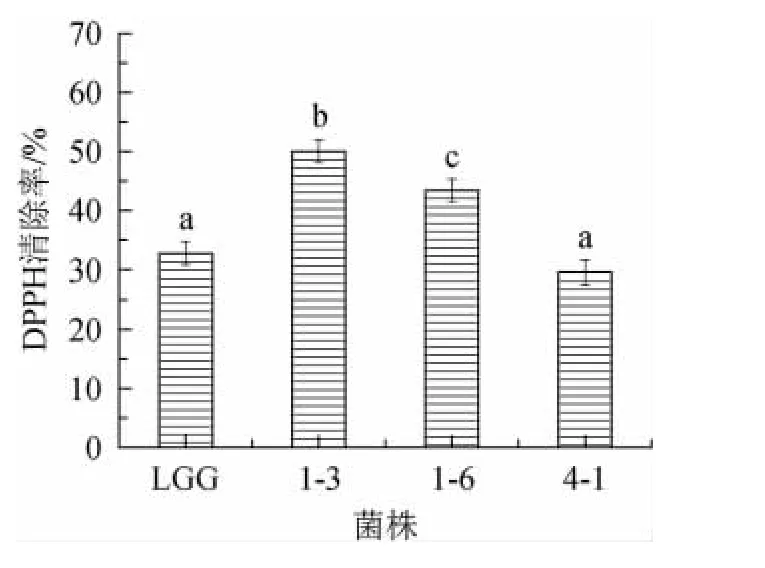
图6 菌株对DPPH自由基的清除率Fig.6 Scavenging rate of DPPH free radicals by strains
2.3.5 菌株的表面疏水性和自凝聚率
乳酸菌菌株的细胞表面疏水性和自聚集能力与粘附能力和肠道的定植有关[33]。自凝集是同一种菌株间相互凝集形成多细胞簇的现象,益生菌通过自凝集作用相互凝集到一定的数量时粘附才牢固,进而达到菌株发挥益生功效所需要的数量。而疏水性是指非极性溶液(溶质)在极性水中所呈现的不稳定状态,从而引起一系列热能(熵)和分子重新分布及排列的变化。疏水性较高的菌株,对小肠组织有较高的粘附能力。菌株的自凝聚和疏水性如表2所示。由表2可知,不同菌株之间自凝聚能力和表面疏水性存在一定差异,菌株1-3的表面疏水性和自凝聚能力显著高于其他菌株(P<0.05)。3株植物乳杆菌都表现出一定自凝聚能力和疏水性,说明该菌株有黏附在人体肠道上皮细胞和黏膜表面的可能性。

表2 菌株自凝聚及表面疏水性Table 2 Self-aggregation and surface hydrophobicity of strains
2.3.6 胆固醇降解率
高胆固醇血症是导致人类发病和死亡的一个重大的健康问题。近年来大量的体内外实验证明植物乳杆菌能够有效地降低胆固醇。由图7可知,在添加胆盐的培养基中3株植物乳杆菌降解胆固醇的能力均有所提高,表明胆盐存在对胆固醇的降解率有一定的促进作用。但随着胆盐浓度的升高其胆固醇降解率有所下降。可能是因为过高浓度的胆盐抑制乳酸菌的生长。3株植物乳杆菌都在0.1%的胆盐浓度中有最高的胆固醇降解率。但菌株1-3的胆固醇降解率达到36.98%。这与李妮等[34]的研究结果相类似。
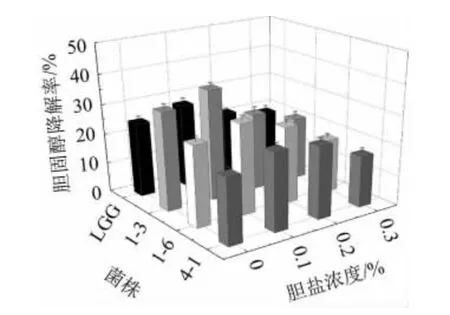
图7 菌株的胆固醇降解率Fig.7 Cholesterol degradation rate of strains
2.3.7 抑菌能力评价
如图8所示,植物乳杆菌1-3、1-6对大肠杆菌和金黄色葡糖球菌的抑制作用显著大于菌株4-1(P<0.05)。对大肠杆菌的抑菌圈直径都达到19 mm。对金黄色葡糖球菌的抑菌圈直径都达到18 mm。而菌株4-1对大肠杆菌和金黄葡糖球菌的抑制作用较菌株1-3、1-6弱。抑菌圈直径在15 mm左右。宋莹龙[35]研究发现植物乳杆菌12产生的胞外多糖对大肠杆菌,金黄色葡糖球菌等6种致病菌生物膜的形成有抑制作用。本研究中3株植物乳杆菌的高抑菌能力除了与其本身的作用之外可能也和其产生的胞外多糖的活性有关。

图8 菌株1-3和1-6对大肠杆菌和金黄色葡糖球菌的抑制作用Fig.8 Inhibition of strains 1-3 and 1-6 against Escherichia coli and Staphylococcus aureus
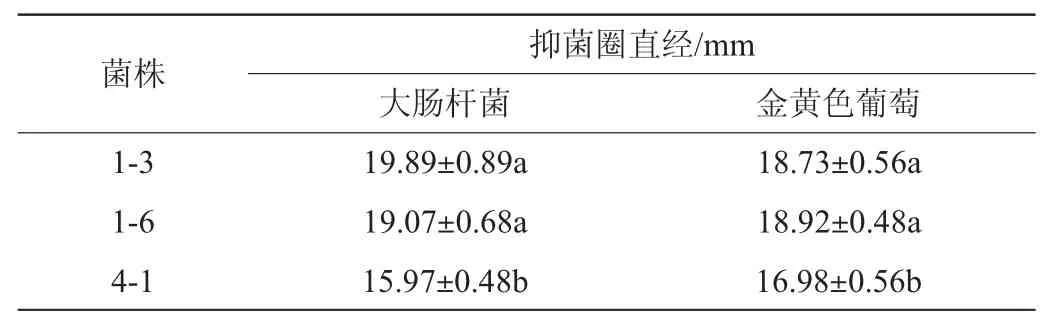
表3 菌株对致病菌的抑菌活性Table 3 Inhibitory activities of strain against pathogens
3 结论
从新疆传统乳品中分离出147株乳酸菌,通过表型鉴定及苯酚硫酸筛选出22株产胞外多糖含量较高的菌株,其中三株植物乳杆菌1-3、1-6、4-1的产量达到240 mg/L。潜在益生特性研究结果显示,菌株1-3、1-6、4-1在酸性环境中的活菌总数都达到107CFU/mL,在模拟人工胃肠液中的存活率都大于50%。菌株1-3表现出最高的胆盐耐受性,对DPPH自由基的清除能力达到50%、自凝聚力最大为59.3%及对二甲苯的粘附性为68.3%,在胆盐浓度为0.1%时胆固醇去除率最高达到36.98%,且对大肠杆菌和金黄色葡萄球菌有较强的抑制能力。因此植物乳杆菌1-3可作为潜在益生菌用于功能性产品的开发。
