一株产2-苯乙醇酵母的鉴定及其在酱油酿造中的应用
2020-06-08邹谋勇朱新贵孙启星何理琴
邹谋勇,朱新贵,孙启星,何理琴
(李锦记(新会)食品有限公司,广东江门 529100)
酱油起源于我国,是以大豆和面粉或小麦为原料,经微生物发酵酿造而形成的具有特殊色、香、味的液体调味品[1-3]。随着科学技术的不断发展,酱油风味物质形成机理以及代谢调控技术逐渐成为行业的研究热点[4-6],原料大分子酶解产物、发酵菌群代谢产物以及美拉德反应、氧化反应等化学反应产物是酱油风味物质的主要来源[7-10]。然而,在酱油发酵菌群代谢与酱油特征风味形成的关系方面的研究尚不深入,相关报道较少。
微生物菌群在酱油体系中生长代谢,产生了丰富的代谢产物,特别是小分子有机酸、醇、醛、酯等主要由微生物代谢产生[11-12],这些代谢产物是酱油风味物质的重要组成部分。酵母菌群在酱油发酵体系中代谢产生醇、有机酸、酯[10,13-14];2-苯乙醇作为酵母的代谢产物在多种酱油中被检出[15-16],是酱油特征风味物质的重要组分。2-苯乙醇合成代谢菌株的分离鉴定日益受到研究者的关注。富志磊等[17]从老白干香型酒曲中筛选获得1株高产β-苯乙醇的季也蒙毕赤酵母(Pichia guilliermondii)F11601,有较好的高盐耐受性,在pH值为1~10 范围内能生长,β-苯乙醇合成量达1.66 g/L。彭东等[18]从高盐稀态发酵酱醪中分离筛选到1株鲁式接合酵母(Zygosaccharomyces rouxii)和1株近平滑假丝酵母(Candida parapsilosis),将其添加到酱油发酵醪,可显著提高酱醪总酯含量,苯乙醇、甲酸异戊酯等检出量增加。崔瑞迎等[19]在实验室水平上将耐盐酵母菌(Zygosaccharomyces rouxii)CGMCC 3791接种到酱醪进行发酵,发现2-苯乙醇质量浓度显著增加。邹谋勇等[20]从酱油发酵醪中分离筛选到1株大洋假丝酵母(Candida oceani)922-1,将该菌株接种到酱油发酵醪可显著提升酱醪中2-苯乙醇的含量,具有良好的应用前景。目前,对于酱油特征香气成分2-苯乙醇的研究,主要是在挥发性风味物质分析中检出2-苯乙醇,以及微生物强化对酱油风味物质(包括2-苯乙醇)含量的影响,对于2-苯乙醇在酱油中的合成代谢规律研究较少,产2-苯乙醇菌株筛选鉴定及其用于2-苯乙醇提升的研究鲜有报道。
该研究采用梯度平板稀释法从酱油发酵醪中分离筛选到一株可以大量合成2-苯乙醇的酵母菌株30-2,采用生理生化特性测试和转录间隔区(internal transcribed spacer,ITS)序列测序及进化树分析确定菌株30-2分类学地位;通过不同盐度培养基分析了菌株30-2 的耐盐性;并对菌株30-2合成2-苯乙醇的生化途径进行分析。考察菌株30-2提高酱油发酵中2-苯乙醇的质量浓度的能力,旨在为提高酱油特征风味物质2-苯乙醇含量提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
酱油发酵醪样品:李锦记(新会)食品有限公司。
1.1.2 化学试剂
麦芽浸粉、琼脂粉(均为生化试剂):北京陆桥技术股份有限公司;2-苯乙醇(色谱纯)、生理生化实验试剂:生工生物工程(上海)股份有限公司;其他化学试剂(均为分析纯):广州化学试剂厂。
1.1.3 培养基
麦芽汁培养基:1%酵母抽提物,5%麦芽浸粉,余量为水。115 ℃高压蒸汽灭菌15 min。
高盐麦芽汁培养基:1%酵母抽提物,5%麦芽浸粉,18%NaCl,2%琼脂粉,余量为水。115 ℃高压灭菌15 min。
酱醪发酵液培养基:取发酵14 d酱油发酵醪,先用200目纱网过滤,清液于台式离心机5 000 r/min离心10 min,上清液即为酱醪发酵液培养基。115 ℃高压蒸汽灭菌15 min。
酵母筛选平板:广东环凯微生物科技有限公司。
苯丙氨酸为唯一氮源培养基:0.5%苯丙氨酸,2%葡萄糖,0.1%KH2PO4,0.01%NaCl,0.05%MgSO4,0.01%CaCl2,0.02%酵母膏,余量为水。115 ℃高压蒸汽灭菌15 min。
(NH4)2SO4为唯一氮源培养基:0.5%(NH4)2SO4,2%葡萄糖,0.1%KH2PO4,0.01%NaCl,0.05%MgSO4,0.01%CaCl2,0.02%酵母膏,余量为水。115 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
5732-U固相微萃取小柱(50/30 μm,DVB/CAR/PDMS):美国色谱科公司;7820A-5977B气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)分析系统、DBWA×U2色谱柱(30 m×0.32 mm,0.25 μm):美国安捷伦公司;HZQ-X300摇床、DHP-9051恒温培养箱:上海一恒科学仪器有限公司;Blue Star紫外可见分光光度计:北京莱伯泰科仪器股份有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国伯乐公司;DYY-B电泳仪:北京六一仪器厂。
1.3 试验方法
1.3.1 产香酵母的分离
从酱油生产不同时间点抽取酱油发酵醪,用0.85%生理盐水稀释,涂布于高盐麦芽汁培养基,30 ℃静置培养60 h,挑取单菌落划线于高盐麦芽汁培养基,进行分离纯化。纯化后菌株采用麦芽汁培养基进行培养,培养条件为30 ℃、150 r/min,发酵4 d后进行香气评价,筛选可产生独特香气菌株。
1.3.2 菌株30-2种子液及发酵液的制备
种子液制备:将菌株30-2纯化斜面菌苔接种于麦芽汁培养基,30 ℃、180 r/min振荡培养48 h,即为种子液。
发酵液的制备:取上述种子培养液接种到酱醪发酵液培养基中,接种量为5%,30 ℃、100 r/min振荡培养14 d,得发酵液。
1.3.3 菌株30-2发酵液风味成分分析
采用GC-MS对发酵液顶空固相微萃取(solid-phase micro-extraction,SPME)样品进行分析,具体方法如下:
取2 mL样品于4 mL 样品瓶,采用固相微萃取小柱顶空萃取30 min,然后立即进样进行GC-MS分析。气相色谱条件:以氦气(He)为载气,流速1.0 mL/min,固相微萃取小柱进样时间为2 min,不分流,吹扫流量15 mL/min,吹扫2 min,色谱柱升温程序为:40℃保持5min;以2℃/min升温到150℃;再以5 ℃/min升温到240 ℃,保留10 min。质谱条件:采用电子电离(electronic ionization,EI)方式,电离能量为70 eV,检测器电压为857 V,扫描速度为2.00 scans/s,扫描范围为质核比(m/z)20~350;进样口和离子源温度分别为250 ℃和230 ℃;以样品的总离子色谱图进行定性分析,采用单离子检测扫描(single ion monitoring,SIM)模式,以m/z91.1和122.0两个离子为定量离子进行分析。
1.3.4 形态观察及生理生化试验
参照《酵母菌的特征与鉴定手册》[21]中酵母形态及主要生理生化特征,对菌株30-2进行观察与生理生化测试。
1.3.5 ITS序列聚合酶链式反应扩增与系统进化树构建
采用液氮研磨提取菌株30-2基因组DNA,PCR扩增rDNA-ITS序列,PCR反应体系(30 μL)如下:20 ng DNA模板(菌株30-2基因组),100 μmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP),25 pmol通用引物(ITS1:5'-TCCGTAGGTGAACCTGCGG-3';ITS4:5'-TCCTCCGCTTATTGATATGC-3'),2.5 U HiFi DNA聚合酶和1 mmol/L MgCl2;PCR扩增产物送华大基因进行二代测序。测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)(http://blast.ncbi.nlm.nih.gov/)的GenBank数据库进行BLAST检索,获取ITS rDNA同源序列,上述序列采用Clustal X 1.81软件[22]进行多重序列比对;采用MEGA 4软件对比对结果进行分析,采用邻接(neighbor-joining,NJ)法构建系统进化树[23-24]。
1.3.6 菌株30-2 耐盐性实验
取菌株30-2种子培养液分别接种到含0、5%、10%、15%、18%NaCl的麦芽汁培养基,接种量为5%(V/V);30℃、180r/min振荡培养,并按时间节点(0、6 h、11 h、24 h、31 h、48 h、72 h、96 h)取样于波长600 nm处测定OD600nm值。
1.3.7 菌株30-2在不同培养基中2-苯乙醇代谢能力研究
培养基设计为2组,第1组含4种培养基:麦芽汁培养基添加苯丙氨酸,麦芽汁培养基,苯丙氨酸为唯一氮源培养基,(NH4)2SO4为唯一氮源培养基;第2组含4种培养基:酱醪发酵醪,酱醪发酵醪加0.5%、1.0%苯丙氨酸,对照组(不接种菌株30-2)。取上述种子液200 mL,4 000 r/min离心10 min;菌体沉淀采用灭菌生理盐水重悬,离心去上清,重复3遍,再用生理盐水重悬,并定容到200 mL。种子悬液接种到上述两组培养基,接种量为5%(V/V)。发酵温度为30℃,前24h,180 r/min振荡培养,随后将转速降到100 r/min,继续培养;发酵20 d,取发酵液5 mL,加入30 mL乙醚,萃取3 次;汇总3次萃取液,真空浓缩,用无水乙醇稀释到一定浓度,并使用GC-MS进行定量分析。2-苯乙醇标准曲线的绘制:取2-苯乙醇梯度稀释到质量浓度分别为10 mg/L、20 mg/L、50 mg/L、80 mg/L、100 mg/L,采用上述GC-MS条件检测不同质量浓度2-苯乙醇(x)的定量离子峰面积(y),绘制2-苯乙醇标准曲线,线性回归得到标准曲线方程为:y=4.514×104x-1.312×105(相关系数R2=0.999 59),按照标准曲线回归方程计算样品中2-苯乙醇含量。
1.3.8 数据及图像处理方法
GC-MS数据处理软件导出GC-MS总离子流色谱图,根据鉴定结果在总离子流色谱图上标注主要检出峰化合物名称。菌株30-2耐盐性能测试及2-苯乙醇定量分析均设置3个平行样,结果显示为“平均值±标准差”()。菌株30-2耐盐性能测试结果的绘图软件为OriginPro 8.0。
2 结果与分析
2.1 产香酵母的分离
从酱油生产不同时间点抽取酱油发酵醪,用0.85%生理盐水稀释,涂布于高盐麦芽汁培养基,30 ℃静置培养60 h,挑取单菌落划线于高盐麦芽汁培养基,进行分离纯化。纯化后菌株采用麦芽汁培养基进行培养,培养条件为30 ℃、150 r/min,发酵4 d后进行香气评价,得到1株可产生独特香气菌株,将其命名为菌株30-2。
2.2 菌株30-2发酵液挥发性风味成分GC-MS鉴定
为了分析菌株30-2 在酱油发酵醪中合成代谢风味物质的种类,将菌株30-2接种到酱油发酵醪培养基中进行发酵培养,发酵产物采用GC-MS分析,总离子流色谱图结果见图1,各挥发性风味成分含量结果见表1。由图1及表1可知,实验组检出了乙醇、异丁醇、异戊醇、3-羟基-2-丁酮、2,3-丁二醇、3-甲硫基丙醇、2-苯乙醇等醇、酮类风味物质;对照组醇、酮类物质仅检出了2-苯乙醇,其峰面积显著低于实验组。结果表明,菌株30-2在酱油发酵醪中具备合成多种醇、酮类风味化合物的能力,其中2-苯乙醇相对峰面积是对照组的14.6倍,显示出其在提升酱油风味中的应用前景。
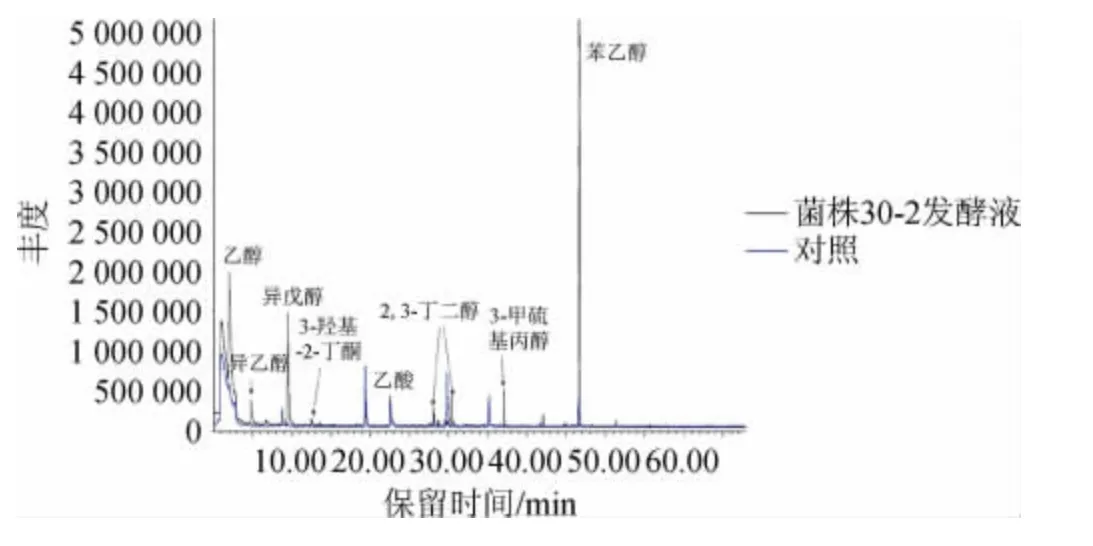
图1 菌株30-2发酵液风味成分GC-MS分析总离子流色谱图Fig.1 Total ion chromatogram of flavor components in fermentation liquid of strain 30-2 by GC-MS analysis
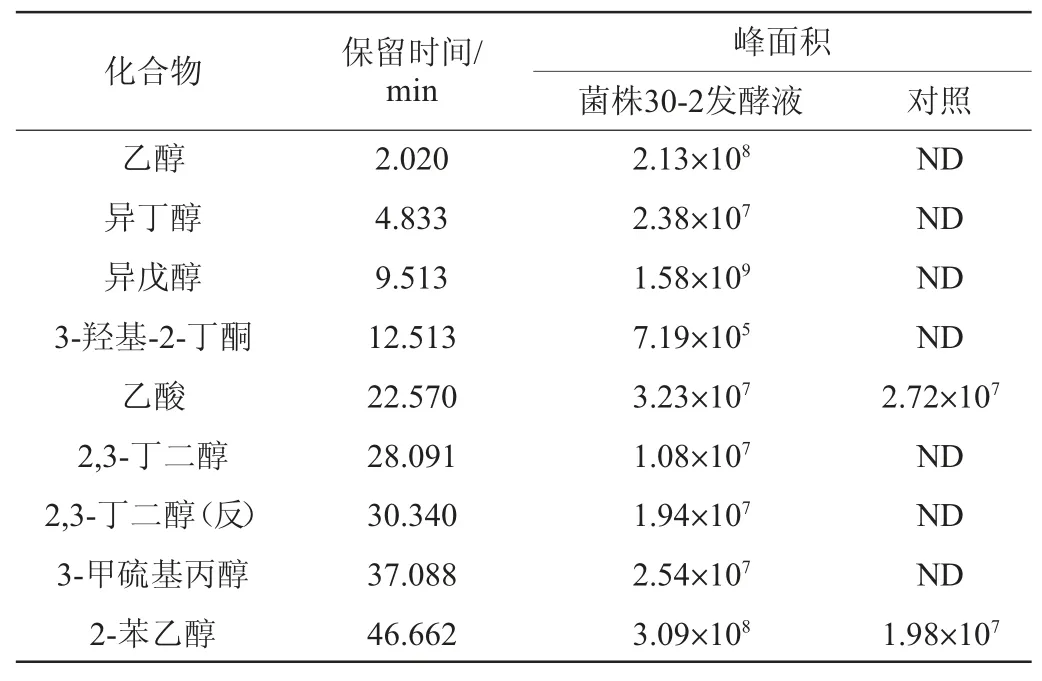
表1 菌株30-2发酵液挥发性风味成分相对含量测定结果Table 1 Determination results of relative content of volatile flavor components in fermentation liquid of strain 30-2
2.3 菌株30-2的形态特征观察
菌株30-2的菌落形态及细胞形态见图2。由图2A可知,菌株30-2在麦芽汁平板上菌落为圆形,边缘整齐,呈米黄色,表明光滑无光泽。由图2B可知,菌株30-2为球形或椭球型,菌体直径为3~8 μm,与酵母属常见菌株的细胞大小接近。
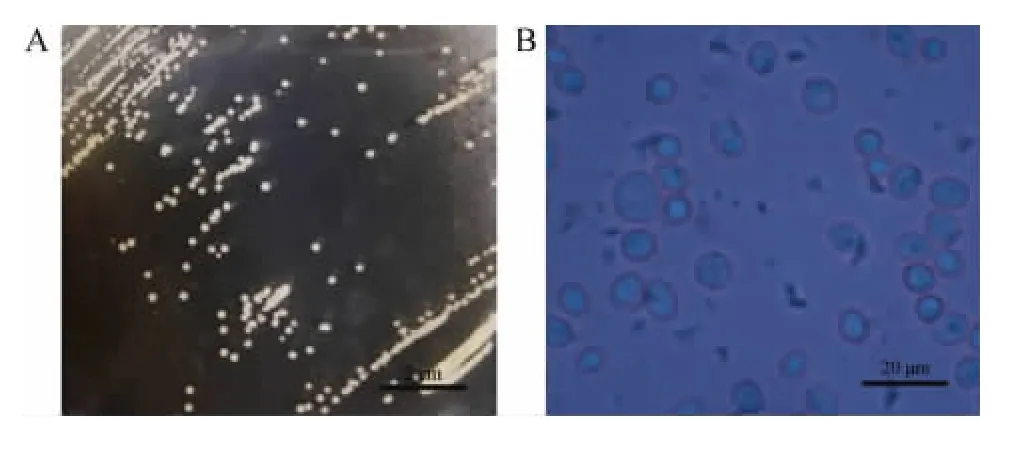
图2 菌株30-2的菌落形态(A)与细胞形态(B)Fig.2 Colonial morphology (A) and cell morphology (B) of strain 30-2
2.4 菌株30-2的生理生化试验
由表2可知,菌株30-2可以发酵葡萄糖,微弱发酵蔗糖;可同化蔗糖、半乳糖、果糖、鼠李糖、甘露醇和山梨醇,微弱同化松三糖和甘油,不能同化赤藓醇、甘油和乙醇,不能利用水杨苷;可同化硝酸盐;在35 ℃、37 ℃培养条件下不生长;可利用50%葡萄糖,可耐受18%氯化钠,在无维生素培养基中生长较弱,脲酶试验阴性。以上结果与《酵母菌的特征与鉴定手册》[21]标准菌株生理生化特征进行比对,初步确定菌株30-2为接合酵母属(Zygosaccharomyces)微生物。
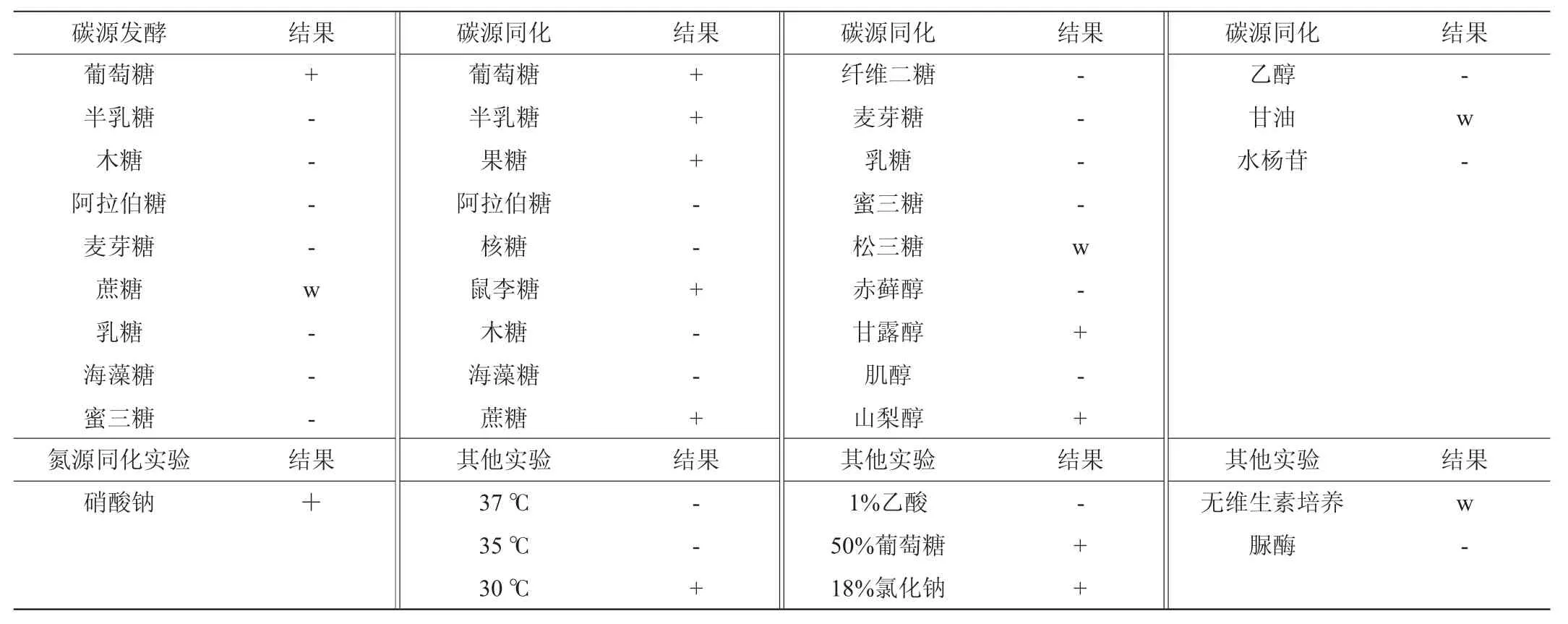
表2 菌株30-2生理生化试验结果Table 2 Physiological and biochemical tests result of strain 30-2
2.5 菌株30-2 ITS rDNA序列PCR扩增与系统进化树构建
采用PCR技术从菌株30-2基因组DNA中扩增出ITS rDNA序列片段,结果见图3。
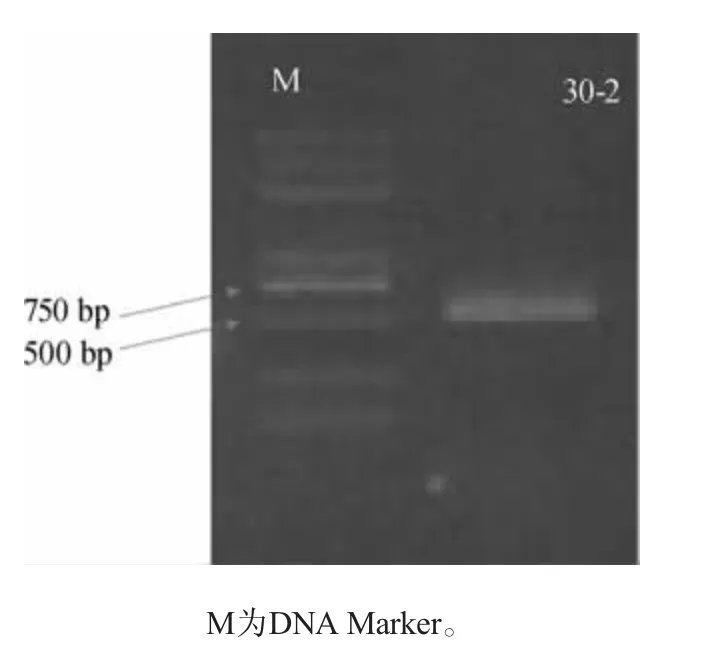
图3 菌株30-2 ITS rDNA序列PCR产物琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of PCR products of strain 30-2 ITS rDNA sequence
由图3可知,PCR产物琼脂糖凝胶电泳显示目标片段长度约为650 bp,PCR扩增产物DNA测序结果显示菌株30-2ITSrDNA序列碱基长度为678bp。对该序列进行BLAST分析,选取同源序列构建系统进化树,结果见图4。由图4可知,菌株30-2与接合酵母Zygosaccharomycessp.聚为一支,二者ITS 序列相似度为99.85%,表明其与Zygosaccha-romycessp.亲缘关系较近。综合形态学观察、生理生化测试和分子生物学鉴定,初步鉴定菌株30-2为接合酵母(Zygosaccharomycessp.)。

图4 基于ITS rDNA序列菌株30-2的系统进化树Fig.4 Phylogenetic tree of strain 30-2 based on ITS rDNA sequences
2.6 菌株30-2耐盐性分析
由图5可知,NaCl质量分数显著影响菌株30-2生长曲线,在NaCl质量分数为5%时,菌株30-2稳定期细胞浓度最高,随着NaCl质量分数的进一步升高,菌株30-2生长受到抑制,稳定期细胞密度呈现下降趋势,延迟期呈现延长趋势;NaCl质量分数提高到18%时,延迟期延长至24 h;不添加NaCl,延迟期最长,为31 h,稳定期细胞浓度也较NaCl质量分数5%~10%时低,说明不加盐不利于菌株30-2生长。上述结果表明菌株30-2具有一定的耐盐性,可以在高含盐(18%NaCl)发酵食品中进行应用测试。
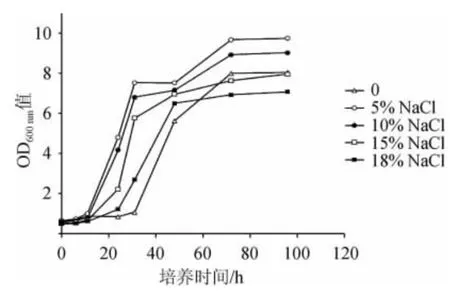
图5 菌株30-2在不同含量的NaCl中生长曲线Fig.5 Growth curves of strain 30-2 in different NaCl contents
2.7 菌株30-2 在不同培养基中2-苯乙醇代谢能力分析
由表3可知,菌株30-2在以(NH4)2SO4为唯一氮源的培养基中,可合成10.6 mg/L 2-苯乙醇,而以苯丙氨酸为唯一氮源时,2-苯乙醇的合成量达到了1 363.1 mg/L,说明艾氏途径是菌株30-2以苯丙氨酸为底物合成代谢2-苯乙醇的主要途径[25]。麦芽汁培养基添加苯丙氨酸的发酵实验发现菌株30-2的2-苯乙醇合成量较对照明显增加,与上述唯一氮源试验结果相近。在缺乏苯丙氨酸的培养条件下,菌株30-2能以(NH4)2SO4为唯一氮源少量合成2-苯乙醇(10.6 mg/L),表明草莽酸途径也是其合成代谢2-苯乙醇的途径之一,但该途径的代谢能力相对较弱。菌株30-2在麦芽汁培养基(不外加苯丙氨酸)中合成2-苯乙醇的质量浓度为113.0 mg/L,说明菌株30-2艾氏途径代谢所需酶蛋白为非诱导型表达。麦芽汁培养基添加苯丙氨酸后,2-苯乙醇的检出量显著增加,较以苯丙氨酸为唯一氮源实验组有一定程度提高,说明充足营养源有利于菌株30-2代谢合成2-苯乙醇。

表3 不同培养基中菌株30-2合成2-苯乙醇含量Table 3 Concentration of 2-phenethyl alcohol synthesized by strain 30-2 in various media
2.8 菌株30-2 在酱油酿造中的应用
采用麦芽汁培养基培养Zygosaccharomycessp.30-2种子液,并接种到酱油发酵醪,发酵60 d 测定发酵醪理化指标及2-苯乙醇含量,结果分别见表4和表5。由表4可知,实验组固形物含量和氨基酸态氮指标与对照组接近;但总酸含量低于对照组,说明菌株30-2添加发酵可以一定程度降低发酵醪总酸,推测菌株30-2具有抑制发酵醪产酸微生物生长代谢的作用。还原糖较对照组有一定幅度降低,推测与菌株30-2代谢利用有关。菌株30-2接种酱油发酵醪发酵20 d,2-苯乙醇质量浓度为40.95 mg/L,是对照组的4.5倍。由表5可知,添加0.5%、1.0%苯丙氨酸后2-苯乙醇质量浓度分别提高到87.15 mg/L、134.55 mg/L。上述结果证实了菌株30-2具备在酱油发酵醪中大量合成2-苯乙醇的能力,添加1.0%苯丙氨酸可使酱油发酵醪中2-苯乙醇质量浓度提高至对照组的14.7倍。实验结果为高浓度2-苯乙醇酱油胚料制备及针对性提高酱油2-苯乙醇含量技术开发提供了新的思路。
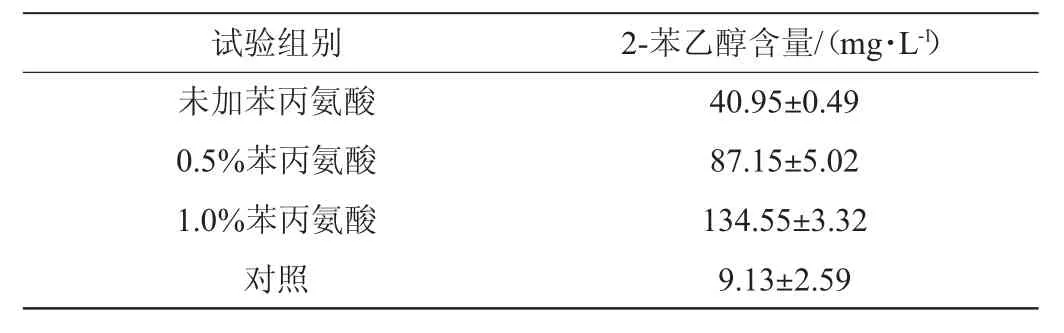
表5 菌株30-2对酱油发酵醪2-苯乙醇含量的影响Table 5 Effect of strain 30-2 on the content of 2-phenethyl alcohol in fermented mash of soy sauce
3 结论
从酱油发酵醪中分离筛选到1 株可耐受18%NaCl的耐盐酵母菌株30-2,其以苯丙氨酸为底物,通过艾氏途径合成2-苯乙醇,在以苯丙氨酸为唯一氮源的培养基中可代谢合成1 363.1 mg/L 2-苯乙醇。经菌落、细胞形态学观察、生理生化试验和分子生物学分析,初步鉴定该菌株为接合酵母(Zygosaccharomycessp.)。菌株30-2 添加酱油发酵醪可抑制发酵醪产酸,并一定程度降低还原糖含量,对发酵液其他理化指标影响不明显。菌株30-2添加酱油发酵可使2-苯乙醇代谢量提高到对照组的4.5倍;外加1.0%苯丙氨酸可使2-苯乙醇质量浓度进一步提高至对照组的14.7倍;说明其在酱油等高盐发酵调味品特征风味物质2-苯乙醇提升及风味改善方面有较大的应用前景。
