高效液相色谱法测定可溶微针贴片中蜂毒肽的含量
2020-06-06董智勇李莹莹陈远政徐雨靓王清清蚌埠医学院药学院药物分析教研室蚌埠233000通讯作者mailmailtoQingqingwangbbmceducn
董智勇,李莹莹,魏 芳,陈远政,刘 航,徐雨靓,马 涛,王清清(蚌埠医学院药学院药物分析教研室,蚌埠 233000;通讯作者,E-mail:mailto:Qingqingwang@bbmc.edu.cn)
可溶微针(dissolving microneedles,DMNs)是一种新型的透皮药物递送系统,可刺穿角质层以增加药物渗透,其微米大小可避免疼痛而不会影响血管和感觉神经末梢。DMNs由水溶性或可生物降解的聚合物组成,插入皮肤内的微针针部释放封装的药物,同时在皮肤中彻底溶解或降解,而不会产生生物危害性废物[1]。
蜂毒肽(melittin,Mel)是蜂毒的主要成分,也是蜂毒中具药理作用和生物学活性的主要组分,其由26个氨基酸残基构成的线性多肽,分子量为2 840 Da,其一级结构的氨基酸残基顺序为NH2-GLY-ILE-GLY-ALA-VAL-LEU-LYS-VAL-LEU-THR-THR-GLY-LEU-PRO-ALA-LEU-ILE-SER-TRP-ILE-LYS-ARG-LYS-ARG-GLN-GLN-COOH[2]。蜂毒肽属于生物大分子类药物,与传统的小分子相比,这些药物的特点是分子量高,结构不稳定,难以通过生物膜。目前,越来越多的研究已通过利用DMNs经皮递送各种生物药物大分子药物,包括疫苗(抗原),蛋白质(抗体、细胞因子、激素[3]、肽),多糖[4]和核酸[5]等,研究表明利用DMNs经皮递送生物大分子显示出令人信服的优势和前景[6,7]。
目前,已有研究表明可以采用高效液相色谱法(HPLC)测定可溶微针贴片中小分子类药物的含量[8,9]。但是关于可溶微针贴片中蛋白质含量测定的报道却很少,所以本文选取蜂毒肽为模型药物,利用高效液相色谱法(HPLC)测定可溶微针贴片中蜂毒肽的含量。通过方法学验证,保证其结果准确可靠,旨在为测定该种新剂型中大分子药物的质量研究提供一定的理论依据。
1 仪器与试药
1.1 仪器
高效液相色谱仪(LC-15C,日本岛津);双光束紫外可见分光光度计(TU-1901,北京普析通用仪器有限责任公司);超声波清洗器(KQ5200B,昆山市超声仪器有限公司);十万分之一电子分析天平(XP 205型,梅特勒-托利多公司);纯水仪(Advantage A10,Milli-Q公司)。
1.2 试药
可溶微针贴片(本课题组自制);蜂毒肽(melittin)对照品(Mel,上海楚肽生物科技有限公司,批号:P181225-ZL257594);透明质酸(HA,华熙福瑞达生物医药有限公司,批号:1510081);聚乙烯基吡咯烷酮(PVP K90,德国BASF,批号:L96014768E0);乙腈(上海麦克林生化科技有限公司,色谱纯);水为超纯水;其余所用试剂均为分析纯。
1.3 方法
1.3.1 色谱条件 色谱柱:Unitary C185 μm 100A(4.6 mm×250 mm);流动相:A相为0.1%TFA水溶液,B相为0.1%TFA乙腈溶液。采用梯度洗脱,洗脱程序如下:0-25 min,10%-90%B;25-28 min,90%-10%B;28-30 min,保持10%B,洗脱程序共30 min。流速1.0 ml/min,柱温30 ℃,检测波长220 nm,进样量20 μl。
1.3.2 溶液处理与样品制备 蜂毒肽对照溶液:精密称取蜂毒肽对照品粉末25.1 mg,置于100 ml容量瓶中,用新沸冷却后的超纯水(脱氧水)溶解并定容至刻度,配制浓度为251 μg/ml的蜂毒肽储备液。并用新沸冷却后的超纯水(脱氧水)稀释成适宜浓度的对照品溶液(Mel-solution)。
制针辅料溶液:分别精密称取HA,PVP K90各100 mg,置于100 ml容量瓶中,用新沸冷却后的超纯水(脱氧水)配制成1 mg/ml可溶微针制针辅料储备液,并稀释成适宜浓度的HA和PVP K90溶液。
供试品溶液:参考文献[8,9],用刀片将微针针部取下来,溶于1 ml新沸冷却后的超纯水(脱氧水)中,作为供试品溶液。
2 结果
2.1 专属性试验
取1.3.2项下制备的4种溶液(蜂毒肽对照品、HA、PVP K90、供试品液),按照1.3.1项色谱条件进样分析,制针辅料溶液色谱图在与蜂毒肽对照品溶液色谱相应的位置上无色谱峰出现,而可溶微针贴片水溶液与蜂毒肽溶液色谱相应的位置上有相同的色谱峰出现(见图1)。表明在此色谱条件下,制针辅料对蜂毒肽含量测定无干扰。
2.2 线性试验
精密吸取1.3.2项下制备的蜂毒肽对照品储备液0.4,0.8,2.0,3.2,4.0,6.0,8.0,10 ml,分别置于10 ml容量瓶中,用超纯水定容,得到浓度为10.04,20.08,50.02,80.32,100.4,150.6,200.8,251.0 μg/ml的一系列蜂毒肽标准工作液。进入高效液相色谱仪分析,以蜂毒肽浓度为横坐标,峰面积为纵坐标,绘制标准曲线,线性回归方程为:Y=16 564x-41 732,R2=0.999 6。结果表明,蜂毒肽在10.04-251.0 μg/ml范围内与峰面积呈良好的线性关系(见图2)。
2.3 精密度试验
2.3.1 日内精密度试验 取浓度为10.04,50.2,200.8 μg/ml的蜂毒肽标准工作液,按1.3.1项下色谱条件连续测定3次,每次进样20 μl。记录峰面积,3个浓度的日内精密度RSD均小于2%,平均RSD值为0.9%(见表1)。表明本实验建立的方法日内精密度较好。
2.3.2 日间精密度试验 取浓度为10.04,50.2,200.8 μg/ml的蜂毒肽标准工作液,按1.3.1项下色谱条件,于3 d内每天的相同时段连续进样3次。记录峰面积,3个浓度的日间精密度RSD均小于2%,平均RSD值为1.6%(见表2)。表明本实验建立的方法日间精密度较好。
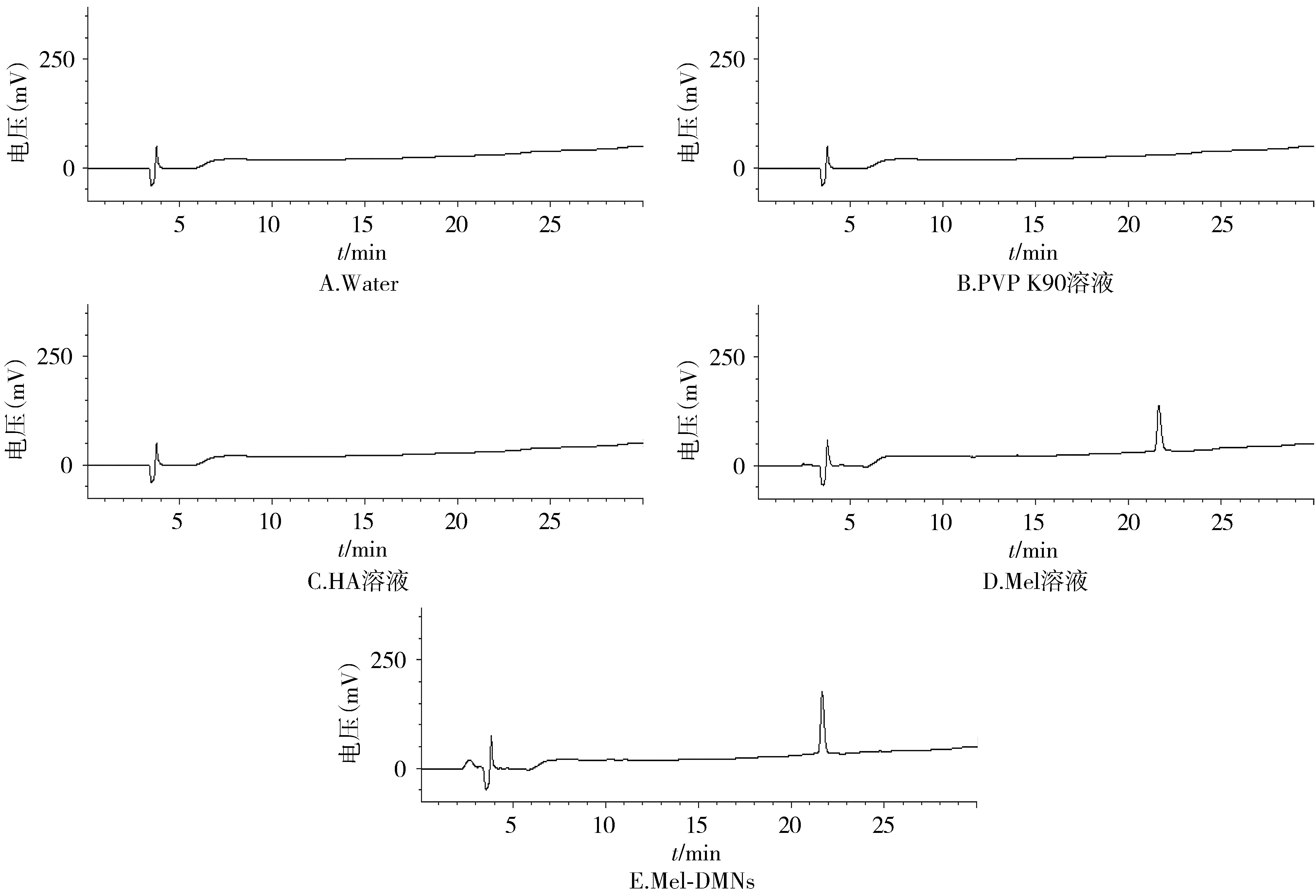
图1 Water、PVP K90、HA、Mel和Mel-DMNs的专属性试验色谱图Figure 1 Specificity chromatograms of Water, PVP K90,HA,Mel solution,Mel-DMNs

图2 蜂毒肽的标准曲线Figure 2 The calibration curve of melittin
2.4 加样回收率试验
按1.3.2项下方法配制各种贮备液,取1.3.1项下的蜂毒肽、HA和PVP K90储备液,参考前期研究[8,9]配制药物辅料混合液,蜂毒肽与混合辅料浓度比为1∶20,1∶10,1∶5,其中混合辅料浓度保持不变,总浓度为200 μg/ml,各辅料均为100 μg/ml,蜂毒肽浓度分别为21.2,42.4,84.8 μg/ml。药物辅料混合液注入高效液相色谱仪进样分析,记录峰面积,代入回归方程计算浓度,蜂毒肽的平均加样回收率在98.9%-106.1%之间,RSD值小于2%(见表3)。

表1 蜂毒肽检测方法的日内精密度Table 1 Intraday precision results of melittin detection method

表2 蜂毒肽检测方法的日间精密度Table 2 Interday precision results of melittin detection method

表3 蜂毒肽的加样回收率试验结果Table 3 Recovery result of determination of melittin
2.5 重复性试验
取6片同一批制备的蜂毒肽可溶微针贴片,按照1.3.2项分别制备成供试品溶液,进样分析,计算每片微针贴片针部蜂毒肽的载药量,可溶微针贴片中蜂毒肽的平均载药量为205.2 μg,RSD为0.8%(n=6),表明方法重复性良好。
2.6 稳定性考察
取2.5项下某一供试品溶液,分别于0,1,2,4,8,12,24 h进样,记录蜂毒肽峰面积,峰面积RSD为1.48%(n=6),表明蜂毒肽供试品溶液在24 h内较稳定。
3 讨论
3.1 波长的选择
目前也有关于紫外可见分光光度法和高效液相色谱法测定蜂毒肽及制剂中蜂毒肽含量的研究[10-12]。前期实验采用紫外可见分光光度计对蜂毒肽对照品溶液和制备微针所需辅料溶液进行全光谱扫描,结果发现蜂毒肽在220 nm和280 nm处有最大吸收,但280 nm处测得蜂毒肽的峰面积与220 nm相比较低,前者仅为后者的十分之一,220 nm结果显示蜂毒肽专属性良好,故检测波长选择220 nm。
3.2 蜂毒肽溶液的配制及保存条件
参考文献报道的蜂毒肽的配制方法及保存条件[13],因为脱氧水能够抑制蜂毒肽的结构变化和氧化反应,故实验采用新沸后冷却的超纯水配制蜂毒肽对照品溶液及供试品溶液。本实验中蜂毒肽的稳定性考察是将供试品溶液保存于4 ℃冰箱24 h,不同时间点测定其蜂毒肽的含量,其结果显示蜂毒肽溶液在24 h内较稳定。故配制完成的溶液均保存于4 ℃冰箱中,测定时取出备用。
3.3 含量测定方法比较
参考文献中报道的蛋白质多肽类药物的含量测定方法有考马斯亮蓝法(Bradford)、酚试剂法(Lowry)、二喹琳甲酸法(BCA)[14]和高效液相色谱法(HPLC)[15]。其中前三种方法是利用蛋白质与特定物质显色的特性测定蛋白质和多肽类药物的含量,但由于实验过程中蛋白质多肽类药物的溶剂或添加剂、剂型中的辅料影响可能会对显色结果的正确性造成影响[14]。而高效液相色谱法(HPLC)由于其专属性好、灵敏度高、操作简单等优点常被用来测定测定蛋白质多肽类药物的含量,在测定其含量时可以通过调节流速、流动相的酸度、有机相的种类等方法达到分离药物与杂质或者辅料的目的[16],实验结果准确可靠。
4 结论
本文建立了HPLC法测定可溶微针贴片中蜂毒肽的含量,此方法简便、准确、重现性好、精密度高、选用的制针材料对测定蜂毒肽的含量无干扰,可作为可溶微针贴片中蜂毒肽含量测定的质量控制方法,并为微针中蛋白质类等生物大分子药物的含量测定提供理论基础。
